




- 6.1.2 化学反应与电能(精品课件) 课件 26 次下载
- 6.1.3 化学电源(精品课件) 课件 27 次下载
- 6.2.2 探究影响化学反应速率的因素(精品课件) 课件 30 次下载
- 6.2.3 化学反应的限度(精品课件) 课件 27 次下载
- 7.1.1 有机化合物中碳原子的成键特点(精品课件) 课件 28 次下载
2021学年第六章 化学反应与能量第二节 化学反应的速率与限度备课课件ppt
展开不同的化学反应进行的快慢千差万别,快与慢是相对而言的,是一种定性的比较。在科学研究和实际应用中,对化学反应进行的快慢进行定量的描述或比较时,要使用同一定义或标准下的数据。与物理学中物体的运动快慢用速率表示类似,化学反应过程进行的快慢用反应速率来表示。
第一课时 化学反应速率
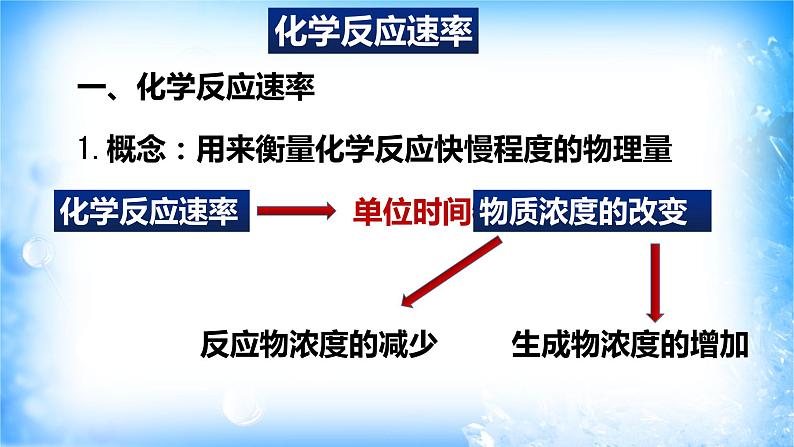
1.概念:用来衡量化学反应快慢程度的物理量
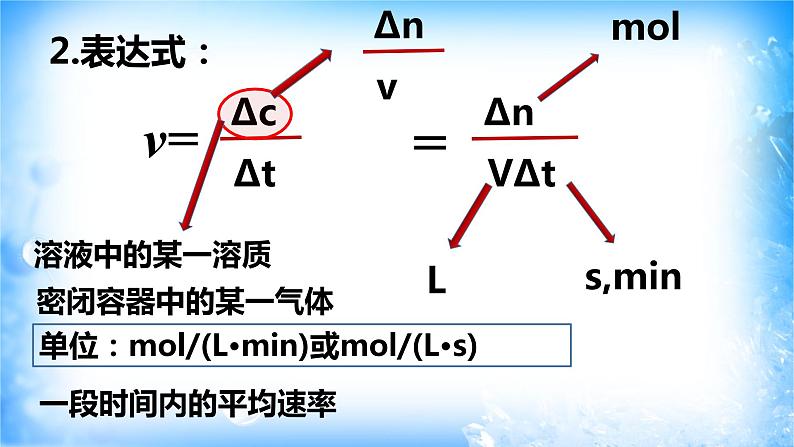
单位时间物体运动的位移
单位:ml/(L·min)或ml/(L·s)
例1.在某一化学反应中,反应物A的浓度在10s内从0.8ml·L-1变为0.2ml·L-1,则在这10s内A的化学反应速率为( )
10s内A的化学反应速率为(0.8 ml.L-1-0.2 ml.L-1)÷10s=0.06 ml.L-1.s-1
例2:.一定温度下,在一容积为2L的密闭容器中加入1mlN2和3mlH2,在五分钟时生成了0.2mlNH3,求v(N2),v(H2),v(NH3)
变化
起始 1ml 3ml
v(H2)=0.03ml/L·min
v(N2)=0.01ml/L·min
v(NH3)=0.02ml/L·min
化学反应速率之比等于化学计量数之比
例3.将10mlH2和5mlN2放入10L真空容器内,某温度下发生反应:3H2+N2 2NH3 。在最初的0.2s内,消耗H2的平均速率为0.06ml·L-1·s-1,则在0.2s末,容器中NH3的物质的量为
v(H2):v(NH3)=3:2
v(NH3)=0.04 ml·L-1·s-1,
NH3的起始物质的量为0 ml
0.2s末时,n(NH3)=0.08 ml
Δn(NH3)=0.04 ml·L-1·s-1×0.2s×10L=0.08 ml
3A(g)+B(g)=2C(g)
对于反应3A(g)+B(g)=2C(g),在不同条件下,用A、B表示的反应速率分别为条件①v(A)=0.6 ml·L-1·min-1;条件②v(B)=0.45 ml·L-1·min-1;比较反应在条件①和条件②的速率快慢
v(A)=0.6 ml·L-1·min-1
v(B)=0.45 ml·L-1·min-1
v(B)=0.2 ml·L-1·min-1
提示:比较不同过程反应速率,转变成同一物质的速率进行比较
例4.反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.45ml·L-1·min-1 ②v(B)=0.6ml·L-1·s-1 ③v(C)=0.4ml·L-1·s-1 ④v(D)=0.45ml·L-1·s-1则该反应速率的快慢顺序为( )A.④>③=②>① B.④<③=②<①C.①>②=③>④ D.④>③>②>①
比较同一个化学反应的反应速率的相对大小时,应先转化为同一物质、同一单位,然后再比较其数值大小,数值越大表明反应越快。
固体、纯液体有浓度变化吗?
Zn + 2H+ = Zn2+ + H2
一定时间内固体质量的减少
一定时间内生成气体体积的大小
化学反应速率是指一段时间内的平均速率,而不是指某一时刻的瞬时反应速率。
同一反应,用不同物质表示的反应速率其数值可能不同,但表示的意义相同,即表示整个化学反应进行的快慢,故表示一个化学反应的反应速率时,必须指明是用哪种物质来表示。
同一化学反应中,用不同反应物或生成物表示的反应速率(单位一致)之比等于各物质的化学计量数之比,也等于各物质的浓度变化量之比。
不用固体或纯液体表示化学反应速率
1、下列有关化学反应速率的说法正确的是( )A.对任何化学反应来说,反应速率越大,反应现就越明显B.化学反应速率是衡量化学反应进行的快慢的物理量C.化学反应速率为0.5 ml·L-1.s-1,就是指在1s时某物质的浓度为0.5ml·L-1D.化学反应速率通常用单位时间内任何一种反应物浓度的减少量或任何一种生成物浓度的增加量来表示
化学反应速率是平均反应速率而不是瞬时速率,C项错误;
化学反应速率用来定量表示化学反应进行的快慢,B项正确;
有些反应的反应速率很快,但反应现象不明显,如酸碱中和反应等,反应速率小的反应现象可能明显,如铁生锈等,A项错误;
一般不用固体和纯液体来表示化学反应速率,D项错误
2、1 L的密闭容器中,发生反应4A(s)+3B(g)=2C(g)+D(g),经2 min后B的浓度减少0.6 ml·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4 ml·L-1·min-1B.用B、C、D分别表示反应的速率,其比值是3∶2∶1C.在2 min末的反应速率用B表示是0.3 ml·L-1·min-1D.在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大
A为固体,一般不用固体表示反应速率,A项错误;同一反应中,用不同物质表示的速率与方程式中各物质的计量数成正比,B项正确;反应速率为平均值,并非2 min末的速率,C项错误;同一时间段内,用反应物、生成物表示的速率的意义是相同的,变化趋势也是一样的,D项错误。
3、一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对该反应的推断合理的是( )
A.该反应的化学方程式为3B+4D 6A+2CB.反应进行到1 s时,v(A)=v(D)C.反应进行到6 s时,B的平均反应速率为0.05 ml·L-1·s-1D.反应进行到6 s时,各物质的反应速率相等
Δn(A)∶Δn(B)∶Δn(C)∶Δn(D)=(1.2-0)ml∶(1.0-0.4)ml∶(1.0-0.2) ml∶(0.4-0) ml=6∶3∶4∶2,所以化学方程式为3B+4C 6A+2D,A错误;不论在什么时刻,用各物质表示的速率之比等于化学计量数之比,B、D错误。
人教版 (2019)必修 第二册第二节 化学反应的速率与限度精品作业ppt课件: 这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度精品作业ppt课件,文件包含621化学反应速率课件pptx、621化学反应速率分层作业含解析docx、621化学反应速率分层作业无答案docx等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文ppt课件: 这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文ppt课件,共27页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度备课课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度备课课件ppt,共1页。














