









高三化学二轮复习-专题三 氧化还原反应学案
展开专题三 氧化还原反应
1.了解氧化还原反应的本质是电子转移,了解常见的氧化还原反应。2.掌握常见氧化还原反应的配平和相关计算。
考纲要求
内容索引
考点一 氧化还原反应的概念辨析
考点二 氧化还原反应的基本规律及应用
考点三 信息型氧化还原反应方程式的书写
考点四 氧化还原反应的综合应用
考点一 氧化还原反应的概念辨析
1.跳出“五大”误区(1)误认为有单质参与或生成的反应一定是氧化还原反应。如O2与O3的转化为非氧化还原反应。(2)误认为元素由化合态变为游离态一定被还原,其实不一定。如HCl―→ Cl2,氯元素被氧化,CuO―→ Cu,铜元素被还原。(3)误认为氧化还原反应中有一种元素被氧化,则一定有另一种元素被还原,其实不一定。如Cl2+H2OHCl+HClO中,被氧化和被还原的都是氯元素。
(4)误认为具有氧化性的物质和具有还原性的物质一定都能发生化学反应,其实不一定。如SO2具有还原性,浓H2SO4具有氧化性,但二者不发生氧化还原反应。(5)误认为同种元素的高价态的物质一定比低价态物质的氧化性强,其实不一定,如HClO的氧化性高于HClO4。
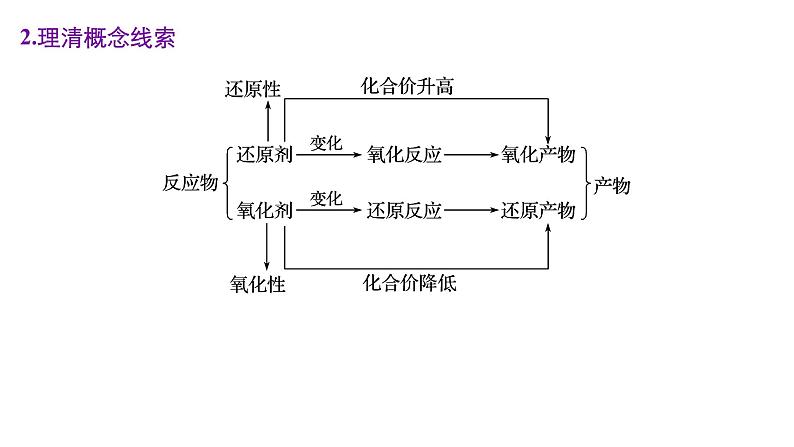
2.理清概念线索
1
2
3
4
题组一 理解氧化还原反应相关概念1.正误判断,正确的划“√”,错误的划“×”。(1)室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。所以Fe3+的氧化性比I2的强 (2016·江苏,13C)( )(2)Cl2+2Br-===2Cl-+Br2、Zn+Cu2+===Zn2++Cu均为单质被还原的置换反应 (2014·山东理综,7C)( )(3)2Na2O2+2H2O===4NaOH+O2↑、Cl2+H2O===HCl+HClO均为水作还原剂的氧化还原反应 (2014·山东理综,7D)( )
√
×
×
答案
答案
(4)因为Fe3+具有氧化性,所以用KSCN溶液可以鉴别Fe3+( )(5)化合反应均为氧化还原反应( )
×
×
1
2
3
4
2.(2016·上海,2)下列化工生产过程中,未涉及氧化还原反应的是( )A.海带提碘 B.氯碱工业C.氨碱法制碱 D.海水提溴解析 A项,海带提碘是由KI变为I2,有元素化合价的变化,属于氧化还原反应,错误;B项,氯碱工业是由NaCl的水溶液在通电时反应产生NaOH、Cl2、H2,有元素化合价的变化,属于氧化还原反应,错误;C项,氨碱法制取碱的过程中没有元素化合价的变化,是非氧化还原反应,正确;D项,海水提溴是由溴元素的化合物变为溴元素的单质,有元素化合价的变化,属于氧化还原反应,错误。故选项C正确。
解析
√
1
2
3
4
解析
题组二 基于“双线桥”分析陌生反应3.(2016·上海,13)O2F2可以发生反应:H2S+4O2F2―→ SF6+2HF+4O2,下列说法正确的是( )A.氧气是氧化产物B.O2F2既是氧化剂又是还原剂C.若生成4.48 L HF,则转移0.8 mol电子D.还原剂与氧化剂的物质的量之比为1∶4
√
1
2
3
4
解析 A项,O元素的化合价由反应前的+1价变为反应后的0价,化合价降低,获得电子,所以氧气是还原产物,错误;B项,在反应中O2F2中的O元素的化合价降低,获得电子,所以该物质是氧化剂,而H2S中的S元素的化合价是-2价,反应后变为SF6中的+6价,所以H2S是还原剂,错误;C项,外界条件不明确,不能确定HF的物质的量,所以不能确定转移电子的数目,错误;D项,根据化学方程式可知还原剂H2S与氧化剂O2F2的物质的量之比是1∶4,正确。
1
2
3
4
解析
4.Na2S2O3是重要的化工原料,用途很广,其还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,主要用于治疗氰化物中毒。工业上可利用反应Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是( )A.Na2S2O3只有还原性B.氧化产物与还原产物的物质的量之比为2∶1C.每生成1 mol Na2S2O3,转移4×6.02×1023个电子D.标准状况下,每吸收4 mol SO2就会放出22.4 L CO2
√
方法技巧
返回
1
2
3
4
解析 在反应物Na2S中S的化合价为-2,在SO2中S的化合价为+4,反应后产生的物质Na2S2O3中S的化合价为+2,介于-2与+4之间,因此Na2S2O3既是氧化产物,又是还原产物。A项,Na2S2O3中S的化合价为+2,属于S的中间价态,则Na2S2O3既有氧化性,又有还原性,错误;B项,根据题意可知反应中氧化剂SO2与还原剂Na2S的物质的量之比为4∶2=2∶1,氧化产物与还原产物的物质的量之比为1∶2,错误;C项,由题给化学方程式可知,每生成3 mol Na2S2O3,转移8 mol电子,则生成1 mol Na2S2O3,转移 mol电子,错误;
解析
方法技巧
1
2
3
4
D项,根据反应方程式可知消耗的SO2与产生的CO2的物质的量之比是4∶1,由于在相同条件下,气体的物质的量之比等于气体的体积之比,所以在相同条件下,每吸收4 mol SO2就会放出22.4 L(标准状况)CO2,正确。
方法技巧
1
2
3
4
方法技巧
理解概念抓实质,解题应用靠特征,即从氧化还原反应的实质——电子转移去分析理解有关的概念,而在实际解题过程中,应从分析元素化合价有无变化这一氧化还原反应的特征入手。具体方法是找变价、判类型、分升降、定其他。其中“找变价”是非常关键的一步,特别是不同反应物中含有同种元素的氧化还原反应,必须弄清元素化合价的变化情况。
返回
1
2
3
4
考点二 氧化还原反应的基本规律及应用
1.性质强弱规律物质氧化性、还原性的强弱取决于元素得失电子的难易程度,与得失电子的数目无关,可从“热>冷”(温度)、“浓>稀”(浓度)、“易>难”(反应条件、剧烈程度),以及金属活动性顺序表、元素在周期表中的位置、原电池原理、电解池中离子的放电顺序等角度判断;还要学会从化学反应方向的角度判断“剂>物”(同一反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性)。
2.反应先后规律同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性较强的物质;同一还原剂与含多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性较强的物质,即强者优先反应。3.价态归中规律即同种元素不同价态之间的反应,高价态的元素化合价降低,低价态的元素化合价升高,但升高与降低的化合价不能交叉。如:KClO3+6HCl===3Cl2↑+KCl+3H2O,氧化剂:KClO3,还原剂:HCl,氧化产物:Cl2,还原产物:Cl2。
4.邻位价态规律氧化还原反应发生时,其价态一般先变为邻位价态。如:(1)Cl-被氧化成Cl2,而不是更高价态氯元素。(2)S2-一般被氧化为S,S单质一般被氧化成SO2。(3)ClO-、ClO 作氧化剂、Cl-作还原剂时,一般被还原成Cl2,而不是Cl-。5.电子守恒规律对于有关氧化还原反应的计算,关键是氧化还原反应的实质——得失电子守恒,列出守恒关系求解,即n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值。
解析
1
2
3
4
5
6
7
题组一 性质强弱规律的应用(一)由方程式判断强弱1.已知常温下,在溶液中可发生如下反应:Ce4++Fe2+===Fe3++Ce3+,Sn2++2Fe3+===2Fe2++Sn4+。由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是( )A.Sn2+、Fe2+、Ce3+ B.Fe2+、Ce3+、Sn2+C.Fe2+、Sn2+、Ce3+ D.Ce3+、Fe2+、Sn2+
√
解析 根据氧化还原反应中还原剂的还原性大于还原产物的还原性,由两个方程式可以得到还原性强弱顺序:Fe2+>Ce3+,Sn2+>Fe2+。故A项正确。
1
2
3
4
5
6
7
解析
(二)依据强弱顺序判断反应是否发生2.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )A.3Cl2+6FeI2===2FeCl3+4FeI3B.Cl2+FeI2===FeCl2+I2C.Co2O3+6HCl===2CoCl2+Cl2↑+3H2OD.2Fe3++2I-===2Fe2++I2
√
1
2
3
4
5
6
7
解析 Fe3+能氧化I-,所以不可能生成FeI3,A错,D对;B项,当Cl2少量时,I-先被氧化;C项,由于Co2O3的氧化性强于Cl2的,所以Co2O3能氧化Cl-得到Cl2,而Co2O3被还原为Co2+。
1
2
3
4
5
6
7
解析
(三)相互竞争的反应3.已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为aFe2++bBr-+cCl2―→ dFe3++eBr2+fCl-下列选项中的数字与离子方程式的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )A.2 4 3 2 2 6 B.0 2 1 0 1 2C.2 0 1 2 0 2 D.2 2 2 2 1 4
√
1
2
3
4
5
6
7
解析 Cl2先氧化Fe2+;A项,Cl2过量;C项,Cl2少量;D项,FeBr2和Cl2等量。
1
2
3
4
5
6
7
解析
4.向含有SO 、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是( )
√
规律总结
1
2
3
4
5
6
7
第二步:审图示信息
解析
规律总结
1
2
3
4
5
6
7
解析
规律总结
1
2
3
4
5
6
7
规律总结
1
2
3
4
5
6
7
规律总结
正确运用有关氧化性、还原性强弱的比较规律,对于提高解题能力有很大帮助。有关物质的氧化性或还原性的比较可以从多个角度进行考查,涉及的知识面很广,常考的判断依据:(1)根据金属活动性顺序比较。①金属活动性顺序:金属单质的还原性从K→Au逐渐减弱,其对应离子的氧化性从K+→Au2+逐渐增强。②非金属活动性顺序:一般某元素的非金属性越强,对应单质的氧化性越强,对应非金属离子的还原性越弱。
规律总结
1
2
3
4
5
6
7
(2)根据原电池两极和电解池两极的放电顺序进行判断。原电池中,活动性较强的金属作负极,活动性较弱的金属作正极;电解池中,阳极上物质的放电顺序即为对应物质还原性由强到弱的顺序,阴极上的阳离子放电顺序即为阳离子氧化性由强到弱的顺序。
1
2
3
4
5
6
7
解析
题组二 守恒规律的灵活应用(一)根据“守恒”进行计算5.在100 mL含等物质的量的HBr和H2SO3的溶液中通入0.025 mol Cl2,有一半Br-变为Br2。则原溶液中HBr和H2SO3的浓度都等于( )A.0.16 mol·L-1 B.0.02 mol·L-1C.0.20 mol·L-1 D.0.25 mol·L-1
√
1
2
3
4
5
6
7
解析 还原性H2SO3>HBr,氯气先氧化H2SO3,H2SO3完全反应后,氯气有剩余,剩余氯气再氧化HBr。设浓度为c mol·L-1,由电子转移守恒可知,0.1c×2+0.1c×0.5=0.025×2,解得c=0.2,故C正确。
1
2
3
4
5
6
7
解析
6.(2016·上海,17)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。x值为( )A.0.80 B.0.85 C.0.90 D.0.93
√
答题模板
1
2
3
4
5
6
7
答题模板
步骤1 找物质找出氧化剂、还原剂及相应的还原产物和氧化产物;步骤2 定得失确定一个原子或离子得失电子数(注意化学式中的原子个数);步骤3 列等式根据题中物质的物质的量和得失电子守恒列出等式;步骤4 找关系对于多步连续进行的氧化还原反应,只要中间各步反应过程中没有损耗,可直接找出起始物和最终产物,删去中间产物,建立二者之间的电子守恒关系,快速求解。
1
2
3
4
5
6
7
解析答案
(二)根据守恒进行配平7.(1)[2015·浙江理综,27Ⅰ(4)]完成以下氧化还原反应的离子方程式:
2
5
16H+
2
10
8H2O
1
2
3
4
5
6
7
解析答案
(2)[2015·天津理综,10(2)②]完成NaClO3氧化FeCl2的离子方程式:
1 6 6 H+ 1 6 3
H2O
1
2
3
4
5
6
7
答案
(3)[2015·安徽理综,27(2)]请配平化学方程式:
1 2 4 2 1 2
1
2
3
4
5
6
7
答案
(4)[2016·天津理综,9(4)]配平反应的方程式:MnO(OH)2+I-+H+―→ Mn2++I2+H2O,其化学计量数依次为_________。
1,2,4,1,1,3
方法技巧
教学忠告
返回
1
2
3
4
5
6
7
方法技巧
氧化还原反应方程式的配平可依据“得失电子守恒、电荷守恒和质量守恒”顺利解答,有关氧化还原反应化学方程式的配平应掌握:(1)配平步骤标变价→列变化→求总数→配系数→细检查。(2)配平方法①正向配平法:如果被氧化、被还原的元素分别是两种不同的反应物,通常从方程式左边进行配平;②逆向配平法:对于自身氧化还原反应或反应物只有一种,一般从方程式右边配平较简便;
方法技巧
教学忠告
1
2
3
4
5
6
7
教学忠告
③缺项配平法:这类方程式通常少写一种反应物或生成物(通常这种物质既不是氧化剂、还原剂,也不是氧化产物或还原产物)的化学式,要求确定其化学式。此类反应可先确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,最后由质量守恒、电荷守恒确定所缺物质(分子或离子)的化学式和化学计量数。
1
2
3
4
5
6
7
教学忠告
在近几年的高考中,氧化还原方程式配平不准的常见原因有:(1)化合价判断不准。近几年高考中常考的一些特殊物质中元素化合价如下:CuFeS2:Cu(+2)、Fe(+2)、S(-2)K2FeO4:Fe(+6) Li2NH:N(-3)LiNH2:N(-3) AlN:N(-3)Na2S2O3:S(+2) C2O :C(+3)HCN:C(+2)、N(-3) CuH:Cu(+1)、H(-1)FeO :Fe[+(8-n)] Si3N4:Si(+4)、N(-3)
教学忠告
1
2
3
4
5
6
7
(2)依据电子得失守恒列等式时忽视变价原子的个数。(3)缺项氧化还原方程式配平时,“ ”中或“________”上的化学计量数“1”容易忽略、漏掉。
返回
1
2
3
4
5
6
7
考点三 信息型氧化还原反应方程式的书写
信息型氧化还原反应方程式的书写涉及元素化合价的变化。虽参加反应的物质比较陌生,但可依据氧化还原的得失电子守恒思想,写出主要反应物和产物,再根据溶液的性质,补上适当的反应物或生成物。具体步骤如下:1.根据题中信息,确定氧化剂和还原剂,氧化产物和还原产物。2.运用电子守恒和元素守恒快速配平。
例 铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐为重要化合物。高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________________________________________________。第一步:根据题给信息和所学知识列出反应式:氧化剂+还原剂——还原产物+氧化产物;
第二步:根据电子守恒确定上述式子“氧化剂+还原剂——还原产物+氧化产物”中各物质的化学计量数;
第三步:根据电荷守恒,结合介质的酸碱性,在反应方程式两端添加H+、OH-,使之满足电荷守恒的要求;
第四步:根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒;配平后的反应:
第五步:检查并确定离子方程式。
答案
1
2
3
4
5
6
7
1.[2016·全国卷Ⅲ,27(2)①]煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,写出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________________________。
答案
1
2
3
4
5
6
7
+4H2O
答案
1
2
3
4
5
6
7
答案
4.[2016·全国卷Ⅰ,28(2)]写出“反应”步骤中生成ClO2的化学方程式_______________________________________。
2NaClO3+H2SO4+SO2===2NaHSO4+2ClO2
1
2
3
4
5
6
7
5.(2016·上海,24)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2,已知HCN、HOCN中N元素的化合价相同,则反应的离子方程式:__________________________________________。
答案
1
2
3
4
5
6
7
答案
6.工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O 被还原成Cr3+。写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式_________________________________________。
1
2
3
4
5
6
7
答案
7.碱性条件下用NaClO处理含CN-的废水,生成一种无毒气体,该反应的离子方程式:_______________________________________________。
返回
1
2
3
4
5
6
7
考点四 氧化还原反应的综合应用
在高考中,氧化还原反应的考查往往渗透到综合实验(如中和滴定实验)、工业流程制备中,增大了试题的灵活度和难度。
1
2
题组一 氧化还原反应在综合实验中的应用
1
2
实验记录如下:
1
2
请回答下列问题:(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):________________________________________________________________________。
解析答案
1
2
答案
缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液
解析
1
2
1
2
(3)实验Ⅱ中发生反应的离子方程式是_____________________。
(4)实验Ⅲ中,浅绿色溶液变为黄色的原因是_______________________________________。
+NO↑+2H2O
解析答案
1
2
(5)实验Ⅳ中液面上方有少量红棕色气体生成,发生反应的化学方程式是_________________。解析 实验Ⅳ中液面上方有少量红棕色气体生成,是由于NO与氧气反应生成红棕色的NO2,发生反应的化学方程式是2NO+O2===2NO2。
解析答案
2NO+O2===2NO2
1
2
答案
解析
1
2
1
2
题组二 氧化还原反应在工业制备中的应用2.(2016·江苏,18)过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O===CaO2·8H2O反应时通常加入过量的Ca(OH)2,其目的是_________________。解析 Ca(OH)2过量,促进H2O2吸收,提高H2O2的利用率。
解析答案
提高H2O2的利用率
解析
1
2
解析 CaO2·8H2O溶于水与水反应生成Ca(OH)2和O2,增加了Ca2+和OH-的浓度。
√
√
解析答案
1
2
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_________________________________。解析 反应物为O2、Mn2+,生成物为MnO(OH)2,溶液呈碱性,可以补充OH-配平。
2Mn2++O2+4OH-===2MnO(OH)2↓
答案
返回
1
2
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L-1表示),写出计算过程。
1
2
答案 在100.00 mL水样中
n[MnO(OH)2]=n(I2)=6.750×10-5 mol,
=6.750×10-5 mol,
返回
2023届高考化学二轮复习专题三氧化还原反应离子反应学案: 这是一份2023届高考化学二轮复习专题三氧化还原反应离子反应学案,共33页。
高考化学二轮复习专题3氧化还原反应离子反应学案: 这是一份高考化学二轮复习专题3氧化还原反应离子反应学案,共23页。
专题三 氧化还原反应 离子反应 (解析版): 这是一份专题三 氧化还原反应 离子反应 (解析版),共34页。学案主要包含了对点析图等内容,欢迎下载使用。












