








人教版九年级下册课题3 溶液的浓度课前预习课件ppt
展开
这是一份人教版九年级下册课题3 溶液的浓度课前预习课件ppt,文件包含932溶液的浓度同步课件pptx、932溶液的浓度教学设计doc、931溶液的浓度同步练习doc等3份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
学习目标1.学会溶液稀释和增浓的计算。2.初步学会溶液与化学方程式的综合计算
1.下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )A.100 g水中溶解了10 g硝酸钾B.100 g硝酸钾溶液中有10 g硝酸钾C.将10 g硝酸钾溶于90 g水中所得的溶液D.将硝酸钾与水按1∶9的质量比配制的溶液
2.下列说法正确的是( )A.15℃时,硝酸钾的溶解度是25 g,15℃时饱和溶液的质量分数为20%B.24%的氢氧化钠溶液取出一半其溶质质量分数为12%C.饱和溶液中析出晶体后,溶质的质量分数一定减小D.饱和溶液升高温度一定变成不饱和溶液
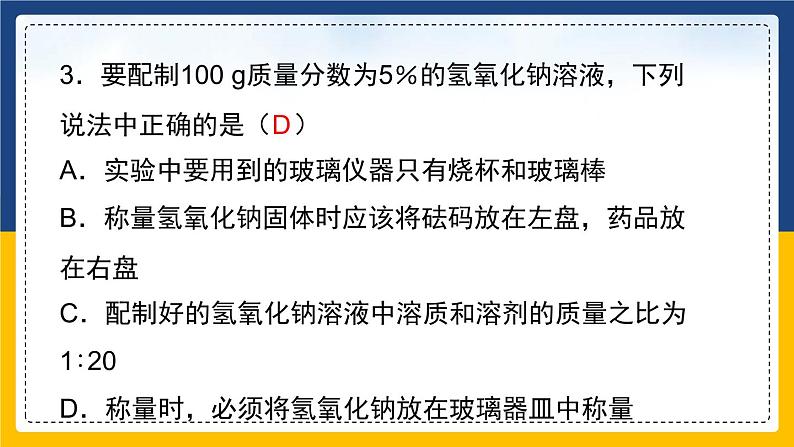
3.要配制100 g质量分数为5%的氢氧化钠溶液,下列说法中正确的是( )A.实验中要用到的玻璃仪器只有烧杯和玻璃棒B.称量氢氧化钠固体时应该将砝码放在左盘,药品放在右盘C.配制好的氢氧化钠溶液中溶质和溶剂的质量之比为1∶20D.称量时,必须将氢氧化钠放在玻璃器皿中称量
什么是溶质质量分数;计算公式怎写么?
我们通常会利用溶质质量分数的计算式进行一些简单的计算,本节课我们就来学习一下。
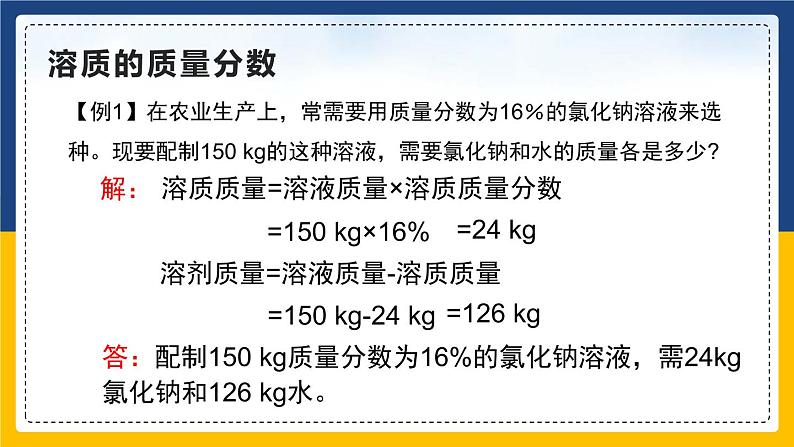
【例1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少?
溶质质量 = 溶液质量 × 溶质质量分数
溶液质量 = 溶质质量 + 溶剂质量
【例1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少?
溶质质量=溶液质量×溶质质量分数
=150 kg×16%
答:配制150 kg质量分数为16%的氯化钠溶液,需24kg氯化钠和126 kg水。
溶剂质量=溶液质量-溶质质量
=150 kg-24 kg
【例2】化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50 g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
溶液稀释前后,溶质的质量不变
解:设:稀释后溶液的质量为x。
答:需要水的质量为195g。
50 g × 98%= x ×20%
需要水的质量=245 g-50 g=195 g
溶质的质量分数应用于化学方程式的计算,真正参与反应的物质一般来讲是溶液中的溶质。
【例3】100 g某硫酸溶液恰好与13 g锌完全反应。试计算这种硫酸溶液中溶质的质量分数。
解题关键是利用化学方程式先解出硫酸溶质的质量。
解:设H2SO4的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
答:稀硫酸的质量分数为19.6%。
体积分数也可用来表示溶液的浓度。
例1.无土栽培所用的某种营养液中,含硝酸钾的质量分数为7%,某蔬菜生产基地欲配制该营养液200 kg,需要硝酸钾的质量是( )A.7 kg B.14 kg C.70 kg D.140 kg
例2.有40 g质量分数为5%的CaCl2溶液,若将其质量分数增大到10%,应采用的方法是( )A.加入2 g CaCl2固体 B.把溶剂蒸发掉一半C.加入20 g溶剂 D.加入40 g溶质质量分数为15%的CaCl2溶液
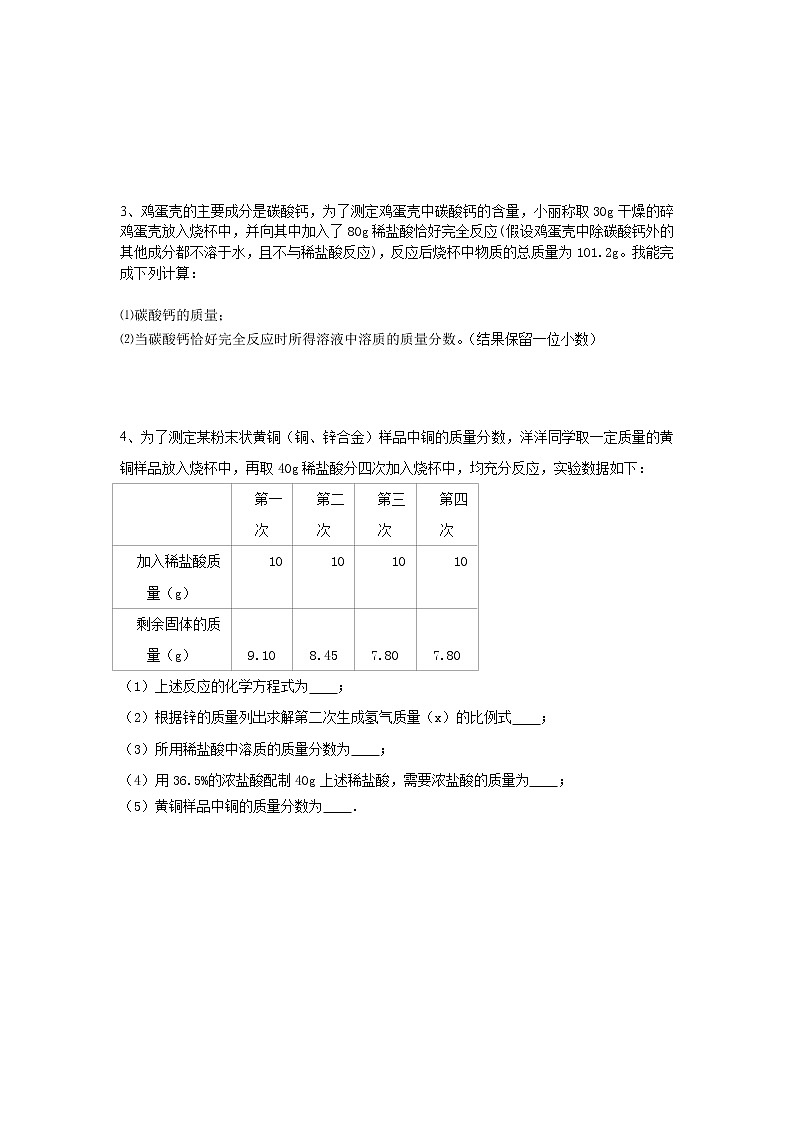
例3.5.6 g铁与100 g稀盐酸恰好完全反应。求:(1)生成氢气的体积是多少升?(氢气的密度为0.09 g/L)(2)原稀盐酸溶液中溶质的质量分数。(3)反应后溶液中溶质的质量分数。
解:设5.6 g铁放入100 g稀盐酸中生成氢气质量为x,同时生成氯化亚铁的质量为y,反应的氯化氢的质量是z,则:
Fe + 2HCl = FeCl2 + H2↑
本节课我们学习了不同种类的有关溶质的质量分数的计算,知道了向溶液中增加溶质或增加溶剂时溶液组成的改变情况,同时还了解了有时也用体积分数来表示溶液的浓度。
相关课件
这是一份人教版课题3 溶液的浓度完整版课件ppt,文件包含93-2溶液的浓度第2课时pptx、93-2教学设计溶液的浓度第2课时docx、93-2练习·能力提升溶液的浓度第2课时docx、93-2练习·基础巩固溶液的浓度第2课时docx、93-2练习·素能拓展溶液的浓度第2课时docx、93-2预习导学溶液的浓度第2课时docx等6份课件配套教学资源,其中PPT共17页, 欢迎下载使用。
这是一份化学课题3 溶液的浓度评课ppt课件,共15页。PPT课件主要包含了复习巩固,溶质质量分数,课堂练习,根据信息列出关系式,增加10g,总结归纳,全部溶解,不饱和,≈242%,恰好饱和等内容,欢迎下载使用。
这是一份化学九年级下册课题3 溶液的浓度备课ppt课件,共21页。PPT课件主要包含了溶液的配制,氯化钠固体和蒸馏水,方法一,溶质的质量少了,溶剂的质量多了,方法二,装瓶存放,自制汽水,玻璃棒等内容,欢迎下载使用。










