

第十单元 酸和碱 A卷 基础夯实—— 人教版九年级下册化学单元测试AB卷
展开第十单元 酸和碱 A卷 基础夯实
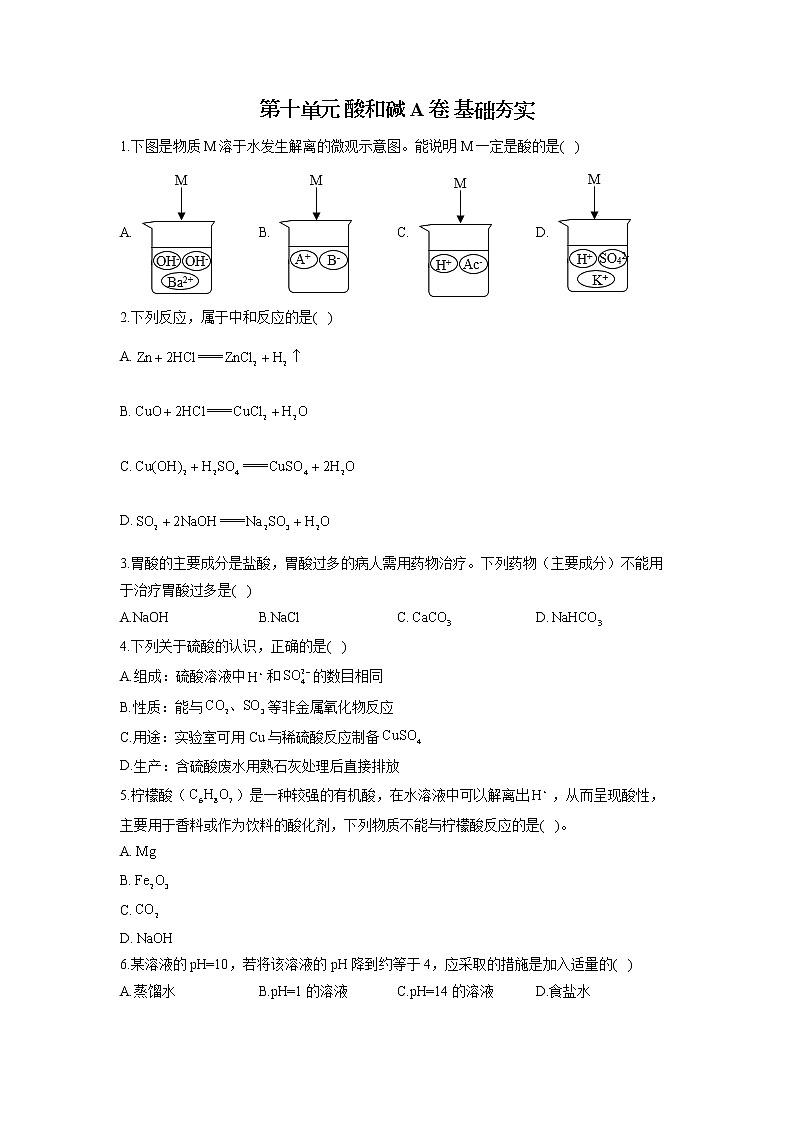
1.下图是物质M溶于水发生解离的微观示意图。能说明M一定是酸的是( )
A. B. C. D.
2.下列反应,属于中和反应的是( )
A.
B.
C.
D.
3.胃酸的主要成分是盐酸,胃酸过多的病人需用药物治疗。下列药物(主要成分)不能用于治疗胃酸过多是( )
A.NaOH B.NaCl C. D.
4.下列关于硫酸的认识,正确的是( )
A.组成:硫酸溶液中和的数目相同
B.性质:能与等非金属氧化物反应
C.用途:实验室可用Cu与稀硫酸反应制备
D.生产:含硫酸废水用熟石灰处理后直接排放
5.柠檬酸()是一种较强的有机酸,在水溶液中可以解离出,从而呈现酸性,主要用于香料或作为饮料的酸化剂,下列物质不能与柠檬酸反应的是( )。
A.
B.
C.
D.
6.某溶液的pH=10,若将该溶液的pH降到约等于4,应采取的措施是加入适量的( )
A.蒸馏水 B.pH=1的溶液 C.pH=14的溶液 D.食盐水
7.下列物质敞口放置在空气中,质量发生变化与空气的成分无关的是( )
A.浓盐酸 B.浓硫酸 C.氧化钙 D.铝丝
8.如表是某酸碱指示剂在不同pH范围内显示的颜色。向滴有少量该指示剂的稀盐酸中,逐滴加入氢氧化钠溶液,出现的颜色变化是( )
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
pH范围 | 1~3 | 4~5 | 6~7 | 8~10 | 11~14 |
A.由红到蓝
B.由绿到橙
C.由蓝到绿
D.由紫到红
9.化学课上老师拿出三朵用石蕊溶液处理过的紫色小纸花(如图),向纸花上分别喷洒不同的溶液,三朵纸花显色情况为①紫色,②红色,③蓝色。则喷在③号纸花上的溶液可能是( )
A.氢氧化钠溶液
B.氯化钠溶液
C.稀硫酸
D.稀盐酸
10.实验室里的固体氢氧化钠必须密封保存,主要原因是( )
①有腐蚀性
②有吸水性,易潮解
③有挥发性
④能与空气中的反应
A.①②
B.①③
C.②④
D.③④
11.下列关于氢氧化钠的说法正确的是( )
A.氢氧化钠可用作建筑材料、用于改良酸性土壤等
B.氢氧化钠易潮解,要密封保存
C.氢氧化钠俗称苛性碱
D.溶于水放出大量热的白色固体一定是氢氧化钠
12.下列关于性质的描述中,不属于酸的通性的是( )
A.能与部分盐反应,生成新的酸和新的盐
B.与镁反应放出氢气
C.浓硫酸滴到白纸上使纸变黑
D.与氧化铁等金属氧化物发生反应
13.物质的性质决定其用途。固体氢氧化钠可用作干燥剂,是利用了它的哪种性质( )
A.白色固体
B.易潮解
C.具有强腐蚀性
D.能与空气中的二氧化碳反应
14.下列物质不能与稀盐酸反应放出气体的是( )
A.Al
B.Fe
C.Cu
D.
15.利用如图所示的实验探究物质的性质,下列叙述错误的是( )
A.若②溶液变红,则M可能为酚酞溶液
B.若只有③有气泡产生,则M可能为稀盐酸
C.若①有蓝色沉淀生成,则M可能为氢氧化钡溶液
D.若①②③④都没有现象,则M可能为氢氧化钠溶液
16.下列说法不正确的是( )
A.人体中血液的pH为7.35~7.45,则身体健康
B.正常雨水的pH≈5.6
C.厕所清洁剂的pH小于7
D.农作物一般适宜在pH等于7或接近7的土壤中生长
17.某同学用氢氧化钾溶液与稀硫酸做中和反应实验时,用pH传感器测得溶液的pH变化如图所示,回答下列问题。
(1)写出对应的化学方程式:________。
(2)该实验是将________加入________中。
(3)取点溶液少量于试管中,滴加紫色石蕊溶液,现象是________。
(4)曲线上________点表示酸和碱恰好完全反应。
(5)点溶液呈________性,溶液中含有的溶质是________。
18.如图所示的3个实验均可验证酸与碱能发生反应。
(1)根据实验一回答下列问题:
①加稀盐酸前,一定能观察到的实验现象是______________________。
②该实验通过稀盐酸与______________________反应的现象验证了酸与碱能发生反应。
(2)实验二通过两支试管中的现象对比,可以判断稀盐酸与能反应,该实验除须控制所加水和稀盐酸的温度、体积相同外,还须控制______________________相同。
(3)实验三中,加入X可验证稀硫酸与碱能发生反应,则X可能是下列物质中的___________。A.酚酞 B. CuO C.
19.为探究碱的性质,进行如下实验:
(1)如图甲所示,加入一定量的盐酸后,现象是_______,溶液温度_______(填“升高”、“降低”或“不变”)。
(2)如图乙和丙所示,同时将两只充满的相同试管分别倒扣在等体积的水和NaOH溶液中,一段时间后,丙中液面______乙(填“高于”或“低于”),说明________,该反应的化学方程式为__________。本实验中乙的作用是__________。
(3)实验结束后,进行废液处理。将丙所得溶液全部倒入一大烧杯中,再将甲所得溶液缓慢加入。全部加入后测得溶液pH为3,调节pH接近7,达到排放标准。将甲所得溶液缓慢加入的过程中,大烧杯内可观察到的现象是____________,涉及的主要反应方程式为____________。
20.完成下列有关酸的性质的实验。
实验一:图甲所示的电子天平A、B上的表面皿中分别盛有浓HCl、浓,放置一段时间。
(1)A中的示数变小,原因是________。
(2)与图甲中C所示变化相一致的是________(填“A”“B”或“A、B”)。
实验二:如图乙,做对比实验,得出相应结论。
(3)I和Ⅱ试管中都产生气泡,且I中比Ⅱ中反应剧烈。此现象说明物质反应的快慢与________有关。Ⅲ试管中可能出现的现象是_______。请用化学方程式解释其原因:_______、_______。
答案以及解析
1.答案:C
解析:酸是电离时产生的阳离子全部是氢离子的化合物。A项,图中阳离子是钡离子,不符合题意;B项,图中阳离子是A离子,不一定是氢离子,不符合题意;C项,图中阳离子都是氢离子,符合题意;D项,图中阳离子是氢离子和钾离子,不都是氢离子,不符合题意。
2.答案:C
解析:中和反应是酸跟碱作用生成盐和水的反应,故C正确。
3.答案:AB
4.答案:D
解析:A项,在溶液中,1个分子解离出2个和1个,所以的数目是的2倍,错误;B项,硫酸不能与等非金属氧化物反应,可以与CuO、等金属氧化物反应,错误;C项,Cu与稀不反应,错误。
5.答案:C
解析:柠檬酸属于酸,酸不能与非金属氧化物反应。
6.答案:B
解析:碱性溶液要变成酸性溶液,则需要加入比混合后溶液酸性更强的物质。蒸馏水、食盐水呈中性,A、D错误;pH=1的溶液呈强酸性,B正确;pH=14的溶液呈碱性,C错误。
7.答案:A
解析:A、浓盐酸具有挥发性,放置在空气中会导致质量减少,发生的变化与空气中成分无关。B、浓硫酸具有吸水性,敞口放置在空气中,易吸收空气中的水分而导致质量增加,发生的变化与空气中成分有关。C、氧化钙敞口放置在空气中,易吸收空气中的水分而质量增加,与空气中成分有关。D、铝丝易于空气中的氧气反应生成氧化铝,而使质量增加,发生的变化与空气中成分有关,故选:A。
8.答案:A
解析:向滴有少量该指示剂的稀盐酸中,逐滴加入氢氧化钠溶液,稀盐酸显酸性,故一开始溶液显红色,加入氢氧化钠溶液,氢氧化钠与稀盐酸反应生成氯化钠和水,酸性逐渐减弱,碱性逐渐增强,可能会出现由红到蓝,故A正确。
9.答案:A
解析:紫色石蕊溶液遇碱性溶液变蓝色,③号纸花变成了蓝色,说明喷的是碱性溶液。氢氧化钠溶液显碱性,氯化钠溶液显中性,稀硫酸、稀盐酸显酸性,故A正确。
10.答案:C
解析:由于固体氢氧化钠易吸收空气中的水蒸气而潮解,且能与空气中的二氧化碳反应生成碳酸钠而变质,所以固体氢氧化钠必须密封保存。故选C。
11.答案:B
解析:氢氧化钠主要用于制肥皂、洗涤剂、造纸、纺织等,其具有强烈的腐蚀性,不可用于改良酸性土壤,A错误。氢氧化钠固体易吸收空气中的水分而潮解,要密封保存,B正确。氢氧化钠俗称苛性钠或烧碱,C错误。氢氧化钠是白色固体,溶于水放热,但溶于水放出大量热的白色固体不一定是氢氧化钠,D错误。
12.答案:C
解析:与部分盐反应生成新的酸和新的盐、与镁反应放出氢气、与氧化铁等金属氧化物反应,都属于酸的通性。浓硫酸具有脱水性,滴到白纸上可使纸变黑,其他酸不一定具有此性质,不属于酸的通性,C符合题意。
13.答案:B
解析:氢氧化钠固体易潮解,具有吸水性,所以可用作干燥剂。故选B。
14.答案:C
解析:Fe和Al都可以与稀盐酸反应生成氢气,碳酸钙可以与稀盐酸反应生成二氧化碳,而Cu不能稀盐酸发生反应,故选C。
15.答案:D
解析:②溶液是氢氧化钙溶液,显碱性,若②溶液变红,则M溶液可能为酚酞溶液,A正确;③是碳酸钠溶液,碳酸钠能与稀盐酸反应生成二氧化碳气体,若只有③有气泡产生,则M溶液可能为稀盐酸,B正确;①是硫酸铜溶液,氢氧化钡溶液与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钡白色沉淀,若①有蓝色沉淀生成,则M溶液可能为氢氧化钡溶液,C正确;若①②③④都没有现象,侧M溶液不可能为氢氧化钠溶液,氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜蓝色沉淀,D错误。
16.答案:A
解析:人体内血液的正常pH为7.35~7.45,血液的pH正常,只能说明血液的一项指标正常,不能据此判定身体健康,A错误;空气中的二氧化碳气体溶于水生成碳酸,故正常雨水的pH≈5.6,B正确;厕所清洁剂显酸性,pH小于7,C正确;农作物一般在5.5<pH<8.5的土壤中都能生长良好,过酸、过碱性的土壤对其生长都不利,5.5<pH<8.5的土壤被称为中性或接近中性的土壤,D正确。
17.答案:(1)
(2)氢氧化钾溶液;稀硫酸
(3)紫色石蕊溶液变红
(4)
(5)碱;氢氧化钾、硫酸钾
解析:(1)氢氧化钾与稀硫酸反应生成硫酸钾和水。
(2)图像中pH的变化是从小于7逐渐增大到大于7,可知原溶液显酸性,是将氢氧化钾溶液滴加到稀硫酸中。
(3)A点时溶液的pH<7,溶液显酸性,说明稀硫酸过量,取点溶液少量于试管中,滴加紫色石蕊溶液,紫色石蕊溶液变红色。
(4)酸和碱恰好完全反应时溶液显中性,pH=7,曲线上点表示酸和碱恰好完全反应。
(5)点时溶液的pH大于7,呈碱性,溶液中含有的溶质是氢氧化钾、硫酸钾。
18.答案:(1)①试管中产生蓝色沉淀②氢氧化铜
(2)氢氧化钙粉末的质量
(3)AB
解析:(1)氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀;根据加入酸以后沉淀逐渐消失,溶液变为蓝色,推测酸与碱发生了化学反应。
(2)由控制变量法分析,本实验中除了水和稀盐酸的种类不同外,其他各量必须保持相同,水和稀盐酸的温度、体积相同,还须控制氢氧化钙粉末的质量相同。
(3)在碱中加入过量的酸后,溶液显酸性,再加入酚酞后溶液仍为无色,说明碱已经不存在了,进而证明了酸与碱确实发生了反应,故A符合。如果和NaOH没有反应,那么加入CO后,CuO和反应生成,会继续和NaOH反应生成蓝色沉淀;如果和NaOH发生了反应,则CuO会和过量的反应生成,但由于NaOH已反应掉,则不会有蓝色沉淀产生,故B符合。由于稀硫酸是过量的,不管和NaOH有没有发生反应,加入都会有气泡产生,故C不符合。
19.答案:(1)溶液红色褪去;升高
(2) 高于;与NaOH反应;;通过对照实验,证明与NaOH发生反应
(3) 溶液先变红后褪色,并有气泡产生;(或)
解析:(1)氢氧化钠溶液显碱性,能使酚酞变红,加入盐酸后,氢氧化钠与盐酸反应生成氯化钠和水,盐酸和氯化钠溶液不能使酚酞变色,可观察到溶液红色褪去,氢氧化钠与盐酸发生中和反应,会放出热量,所以溶液温度升高,故填:溶液红色褪去;升高;
(2)将两只充满的相同试管分别倒扣在等体积的水和NaOH溶液中,一段时间后,丙中液面高于乙,说明二氧化碳与氢氧化钠发生了反应,氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的化学方程式为;实验中乙和丙对比,丙中试管内液面上升更高,说明液面上升不仅是二氧化碳溶于水引起的,还可以说明二氧化碳与氢氧化钠发生了反应,故填:高于;与NaOH反应;;通过对照实验,证明与NaOH发生反应;
(3)甲中含有酚酞溶液,丙中含有碳酸钠,碳酸钠溶液显碱性,能使酚酞溶液变红,甲所得溶液全部加入烧杯后,测得溶液pH为3,溶液显酸性,含有稀盐酸,盐酸与氢氧化钠反应生成氯化钠和水,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应有气泡产生,现象是先变成红色,然后红色变成无色,同时产生气泡,反应的化学方程式为、,故填:溶液先变红后褪色,并有气泡产生;(或)。
20.答案:(1)浓盐酸具有挥发性
(2)A、B
(3)酸的浓度;铁锈消失,溶液变成黄色,随后产生气泡;
解析:(1)浓盐酸具有挥发性,所以敞口放置一段时间后,氯化氢气体的挥发会造成溶液的质量减少。
(2)浓盐酸具有挥发性,挥发出了溶质,溶剂质量不变,而浓硫酸具有吸水性,溶剂质量增大,溶质质量不变,二者溶液中溶质的质量分数均会变小。
(3)I和Ⅱ试管中相同的铁片与不同浓度的盐酸反应,产生气泡的速率不同,盐酸的浓度越大,产生气泡的速率越快,说明物质反应的快慢与酸的浓度有关。生锈的铁钉放入盐酸中时,铁锈中的氧化铁与盐酸反应生成氯化铁和水,溶液变成黄色,铁锈消失:待氧化铁完全反应后,铁与盐酸反应生成氯化亚铁和氢气,又有气泡产生。










