

鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律第3课时导学案
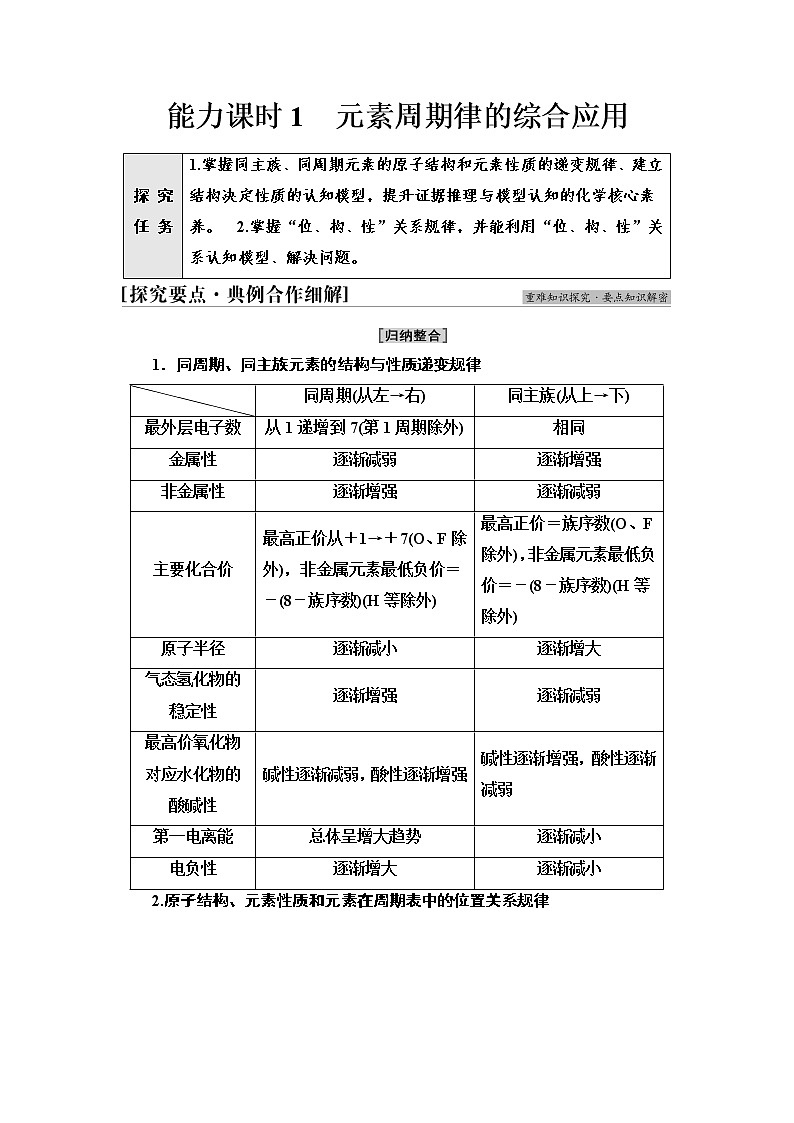
展开能力课时1 元素周期律的综合应用1.同周期、同主族元素的结构与性质递变规律2.原子结构、元素性质和元素在周期表中的位置关系规律3.元素“位—构—性”关系(2021·黑龙江牡丹江三中期末考试)下表是元素周期表的一部分(前5周期),表中所列的字母分别代表一种化学元素。试回答下列问题:(1)G的元素符号为__________,在元素周期表中位于________区。(2)基态A原子的轨道表示式为________________;基态H原子的价电子排布式为________;H在元素周期表中的位置是________。(3)A、B、E、F的原子半径由大到小的顺序是________(填元素符号,下同);A、B、C、D的第一电离能由大到小的顺序是________;A、B、C、D的电负性由大到小的顺序是________。[解析] (1)G位于第6纵列,是24号元素,元素符号为Cr,该元素位于元素周期表的d区。(2)A为C元素,其核外有6个电子,轨道表示式为;H为Fe元素,是26号元素,Fe原子的价电子排布式为3d64s2;Fe位于元素周期表中第4周期Ⅷ族。(3)A为C元素,B为N元素,E为Al元素,F为Si元素,其原子半径:Al>Si>C>N。C为O元素,D为F元素,因N元素2p能级处于半充满状态,其第一电离能比O的大,故C、N、O、F的第一电离能:F>N>O>C;同周期主族元素,从左到右电负性逐渐增大,故电负性:F>O>N>C。[答案] (1)Cr d (2) 3d64s2 第4周期Ⅷ族 (3)Al>Si>C>N F>N>O>C F>O>N>C1.(2020·山东等级考)短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是 ( )A.第一电离能:W>X>Y>ZB.简单离子的还原性:Y>X>WC.简单离子的半径:W>X>Y>ZD.氢化物水溶液的酸性:Y>WC [四种短周期主族元素,基态X原子的电子总数是其最高能级电子数的2倍,若X为第2周期元素原子,则X可能为Be或O,若X为第3周期元素原子,则均不满足题意,Z与X能形成Z2X2的淡黄色化合物,该淡黄色化合物为Na2O2,则X为O元素,Z为Na元素;Y与W的最外层电子数相同,则Y为F元素,W为Cl元素。同一周期从左向右第一电离能总趋势为逐渐增大,同一主族从上到下第一电离能逐渐减小,故四种元素中第一电离能从大到小的顺序为F>O>Cl>Na,A错误;O、F、Cl三种元素的简单离子中,F-还原性最弱,B错误;电子层数越多简单离子半径越大,相同结构的离子,原子序数越大半径越小,故四种元素中离子半径从大到小的顺序为Cl->O2->F->Na+,C正确;F元素的非金属性强于Cl元素,则形成氢化物后F原子束缚H原子的能力强于Cl原子,在水溶液中HF不容易发生电离,故HCl的酸性强于HF,D错误。]2.(双选)(2021·蚌埠高二检测)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )A.原子半径:Z>Y>XB.气态氢化物的稳定性:R>WC.WX3和水反应形成的化合物是离子化合物D.Y和Z两者最高价氧化物对应的水化物能相互反应BD [由题图可知,X为O,Y为Na,Z为Al,W为S,R为Cl。原子半径:Na>Al>O,故A项错误;非金属性越强,对应气态氢化物就越稳定,所以HCl比H2S稳定,故B项正确;SO3和水反应形成的化合物为硫酸,是共价化合物,故C项错误;Y和Z的最高价氧化物对应的水化物分别是NaOH和Al(OH)3,因Al(OH)3为两性氢氧化物,既能与酸反应又能与强碱溶液反应,故D项正确。]3.(2021·宁夏石嘴山三中期末考试)第3周期主族元素的I1、I2、I3的变化如图所示,则图a、b和c中纵轴代表的电离能依次是( )图a 图b 图cA.I1、I2、I3 B.I2、I3、I1C.I3、I2、I1 D.I1、I3、I2B [Mg的3s能级处于全充满状态,其I1比Al的I1大,且Al的I1比Na的Il大,则图c的纵轴代表I1,比较图a、b、c中Mg元素的电离能可知,图b中Mg元素的电离能远大于图a、c中Mg元素的电离能,则图b的纵轴表示I3,B项正确。]中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。1.49In元素的价电子排布式如何书写?原子中未成对电子的个数是多少?提示:根据核外电子排布规律可以判断该元素的价电子排布式为5s25p1,原子中有一个未成对电子。2.该元素在周期表的哪个位置?属于哪个分区?提示:根据该元素原子的价电子排布式判断该元素为第5周期ⅢA族元素,由于最后一个电子落在p轨道上,因此该元素属于p区元素。3.试比较该元素与铷(37Rb)的原子半径及简单离子半径大小。提示:由于这两种元素属于同一周期元素,从左往右元素的原子半径逐渐减小,因此原子半径Rb大于In;形成离子时,由于两种元素均为金属元素,均失电子形成金属阳离子,因此离子半径与原子半径顺序相同。4.试比较两者的第一电离能大小。提示:两元素属于同一周期的主族元素,从左往右元素的第一电离能呈增大趋势。5.试比较两者所形成的最高价氧化物对应水化物的碱性强弱。提示:In是第5周期第ⅢA族元素,Rb为第5周期第ⅠA族元素,金属性In
高中化学鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律第3课时学案: 这是一份高中化学鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律第3课时学案,共11页。学案主要包含了选择题,非选择题等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律第2课时学案: 这是一份高中化学鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律第2课时学案,共12页。学案主要包含了第四电离能等,选择题等内容,欢迎下载使用。
鲁科版 (2019)第3节 元素性质及其变化规律第1课时学案设计: 这是一份鲁科版 (2019)第3节 元素性质及其变化规律第1课时学案设计,共10页。学案主要包含了选择题,非选择题等内容,欢迎下载使用。













