





高中第二单元 溶液组成的定量研究集体备课课件ppt
展开课程目标1.了解物质的量浓度的含义。2.掌握物质的量浓度的有关计算。3.掌握容量瓶的使用方法。4.掌握配制一定物质的量浓度溶液的方法及操作。
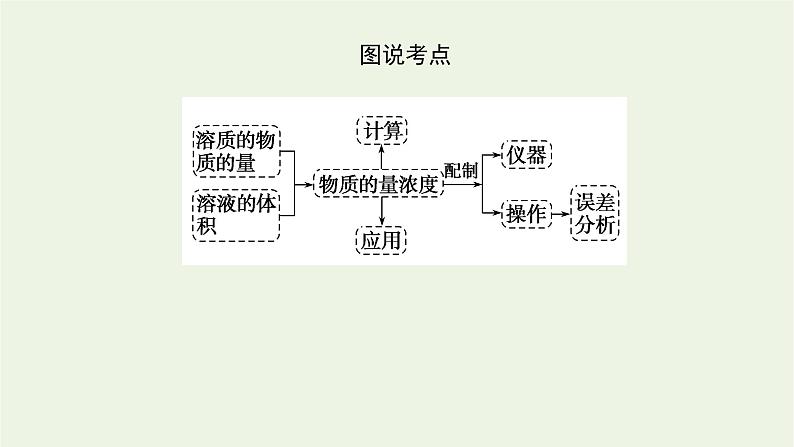
[新知预习]一、物质的量浓度
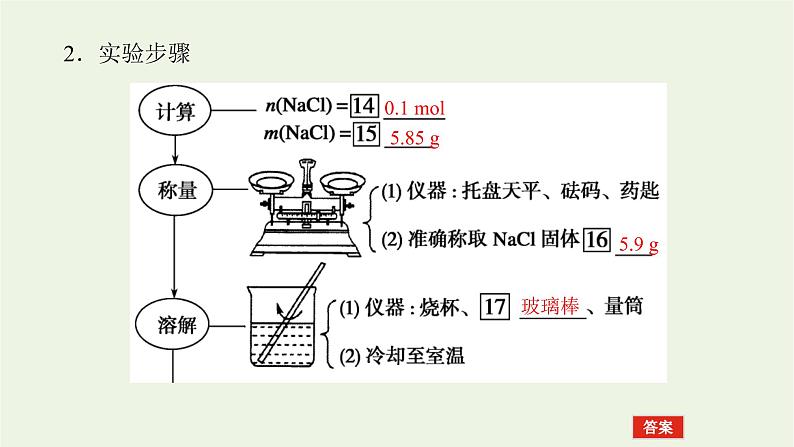
二、配制一定物质的量浓度的溶液 以配制100 mL 1.00 ml·L-1 NaCl溶液为例。1.主要仪器(1)容量瓶
50 mL、100 mL、250 mL、500 mL
容量瓶(100 mL)
2.1 ml·L-1的NaCl溶液表示( )A.溶液中含有1 ml NaClB.1 ml NaCl溶于1 L水中C.58.5 g NaCl溶于941.5 g水中D.1 L溶液中含有NaCl 58.5 g
3.容量瓶的瓶壁上未标有的是( )A.刻度线 B.温度C.浓度 D.容积
解析:容量瓶上标有:刻度线、温度、容积。
4.从2 L 1 ml·L-1 NaOH溶液中取出100 mL,下列有关这100 mL溶液的叙述错误的是( )A.浓度为0.1 ml·L-1 B.浓度为1 ml·L-1C.含NaOH 4 g D.含NaOH 0.1 ml
5.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
解析:用托盘天平称量药品应左物右码,A项不正确;向容量瓶转移液体应用玻璃棒引流,C项不正确;定容时,胶头滴管不能插入容量瓶内,D项不正确。
提升点1 物质的量浓度的基本计算和判断[例1] 下列溶液中物质的量浓度为1 ml·L-1的是( )A.将40 g NaOH溶解在1 L水中B.将22.4 L HCl气体溶于水配成1 L溶液C.将1 L 10 ml·L-1浓盐酸加入9 L水中D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
[提升1] 下列说法正确的是( )A.40 g NaOH溶于水所得1 L溶液的浓度为1 ml·L-1B.1 ml·L-1的Na2CO3溶液中Na+的浓度为1 ml·L-1C.从1 L 0.1 ml·L-1的NaCl溶液中取出0.1 L溶液,则NaCl的浓度变为0.01 ml·L-1D.1 L 0.2 ml·L-1的Na2SO4溶液中,Na+的物质的量为0.2 ml
在用公式计算物质的量浓度时体积指的是溶液的体积,而不是溶剂的体积。
在一定物质的量浓度溶液中取出任意体积的溶液,其浓度不变,即浓度不会随着体积的变化而变化,但所含溶质的物质的量或质量因体积的不同而不同。
状元随笔 溶液稀释计算中的“三个守恒”①溶质的物质的量守恒:c(浓)·V(浓)=c(稀)·V(稀);②溶质的质量守恒:m(浓)·w(浓)=m(稀)·w(稀);③溶液的质量守恒:m(稀)=m(浓)+m(水)。
答案:(1)20% (2)2.28 ml/L
提升点2 一定物质的量浓度溶液的配制及误差分析[例2] 实验室配制500 mL 0.5 ml·L-1的NaCl溶液,有如下操作步骤:①把称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。②把①所得溶液小心转入500 mL容量瓶中。③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞塞紧,充分摇匀。
(1)操作步骤的正确顺序为________(填序号)。(2)本实验用到的基本实验仪器有_________________________________________________。(3)某同学观察液面的情况如图所示,对所配溶液浓度将有何影响?________(填“偏高”“偏低”或“无影响”)。 (4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)没有进行操作步骤④____________;加蒸馏水时不慎超过了刻度____________。(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度线________;向容量瓶中转移溶液时(操作步骤②)溶液流到容量瓶外面________。
500 mL容量瓶、托盘天平、药匙、烧杯、胶头滴管、玻璃棒
状元随笔 容量瓶读数的仰视和俯视
①仰视刻度线(图1)。加水量偏多,导致溶液体积偏大,结果偏低。②俯视刻度线(图2)。加水量偏少,结果偏高。
[提升4] 下列配制的溶液浓度偏高的是( )A.配制盐酸用量筒量取浓盐酸时俯视刻度线B.配制盐酸定容时,仰视容量瓶刻度线C.称量4.0 g NaOH配制0.1 ml·L-1NaOH溶液1 000 mL时,砝码错放在左盘D.NaOH溶解后未经冷却即注入容量瓶至刻度线
①用托盘天平称量时,切记“左物右码”。②读数计算应为m物=m砝码+m游码。
解析:A项俯视刻度线,将会使量得的盐酸体积小于计算值,导致浓度偏低;B项定容时仰视容量瓶刻度线,将会导致加水量增多,使溶液浓度偏低;C项由于所称NaOH固体的质量为整数,不需移动游码,故称得固体NaOH的质量是准确的,不会影响到配制溶液的浓度;D项因热胀冷缩之故,会使容量瓶中的溶液在冷却后液面低于刻度线,导致所配溶液浓度偏高。
关键能力1.配制溶液“十字”表达:算(计算)→量(称量或量取)→溶(溶解)→冷(冷却)→移(移液)→洗(洗涤)→振(振荡)→定(定容)→摇(摇匀)→贴(转入试剂瓶,贴标签)。
提升点3 化学反应的计算[例3] 标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气。下列比例式正确的是( )A.Zn+2HCl===ZnCl2+H2↑ 1 ml 1 ml 3.25 g x LB.Zn+2HCl===ZnCl2+H2↑ 65 g 1 L 3.25 g x LC.Zn+2HCl===ZnCl2+H2↑ 1 ml 22.4 L 0.05 ml x LD.Zn+2HCl===ZnCl2+H2↑ 65 g 1 ml 3.25 g x L
【解析】 A项,上下单位不同,错误;B项,左右物理量不对应,错误;D项,上下单位不同,错误。
[提升5] 把一小块钠放入足量水中,会发生如下反应:2Na+2H2O===2NaOH+H2↑。有关该反应的下列说法正确的是( )A.反应中Na与NaOH的质量相等B.反应中H2O和H2的质量相等C.反应中H2O和H2的质量之比为2∶1D.反应中Na与NaOH的物质的量之比为1∶1
解析:该反应中,Na与NaOH的物质的量之比为1∶1,质量之比为23∶40,所以A项错误,D项正确;H2O与H2的物质的量之比为2∶1,质量之比为18∶1,所以B项、C项均错误。
[提升6] Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中不正确的是( )A.参加反应的Mg、Al共0.2 mlB.参加反应的HCl为0.4 mlC.Mg、Al在反应中共失去0.4 ml电子D.若与足量的稀硫酸反应能产生0.2 ml H2
关键能力物质的量应用于化学方程式计算的基本步骤
状元随笔 ①书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。 ②单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。③如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据不足量的物质进行计算。
1.(双选)欲配制1.00 ml·L-1 Na2CO3溶液100 mL,不需要使用的仪器是( )A.100 mL容量瓶 B.蒸馏烧瓶C.玻璃棒 D.锥形瓶
2.将5 ml·L-1盐酸10 mL稀释到200 mL,再取出5 mL,这5 mL溶液的物质的量浓度是( )A.0.05 ml·L-1 B.0.25 ml·L-1C.0.1 ml·L-1 D.0.5 ml·L-1
3.下列溶液中氯离子浓度与50 mL 1 ml·L-1 AlCl3溶液中Cl-浓度相等的是( )A.150 mL 1 ml·L-1的NaCl溶液B.75 mL 2 ml·L-1的NH4Cl溶液C.150 mL 3 ml·L-1的KCl溶液D.75 mL 2 ml·L-1的FeCl3溶液
解析:1 ml·L-1的AlCl3溶液中c(Cl-)=3 ml·L-1;A项c(Cl-)=1 ml·L-1;B项c(Cl-)=2 ml·L-1;C项c(Cl-)=3 ml·L-1 ,D项c(Cl-)=6 ml·L-1。
4.现需要配制500 mL 1 ml·L-1硫酸溶液,(1)需用质量分数为98%、密度为1.84 g·cm-3的浓硫酸________ mL。(2)容量瓶使用前检验漏水的方法是______________________________________________________________________________________________________________________________________________________________。
往容量瓶中加入适量的水,塞好瓶塞,用左手食指顶住瓶塞,用右手的五指托住瓶底,把瓶倒立过来,如不漏水,将其放正,把瓶塞旋转180°后塞紧,再把瓶倒立过来,若不漏水,才能使用
解析:(1)求需要的浓硫酸的体积,根据稀释前后溶质的质量不变来计算,设需浓硫酸的体积为x,则:0.5 L×1 ml·L-1×98 g·ml-1=x×1.84 g·cm-3×98%,解得x=27.2 mL。
(3)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填写“偏大”“偏小”或“不变”)? ①稀释的硫酸转移到容量瓶中后未洗涤烧杯:________________。②趁热将溶液注入容量瓶中并定容:________________________。③摇匀后发现液面低于刻度线于是又加水:__________________。④容量瓶中原有少量蒸馏水:______________________________。⑤定容时俯视液面:________。
5.0.56 g氧化钙恰好与20 mL盐酸反应,则此盐酸的物质的量浓度是( )A.0.10 ml·L-1 B.0.20 ml·L-1C.0.50 ml·L-1 D.1.00 ml·L-1
高中化学苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究优秀ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究优秀ppt课件,共39页。
高中化学苏教版 (2019)必修 第一册专题2 研究物质的基本方法第二单元 溶液组成的定量研究示范课ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册专题2 研究物质的基本方法第二单元 溶液组成的定量研究示范课ppt课件,共38页。
2020-2021学年第二单元 溶液组成的定量研究多媒体教学课件ppt: 这是一份2020-2021学年第二单元 溶液组成的定量研究多媒体教学课件ppt,共60页。PPT课件主要包含了物质的量,mol·L-1,刻度线,06g,玻璃棒,容量瓶,烧杯内壁,洗涤的溶液,蒸馏水,~2cm等内容,欢迎下载使用。













