

2022届高三湖北十一校第一次联考化学试题
展开
这是一份2022届高三湖北十一校第一次联考化学试题,文件包含十一校联考化学试题8kdoc、化学答案doc等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。
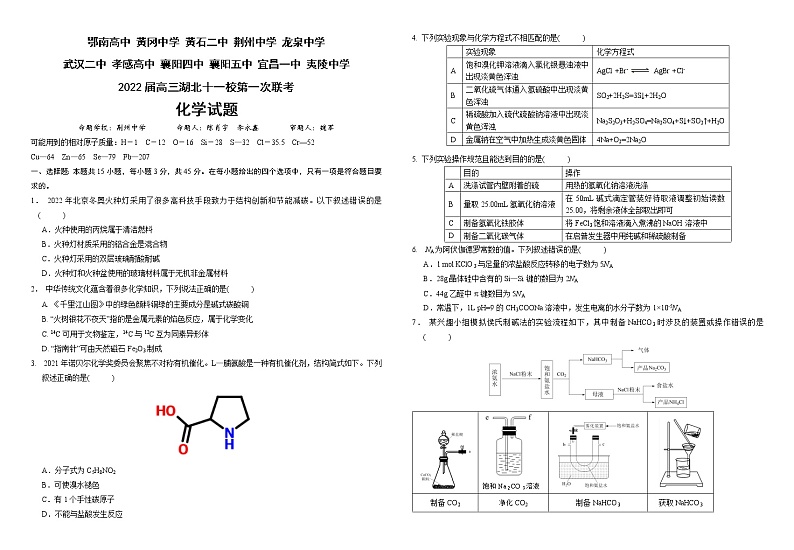
鄂南高中 黄冈中学 黄石二中 荆州中学 龙泉中学武汉二中 孝感高中 襄阳四中 襄阳五中 宜昌一中 夷陵中学2022届高三湖北十一校第一次联考化学试题命题学校:荆州中学 命题人:陈肖宇 李永鑫 审题人:魏军可能用到的相对原子质量:H-1 C-12 O-16 Si-28 S—32 Cl-35.5 Cr—52 Cu—64 Zn—65 Se—79 Pb—207一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。1. 2022年北京冬奥火种灯采用了很多高科技手段致力于结构创新和节能减碳。以下叙述错误的是( )A.火种使用的丙烷属于清洁燃料B.火种灯材质采用的铝合金是混合物C.火种灯采用的双层玻璃耐酸耐碱D.火种灯和火种盆使用的玻璃材料属于无机非金属材料2. 中华传统文化蕴含着很多化学知识,下列说法正确的是( )A. 《千里江山图》中的绿色颜料铜绿的主要成分是碱式碳酸铜
B. “火树银花不夜天”指的是金属元素的焰色反应,属于化学变化
C. 14C可用于文物鉴定,14C与12C互为同素异形体
D. “指南针”可由天然磁石Fe2O3 制成3. 2021年诺贝尔化学奖委员会聚焦不对称有机催化。L—脯氨酸是一种有机催化剂,结构简式如下。下列叙述正确的是( )A.分子式为C5H8NO2 B.可使溴水褪色C.有1个手性碳原子 D.不能与盐酸发生反应4. 下列实验现象与化学方程式不相匹配的是( ) 实验现象化学方程式A饱和溴化钾溶液滴入氯化银悬浊液中出现淡黄色浑浊AgCl +Br- AgBr +Cl-B二氧化硫气体通入氢硫酸中出现淡黄色浑浊SO2+2H2S=3S↓+2H2OC稀硫酸加入硫代硫酸钠溶液中出现淡黄色浑浊Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2OD金属钠在空气中加热生成淡黄色固体4Na+O2=2Na2O5. 下列实验操作规范且能达到目的的是( ) 目的操作A洗涤试管内壁附着的硫用热的氢氧化钠溶液洗涤B量取25.00mL氢氧化钠溶液在50mL碱式滴定管装好待取液调整初始读数25.00,将剩余液体全部取出即可C制备氢氧化铁胶体将FeCl3饱和溶液滴入煮沸的NaOH溶液中D制备二氧化碳气体在启普发生器中用纯碱和稀硫酸制备6. NA为阿伏伽德罗常数的值。下列叙述错误的是( )A.1 mol KClO3与足量的浓盐酸反应转移的电子数为5NAB.28g晶体硅中含有的Si—Si键的数目为2NAC.44g乙醛中π键数目为5NA D.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-5NA7. 某兴趣小组模拟侯氏制碱法的实验流程如下,其中制备NaHCO3时涉及的装置或操作错误的是( ) 饱和Na2CO3溶液制备CO2净化CO2制备NaHCO3获取NaHCO3ABCD8. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列叙述正确的是( )A.最简单氢化物的热稳定性:X>YB.该化合物阴阳离子中均有配位键C.第一电离能:Z>Y>X>WD.Y元素基态原子有5种不同运动状态的电子9.下列关于N、P及其化合物结构与性质的论述正确的是( )A.键能N-N>P-P、N-H>P-H,因此N2H4的沸点大于P2H4B.N的电负性比P的大,可推断NCl3分子的极性比PCl3的大C.NH3和PH3分子的VSEPR模型为正四面体形,PH3中P—H键键角大于NH3中N—H键键角D.研究发现固态中含有,而中则含有,存在差异的原因是Br-半径大10.硒化锌是一种黄色晶体,可用于荧光材料、半导体掺杂物。其立方晶胞结构如图所示,其晶胞参数为apm。下列叙述不正确的是( )A.该晶体中锌的配位数为4B.相邻的Se2-与Zn2+之间的距离为pmC.已知原子坐标:A点为(0,0,0),则C点的原子坐标为(,,)D.若硒化锌晶体的密度为,则阿伏加德罗常数的值为11.高分子修饰是指对高聚物进行处理,接上不同取代基改变其性能。我国高分子科学家对聚乙烯进行胺化修饰,并进一步制备新材料,合成路线如图:下列说法正确的是( )A.a分子不存在顺反异构B.合成路线中生成高分子b的反应为加聚反应C.1 mol高分子b最多可与2 mol NaOH反应D.高分子c的水溶性比聚乙烯的好12.在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图CO2的转化过程。下列说法错误的是( )A.铜元素位于周期表中的ds区B.步骤④中有化学键的断裂和形成C.甲酸乙酯是该过程的催化剂D.总反应化学方程式为CO2+3H2CH3OH+H2O13.下列说法正确的是( )A.基态锰原子的外围电子排布图:B.ZnGeAs2是重要的半导体化合物,其中元素Zn、Ge、As的电负性由大到小的顺序为Ge>As> ZnC.在共价化合物中,一定存在极性键,可能存在非极性键,一定不存在离子键D.在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构14. 25 ℃时,改变0.1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是( )A.若弱酸pH增大是通过向弱酸中加入NaOH固体实现的,则图中M、N两点对应溶液中的c(Na+)相等B.对于甲酸和丙酸,当lg[c(RCOOH)/c(RCOO-)]>0时,溶液都为酸性C.等浓度的HCOONa和CH3CH2COONa两种溶液中的c(NaOH)相等D.将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)15.二氧化铅-铜电池是一种电解质可循环流动的新型电池(如图所示),电池总反应为PbO2+Cu+2H2SO4=PbSO4+CuSO4+2H2O。下列有关该电池的说法正确的是( )A.电池工作时,电子由Cu电极经电解质溶液流向PbO2电极B.电池工作过程中,电解质溶液的质量逐渐减小C.正极反应式:PbO2+2e-+4H++SO2-4=PbSO4+2H2OD.放电后,循环液中H2SO4与CuSO4的物质的量之比不变二、非选择题:本题共4小题,共55分。16. (14分)某油脂厂废弃的镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:金属离子Ni2+Al3+Fe3+Fe2+开始沉淀时(c=0.01 mol·L−1)的pH沉淀完全时(c=1.0×10−5 mol·L−1)的pH7.28.73.74.72.23.27.59.0回答下列问题:(1)“碱浸”中NaOH的两个作用是溶解铝及其氧化物和________。为回收滤液①中的金属,可用稀硫酸将其调为中性,生成沉淀。写出该反应的离子方程式___________________。(2)“滤液②”中含有的主要金属离子有______________和Fe3+。(3)“转化”中H2O2的作用是___________________。(4)根据上表数据,如果“转化”后的溶液中Ni2+浓度为1.0 mol·L−1,则“调pH”应控制的pH范围是____________。(5)“控制pH”后从溶液中得到硫酸镍晶体,包含的操作是______________、过滤、洗涤及干燥。(6)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式________________________________________________。17. (13分)天然产物Ⅴ具有抗疟活性,某研究小组以化合物Ⅰ为原料合成Ⅴ及其衍生物Ⅵ 的路线如下(部分反应条件省略,Ph表示—C6H5):(1)化合物Ⅰ中官能团的名称是_________________________。(2)化合物Ⅳ能发生银镜反应,其结构简式为___________________。(3)反应④的反应类型是______________。(4)化合物Ⅲ的芳香族同分异构体中,同时满足如下条件的有_______种。a.遇三氯化铁溶液显紫色;b. 能发生银镜反应;c.含氧官能团与苯环直接相连;d.苯环上有3个取代基。请写出任意一种同时满足上述4个条件且核磁共振氢谱有7组峰,峰面积之比为1:1:1:1:1:1:6的同分异构体的结构简式_________________。(5) 已知:。以苯酚的一种同系物M和HOCH2CH2Cl为原料合成的路线如下:M M的分子式为____________;写出生成的化学反应方程式:__________________________________。 18.(14分)三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室利用反应Cr2O3(s)+3CCl42CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;②碱性条件下,H2O2将Cr3+氧化为CrO2-4;酸性条件下,H2O2将Cr2O2-7还原为Cr3+。回答下列问题:(1)A中的试剂为___________;无水CaCl2的作用是_______________________;反应结束后继续通入一段时间氮气,主要目的是_______________________________。(2)装置E用来收集产物,实验过程中若D处出现堵塞,可通过__________(填操作),使实验能继续进行。(3)装置G中发生反应的离子方程式为_______________________________。(4)测定产品中CrCl3质量分数的实验步骤如下:I.取m g CrCl3产品,在强碱性条件下,加入过量的30% H2O2溶液,小火加热使CrCl3完全转化为CrO2-4,继续加热一段时间;Ⅱ.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使CrO2-4转化为Cr2O2-7;Ⅲ.用新配制的c mol·L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O2-7被Fe2+还原为Cr3+)。①产品中CrCl3的质量分数表达式为___________________(写出含m、c、V的表达式)。②下列操作将导致产品中CrCl3质量分数测定值偏低的是___________(填标号)。a.步骤Ⅰ中未继续加热一段时间 b.步骤II用盐酸替代硫酸c.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质 d.步骤Ⅲ中读数时,滴定前俯视,滴定后平视19.(14分) 乙烷裂解制乙烯具有成本低。收率高、投资少、污染小等优点。目前裂解方法有电催化、光催化裂解、直接裂解、氧气或二氧化碳氧化乙烷裂解等。回答下列问题:(1)乙烷直接裂解时温度、压强及平衡转化率的关系如图所示:①反应的_______ 0,_______(填“”、“”或“=”)。②T℃时,将乙烷与氦气的混合气体(乙烷的物质的量分数为)通入一密闭容器中发生反应。平衡时容器压强为p KPa,此时乙烷的平衡转化率为α,则乙烯的平衡分压为__________KPa,反应的平衡常数_________ KPa (用分压表示,分压=总压×物质的量分数)。(2)已知乙烷直接裂解、氧化裂解和氧化裂解反应如下:(Ⅰ) (Ⅱ) (Ⅲ) ①反应的_______(用含和的代数式表示)。②反应(Ⅰ)、(Ⅱ)的平衡常数分别为、,则反应的平衡常数为_______(用含、的代数式表示)。③在800℃时发生反应(Ⅲ),乙烷的转化率、乙烯的选择性和收率随投料比的变化关系如图所示:控制,而不采用选择性更高的,除可防止积碳外,另一原因是______________________________;时,越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是______________________________。
相关试卷
这是一份湖北省十一校2023-2024学年高三上学期12月第一次联考化学试题含答案,共20页。试卷主要包含了下图是自然界中的氮循环过程,下列实验设计或所选装置合理的是,磷酰氯,以浓差电池等内容,欢迎下载使用。
这是一份湖北省十一校2023-2024学年高三上学期第一次联考化学试题,共4页。
这是一份湖北省十一校2023-2024学年高三上学期第一次联考化学试题,共16页。试卷主要包含了下图是自然界中的氮循环过程,下列实验设计或所选装置合理的是,磷酰氯,以浓差电池等内容,欢迎下载使用。









