


















人教版 (2019)选择性必修2第一节 原子结构教学课件ppt
展开
这是一份人教版 (2019)选择性必修2第一节 原子结构教学课件ppt,文件包含112构造原理与电子排布式电子云与原子轨道ppt、112构造原理与电子排布式电子云与原子轨-教学设计docx、112构造原理与电子排布式电子云与原子轨道-学案解析版docx、112构造原理与电子排布式电子云与原子轨道-练习解析版docx、112构造原理与电子排布式电子云与原子轨道-学案原卷版docx、112构造原理与电子排布式电子云与原子轨道-练习原卷版docx等6份课件配套教学资源,其中PPT共44页, 欢迎下载使用。
秦始皇幻想帝位永在,龙体长存,日思长生药,夜作金银梦。于是各路仙家大炼金丹,他们深居简出于山野之中,过着超脱尘世的神仙般生活。炼丹家以丹砂(硫化汞)、雄黄(硫化砷)等为原料,开炉熔炼。企图制得仙丹,再点石成金,服用仙丹或以金银为皿,均使人永不老死。西洋文人也仿效于暗室或洞穴,单身寡居致力于炼金术。一两千年过去了,死于仙丹不乏其人,点石成金终成泡影。金丹大多徒劳无功而销声匿迹。中外古代炼金术士毕生从事化学实验,为何一事无成?乃因其违背科学规律。他们梦想用升华等简单方法改变金属的性质,把铅、铜、铁、汞变成贵重的金银。
殊不知用一般化学方法是不能改变元素的性质的。化学元素是具有相同核电荷数的同种原子的总称,而原子是化学变化中的最小微粒。在化学反应里分子可以分成原子,原子却不能再分。随着科学的发展,今天“点石成金”已经实现。1919年英国卢瑟福用α粒子轰击氮元素使氮变成了氧。1941年科学家用原子加速器把汞变成了黄金——人造黄金镄(一百号元素)。1980年美国科学家又用氖和碳原子高速轰击铋金属靶,得到了针尖大的微量金。这一切都离不开科学家对原子的研究。
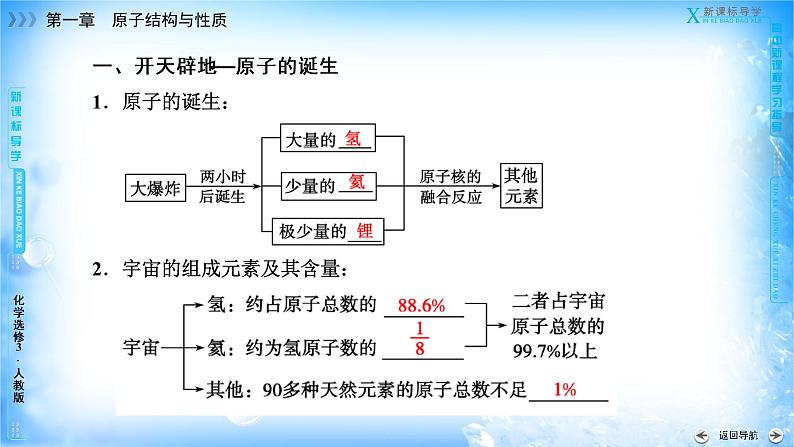
一、开天辟地——原子的诞生1.原子的诞生:2.宇宙的组成元素及其含量:
二、能量与能级1.能层:意义:根据多电子原子的核外电子的____________,将核外电子分成不同的能层符号:能层序数1、2、3、4、5、6、7分别用K、L、M、N、O、P、Q表示2.能级:意义:根据多电子原子中同一能层电子能量不同,将它们分成不同的能级符号:在每一能层中,能级符号分别为ns、np、nd、nf……,其中n代表能层
3.能层、能级中所容纳的电子数:
三、构造原理1.构造原理:(1)含义:在多电子原子中,电子在能级上的排列顺序是电子先排在能量________的能级上,然后依次排在能量________的能级上。(2)构造原理示意图。
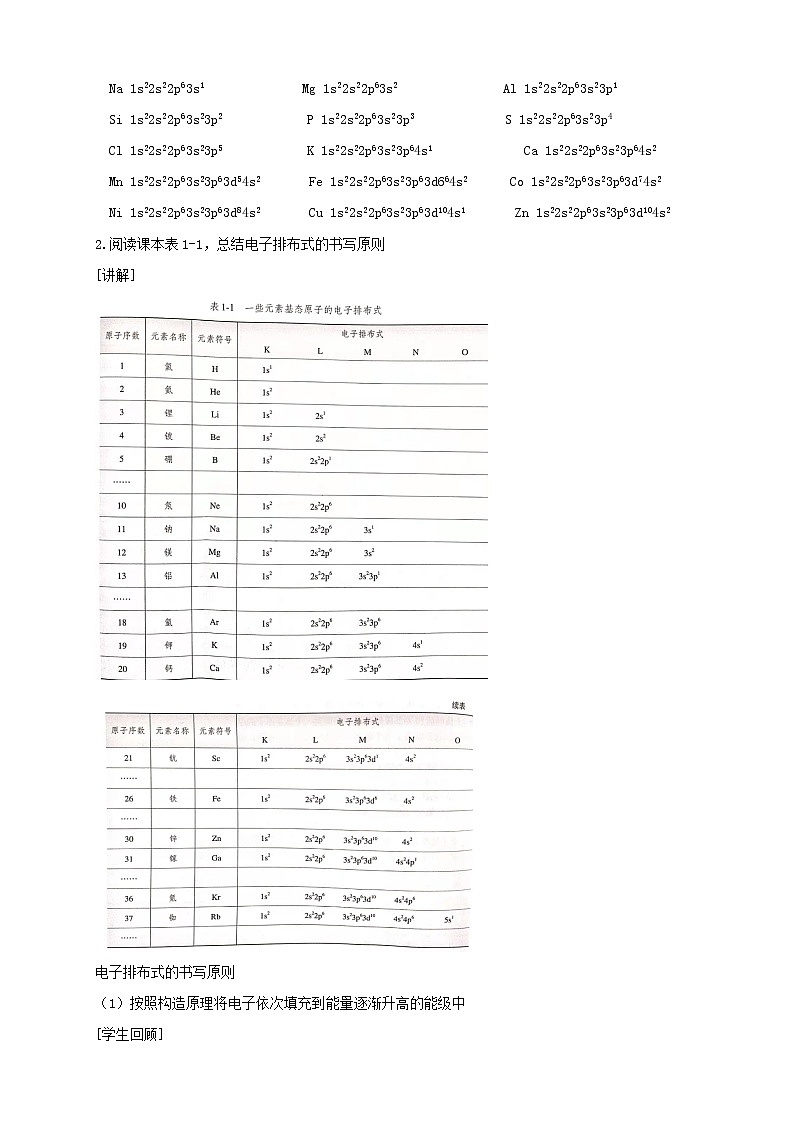
2.电子排布式:(1)概念:将________上所排布的电子数标注在该能级符号__________,并按照能层从左到右的顺序排列的式子。(2)表示方法。钠原子的电子排布式可表示为1s22s22p63s1,也可简化为[Ne]3s1。
1.思考辨析:(1)在原子中第n能层容纳的电子数一定是2n2。( )(2)最外层电子排布式为4s1的元素一定为K。( )(3)能层序数大,能级的能量一定大。( )(4)K的电子排布式为1s22s22p63s23p63d1。( )
2.在M能层中,最多能容纳的电子数为( )A.2 B.8 C.18 D.32解析:原子核外电子的每一能层最多可容纳的电子数为2n2(n为能层序数)。M能层的序数为3,故最多能容纳18个电子。
3.下列各能层不包含d能级的是( )A.O能层B.P能层C.M能层D.K能层解析:多电子原子中,同一能层的电子可分占不同的能级,K能层只有s能级,L能层有s、p能级,从M能层开始有d能级。
4.以下能级符号表述正确的是( )①5s ②1d ③2f ④1p ⑤2d ⑥3f ⑦4f ⑧5d ⑨3p ⑩6sA.③⑤⑦⑧⑨⑩B.①⑦⑧⑨⑩C.①③⑤⑦⑨D.②④⑥⑧⑩解析:每一个能层都有s能级,从第二能层开始出现p能级,从第三能层开始出现d能级,从第四能层开始出现f能级。综上所述,B项正确。
5.下列叙述正确的是( )A.M电子层只有s、p 2个能级,该电子层最多能容纳8个电子B.d能级最多能容纳5个电子,f能级最多能容纳7个电子C.无论哪一电子层的s能级,最多容纳的电子数均为2D.任一电子层都有s、p能级,但不一定有d能级解析:A项,M电子层有s、p、d 3个能级,该电子层最多能容纳18个电子;B项,d能级最多能容纳10个电子,f能级最多能容纳14个电子;C项,每个电子层都从s能级开始,且s能级最多能容纳2个电子;D项,K电子层只有s能级,不含有p能级。
6.按要求书写原子或离子的电子排布式。(1)K______________________。(2)Cl-___________________。(3)Fe_________________________。(4)Fe3+______________________。解析:因E(3d)>E(4s),故19号K先排4s能级,电子排布式为1s22s22p63s23p64s1;氯离子是由氯原子得到一个电子填充在最外层,使原来未充满的3p能级达到8电子稳定结构;铁是26号元素,其价电子与次外层的d能级有关,当铁失去电子时,是从最外层开始失去电子,所以先失去的是4s能级上的两个电子,再失去次外层3d能级上的一个电子。
1s22s22p63s23p64s1
1s22s22p63s23p6
1s22s22p63s23p63d64s2
1s22s22p63s23p63d5
1.不同能层分别有多少个能级?与能层序数(n)间存在什么关系?2.原子核外电子的每一个能层最多可容纳的电子数与能层序数(n)间存在什么关系?3.以s能级为例,不同能层的s能级间能量有何关系?同一能层,不同能级间能量有何关系?
知识点一 能层和能级的组成与能量关系
1.提示 任一能层的能级数等于该能层序数。相等。2.提示 各层最多容纳的电子数为2n2。3.提示 1s
相关课件
这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件,共25页。PPT课件主要包含了构造原理,电子排布式,能级交错现象,ns2np6,s22s22p1,s22p3,s23p63d10,s22s22p6等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第一节 原子结构多媒体教学课件ppt,共13页。PPT课件主要包含了PART01,PART02,·电子云与原子轨道·等内容,欢迎下载使用。
这是一份化学选择性必修2第一节 原子结构教课内容ppt课件,共33页。PPT课件主要包含了HClO4,PH3,HNO3,NaOH,N的非金属性比P强等内容,欢迎下载使用。










