



【考前三个月】2022届高考化学(2019新人教版)考前专题复习课件:专题2 离子反应
展开
这是一份【考前三个月】2022届高考化学(2019新人教版)考前专题复习课件:专题2 离子反应,共60页。PPT课件主要包含了最新考纲展示,基础回扣,生成难溶物质,不反应,生成难溶性氢氧化物,生成弱酸或气体,发生氧化还原反应,电荷不守恒,答案A,答案C等内容,欢迎下载使用。
1.了解电解质、非电解质、强电解质、弱电解质的概念。2.了解离子反应的概念、离子反应发生的条件,了解常见离子的检验方法。3.能正确书写化学方程式和离子方程式,并能进行有关计算。
题型1 离子反应的条件——离子共存问题
题型2 离子方程式的书写及正误判断
题型3 离子检验及推断
1.正误判断,正确的打“√”,错误的打“×”(1)NH3、SO2的水溶液均导电,所以NH3、SO2均属于电解质( )(2)强电解质饱和溶液一定比弱电解质饱和溶液的导电性强( )(3)NaCl溶液能导电,故NaCl溶液为电解质( )(4)Fe、Cu、Ag熔化能导电,故Fe、Cu、Ag为电解质( )
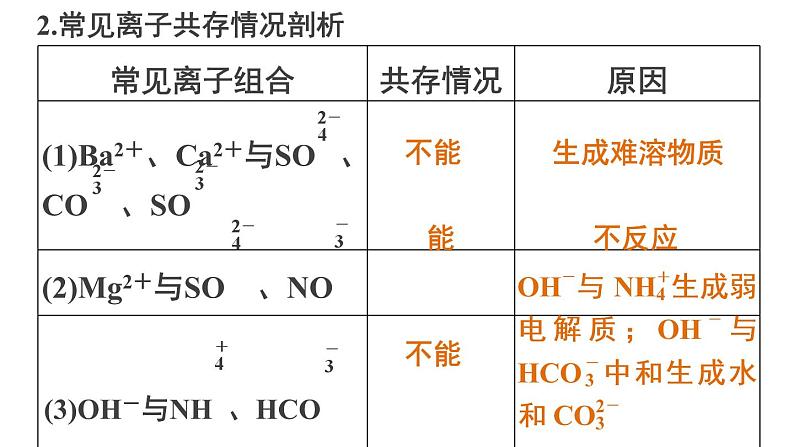
2.常见离子共存情况剖析
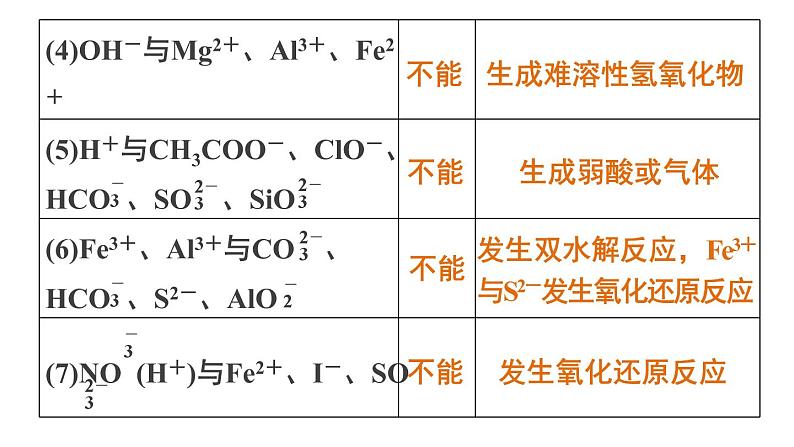
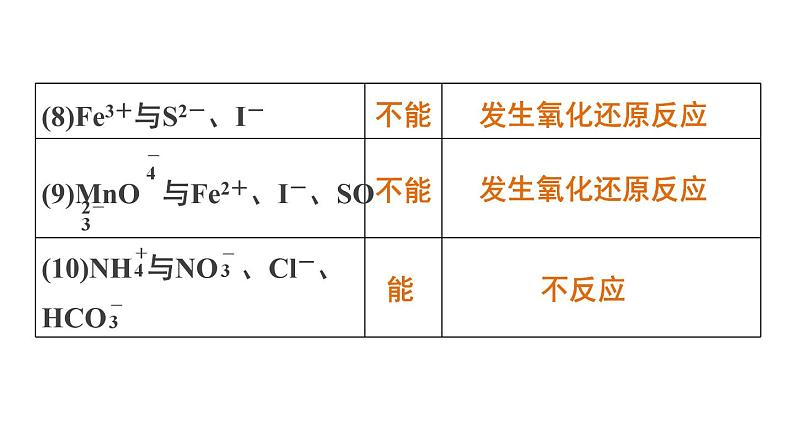
发生双水解反应,Fe3+与S2-发生氧化还原反应
3.指出下列离子方程式错误的原因
产物中的Fe3+应为Fe2+
反应物中遗漏Cu2+和OH-,产物中遗漏Cu(OH)2↓
碳酸钙不能拆写成离子形式
胶体不能标注“↓”,应注明(胶体)
4.完成下列离子方程式:(1)钠与水反应:________________________________。(2)氯气通入水中:____________________________________________________________。(3)向氢氧化钠溶液中通入少量CO2:___________________________。(4)碳酸钙中滴入醋酸溶液:_______________________________________________________。
2Na+2H2O===2Na++2OH-+H2↑
CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
(5)铝片投入氢氧化钠溶液:_____________________________________________。(6)氯化铝溶液中加足量碳酸氢钠溶液:___________________________________。(7)FeCl3溶液与Cu反应:_________________________。(8)酸性硫酸亚铁溶液中加入过氧化氢溶液:____________________________________。
2Fe3++Cu===Cu2++2Fe2+
2Fe2++H2O2+2H+===2Fe3++2H2O
(9)实验室用MnO2与浓盐酸制取Cl2:______________________________________________。(10)NO2溶于水:_______________________________。
3NO2+H2O===2H++2NO +NO
解析 逐一分析判断每个选项中四种微粒的性质,如果能生成沉淀、气体、弱电解质、络合离子或发生氧化还原反应就不能大量共存。
C项,四种离子之间不发生反应,能大量共存;D项,Fe3+和SCN-能形成络合离子,不能大量共存。答案 C
解析 从离子之间能否发生复分解反应、沉淀反应或氧化还原反应等角度分析。A项四种离子之间不发生任何反应;
D项Al3+和CO 之间能发生水解相互促进的反应:2Al3++3CO +3H2O===2Al(OH)3↓+3CO2↑,Ca2+、CO 可发生沉淀反应。
解析 A项,Al3+和S2-可以发生水解相互促进反应而不能大量共存,该选项错误;B项,酸性溶液中,HClO具有强氧化性,能将I-氧化,该选项错误;
D项,Fe3+在pH为3.7的溶液中就可沉淀完全,则在中性溶液中生成Fe(OH)3沉淀,该选项错误。答案 C
解析 A项,pH=1的溶液显强酸性,CO 与H+因生成CO2、H2O而不能大量共存;
B项,c(H+)=1×10-13 ml·L-1的溶液pH=13,溶液显强碱性,Mg2+、Cu2+分别与OH-反应生成Mg(OH)2、Cu(OH)2沉淀而不能大量共存;
D项,Fe3+、Fe2+均能与SCN-反应,生成难电离的弱电解质Fe(SCN)3、Fe(SCN)2而不能大量共存。
溶液中离子能否大量共存的判断准则:看离子在所给条件下能否反应。其判断步骤:先看条件,后看反应。1.先看条件——题给条件一看准题干要求,需辨别的离子组是“大量共存”还是“不能大量共存”,是“可能”还是“一定”。二看准附加条件,如①溶液的颜色,若为无色溶液则MnO 、Fe3+、Cu2+、Fe2+等有色离子不能存在;②溶液的酸、碱性;③特定离子或分子的存在等。
2.后看反应——所给离子之间能否发生反应 熟记发生离子反应不能大量共存的几种情况
(一)一般离子共存问题
解析 B项NO (H+)能氧化Fe2+;
D项Fe3+、Cu2+与OH-生成沉淀。答案 A
解析 A项Fe3+能氧化I-;D项H+与F-结合成弱酸氢氟酸。
解析 A项中PbSO4难溶于水;
B项中Fe3+与S2-发生氧化还原反应;
解析 Fe3+、NH 水解都使溶液呈酸性,在中性条件下不能大量存在,A项错误;
=1012的碱性溶液,NH 、Al3+均不能大量存在,D项错误。
5.已知某强酸性溶液中存在较多的Ba2+、NO ,则该溶液中还可能大量存在的离子组是( )A.K+、NH 、HCO B.Fe2+、Ca2+、Cl-C.Cu2+、Mg2+、SO D.Na+、Cu2+、Cl-
B项中Fe2+和NO 不能在强酸性溶液中大量共存:3Fe2++4H++NO ===3Fe3++NO↑+2H2O;
Mg2+与OH-反应生成Mg(OH)2沉淀,B错误;
Fe3+为棕黄色,C错误;
澄清透明是指不生成沉淀,不是无色,D正确。
解析 A项高锰酸钾能氧化葡萄糖分子;
C项BaCO3难溶于水;
D项中S2-与Cu2+生成CuS沉淀。
1.(2014·四川理综,3)能正确表示下列反应的离子方程式是( )A.Cl2通入NaOH溶液:Cl2+OH-===Cl-+ClO-+H2OB.NaHCO3溶液中加入稀HCl:CO +2H+===CO2↑+H2OC.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO +4NH +2H2OD.Cu溶于稀HNO3:3Cu+8H++2NO ===3Cu2++2NO↑ +4H2O
解析 A项,该离子方程式电荷不守恒,正确的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O;
D项,铜溶于稀硝酸后生成NO、Cu(NO3)2、H2O,该离子方程式中电荷、得失电子、原子都守恒,故该选项正确。答案 D
2.正误判断,下列指定反应的离子方程式,正确的打“√”,错误的打“×”(1)Ca(HCO3)2溶液与少量NaOH溶液反应:HCO +Ca2++OH-===CaCO3↓+H2O( )(2013·江苏,8D)(2)(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓( )(2014·江苏,7B)
(3)Fe2(SO4)3和Ba(OH)2溶液反应的离子方程式:Fe3++SO +Ba2++3OH-===Fe(OH)3↓+BaSO4↓( )(2014·安徽理综,8C)(4)向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO +2H2O===Al(OH)3↓+HCO ( )(2014·江苏,7D)
(5)向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-( )(2013·海南,10C)(6)NH4HCO3溶于过量的浓KOH溶液中:NH + HCO +2OH-===CO + NH3↑+2H2O( )(2013·海南,10A)
(7)向明矾溶液中滴加Ba(OH)2溶液,恰好使SO 沉淀完全:2Al3++3SO +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓( )(2013·海南,10B)
3.(高考题组合)完成下列离子方程式(1)[2013·北京理综,27(1)]H2SO4溶解Al2O3的离子方程式是____________________________。
Al2O3+6H+===2Al3++3H2O
(2)[2013·海南,13(3)]H和O元素组成的化合物中,既含有极性共价键又含有非极性共价键的是______。此化合物在酸性条件下与高锰酸钾反应的离子方程式为_____________________________________________;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为________________________________。
(3)[2013·海南,14(1)]海水提溴过程中,向浓缩的海水中通入________,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO ,其离子方程式为______________________________________________________________________________________。
解析 溴在碳酸钠溶液的歧化可把反应理解为溴与水发生歧化,产生的H+被碳酸钠吸收。
1.“少定多变”法书写与量有关的离子方程式所谓的“少定”,即将量少的反应物的计量数确定为1,而“多变”即过量的反应物的计量数根据反应的需要确定,不受化学式中比例制约,是可变的。量少物质产生的离子数之比符合化学式。
2.判断离子反应顺序的方法(1)氧化还原型离子反应。同一氧化剂(或还原剂)可能与多种还原剂(或氧化剂)反应,解此类题应抓住三点:①确定氧化剂或还原剂强弱顺序。如还原性I->Fe2+>Br->Cl-,氧化性Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+等;②根据强弱规律,判断反应顺序。同一氧化剂与多种还原剂反应,还原性强的还原剂优先发生反应;同一还原剂与多种氧化剂反应,氧化性强的氧化剂优先发生反应;③分步计算。先判断过量,后计算。
(一)简单离子反应的正误判断
1.下列离子方程式不正确的是( )A.向AgCl悬浊液中加入Na2S溶液:2AgCl+S2-===Ag2S+2Cl-B.向NaHCO3溶液中加入NaOH溶液:HCO +OH-===CO + H2OC.向Ba(OH)2溶液中加入稀H2SO4:Ba2++OH-+H++SO ===BaSO4↓+H2OD.向Cu粉中加入过量的浓HNO3:Cu+4H++2NO ===Cu2+ +2NO2↑+2H2O
解析 B项得失电子不守恒。
(二)复杂离子反应的正误判断4.下列反应的离子方程式书写正确的是( )A.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O ===Al(OH)3↓+3NHB.将Fe(OH)2溶于过量的稀硝酸:Fe(OH)2+2H+===Fe2++ 2H2OC.用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O=== HSO +HClOD.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
解析 氢氧化铝不能溶于过量的氨水,A对;硝酸具有强氧化性,可将Fe2+氧化为Fe3+,B错;次氯酸根可将+4价的硫元素氧化为+6价,C错;Fe3+具有强氧化性,可将I-氧化为I2,D错。答案 A
解析 B项应生成Fe(OH)3沉淀;C项还应有CaCO3沉淀生成;D项被氧化的都是H2O2中-1价的氧。答案 A
解析 A项,应是NO (H+)氧化SO2;
B项,由于n(FeI2)∶n(Cl2)=4∶5,且还原性I->Fe2+,离子方程式应为2Fe2++8I-+5Cl2===2Fe3++4I2+10Cl-;
解析 A项反应后溶液呈碱性;
D项酸性条件下不能生成OH-。答案 C
(三)新情景下离子方程式的书写8.为探究NH4HCO3和NaOH的反应,设计实验方案如下:含0.1 ml NH4HCO3的溶液中加入0.1 ml NaOH,反应完全后,滴加氯化钙稀溶液。若有沉淀,则NH4HCO3与NaOH的反应可能为____________________________________(写离子方程式);若无沉淀,则NH4HCO3与NaOH的反应可能为_____________________________________(写离子方程式)。
解析 向NH4HCO3溶液中加入NaOH时,发生的离子反应有:HCO +OH-===CO +H2O与NH +OH-===NH3·H2O,若NaOH量不足,则两反应存在先后次序问题,
9.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是_____________________________________。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。①装置中由NaCl转化为NaClO过程中的离子方程式_________________________________、________________________________,总的离子方程式__________________________ 。
②海水中含有Ca2+、Mg2+、HCO 等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是_____________________________________。③若每隔5~10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释_______________________________________________________________________________________________________________________________________________________________________________。
阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为2Cl--2e-===Cl2↑,产生的氯气与水发生反应:Cl2+H2O===HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的
10.工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下:
(1)浓盐酸溶解粗CuO时可能发生的离子方程式___________________________、________________________。(2)写出向溶液A中加入NaClO的离子方程式:________________________________________。
FeO+2H+===Fe2++H2O
完成上述转化过程中的离子方程式①_____________________________;②___________________;③_______________________________________。
Fe(OH)3+3H+===Fe3++3H2O
2Fe3++Fe===3Fe2+
(3)用沉淀C制取FeCO3的流程如下:
1.(2014·浙江理综,13)雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH 、Mg2+、Al3+、SO 、NO 、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
解析 由气体1使湿润红色石蕊试纸显蓝色的现象,确定气体1为氨气,溶液中一定存在NH ;
由沉淀2与酸反应的现象判断其成分中一定有碳酸钡,可能存在氢氧化铝,所以B项错误;
Na+、Cl-无法确定是否存在,C项正确。
2.(2014·上海,18改编)某未知溶液可能含Cl-、CO 、Na+、SO 、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )A.一定有Cl- B.一定有SOC.一定没有Al3+ D.一定有CO
解析 本题考查离子的共存和检验。溶液滴在蓝色石蕊试纸上,试纸变红,说明溶液呈酸性含有H+,则一定没有CO ;
在上层清液中滴加硝酸银溶液,产生白色沉淀,可能为Ag2SO4或AgCl或二者混合物,由于前面已引入Cl-,无法判断是否含有Cl-,所以选B。答案 B
解析 加入过量NaOH溶液,加热,得到0.02 ml气体,说明有NH ,为0.02 ml;
则根据电荷守恒可知一定有Cl-,至少有0.04 ml,B正确。答案 B
离子推断的四项原则(1)肯定性原则:根据实验现象推出溶液中肯定存在或肯定不存在的离子(记住几种常见的有色离子:Fe2+、Fe3+、Cu2+、MnO 、CrO 、Cr2O )。(2)互斥性原则:在肯定某些离子的同时,结合离子共存规律,否定一些离子的存在(要注意题目中的隐含条件,如:酸性、碱性、指示剂的变化、与铝反应产生H2、水的电离情况等)。
(3)电中性原则:溶液呈电中性,一定既有阳离子,又有阴离子,且溶液中正电荷总数与负电荷总数相等(这一原则可帮助我们确定一些隐含的离子)。(4)进出性原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
1.下列判断正确的是( )A.向某溶液中加入AgNO3溶液生成白色沉淀,加入稀盐酸时沉淀 不溶解,可确定溶液中有Cl-存在B.对某溶液进行焰色反应时火焰颜色为黄色,则该溶液中一定有 Na+,可能有K+C.加入盐酸时有能使澄清石灰水变浑浊的气体生成,则原溶液中 一定有大量的CO 存在D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用 NaOH溶液不能一次性鉴别出来
解析 盐酸中的Cl-也可与Ag+生成白色沉淀,A项不正确;Na+火焰的颜色为黄色,可以遮掩K+的浅紫色的火焰颜色,B项正确;
Mg2+、Cu2+、Fe2+与NaOH反应产生的沉淀的颜色不同,分别为白色沉淀,蓝色沉淀,白色沉淀变为灰绿色,最终变为红褐色,能一次鉴别,D项不正确。答案 B
2.溶液X中可能含有K+、Mg2+、Al3+、AlO 、SiO 、CO 、SO 、SO 中的若干种离子。某同学对该溶液进行了如下实验:
下列判断正确的是( )A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物C.K+、AlO 和SiO 一定存在于溶液X中D.CO 和SO 一定不存在于溶液X中
溶液中必须含有阳离子,所以X溶液中一定含有K+。
气体甲中至少含有CO2、SO2中的一种,不一定是纯净物,沉淀甲是硅酸。
3.有一瓶澄清溶液,其中可能含有NH 、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO 、CO 、SO 中的几种。取该溶液进行以下实验。(1)填写表中空白:
(2)根据以上事实,该溶液中肯定存在的离子是________。(3)写出实验②、④、⑤中反应的离子方程式:实验②________________________________________________________________________;实验④________________________________________________________________________;实验⑤________________________________________________________________________。
解析 ①溶液呈强酸性肯定有H+,故肯定不含有CO ;
③在滴入NaOH溶液过程中及滴加完毕后,均无沉淀产生,故肯定不含有Mg2+、Al3+;
(二)定量离子推断型4.某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO 、SO ,现取两份100 mL溶液进行如下实验:实验1:向第一份溶液中加入足量AgNO3溶液,干燥得沉淀3.50 g。实验2:向第二份溶液中加入足量BaCl2溶液后,干燥得沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是( )①一定存在Mg2+ ②可能存在CO ③一定存在Cl- ④可能存在Ba2+ ⑤可能存在Mg2+A.①③ B.②③C.③⑤ D.④⑤
根据实验1,原溶液一定含Cl-,n(Cl-)= ≈0.024 ml
负电荷总数为(2×0.01 ml+0.024 ml) NA·ml-1=0.044NA而H+所带正电荷总数为0.01NA,由于Ba2+不存在,所以一定存在Mg2+。答案 A
6.某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
A.①②⑤ B.①③④ C.②⑥⑦ D.①②④⑥
相关课件
这是一份【考前三个月】2022届高考化学(2019新人教版)考前专题复习课件:专题1 常用化学计量,共60页。PPT课件主要包含了最新考纲展示,基础回扣,15mol,55g,15NA,67%,mol·L-1,24L,真题回顾,答案D等内容,欢迎下载使用。
这是一份【考前三个月】2022届高考化学(2019新人教版)考前专题复习课件:专题6 化学与技术,共60页。PPT课件主要包含了最新考纲展示,基础回扣,①升高,NH42SO3,+H2,NH3+CO2+,NaHCO3,新型无机非金属,活动性,电解法等内容,欢迎下载使用。
这是一份【考前三个月】2022届高考化学(2019新人教版)考前专题复习课件:专题1 物质的组成、分类及化学用语,共60页。PPT课件主要包含了最新考纲展示,基础回扣,①③④⑥⑦⑨,①②③④⑦⑧⑩,①②③⑦⑧⑩,⑤⑥⑨,c2CO,mol,答案B,答案C等内容,欢迎下载使用。









