





苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物备课ppt课件
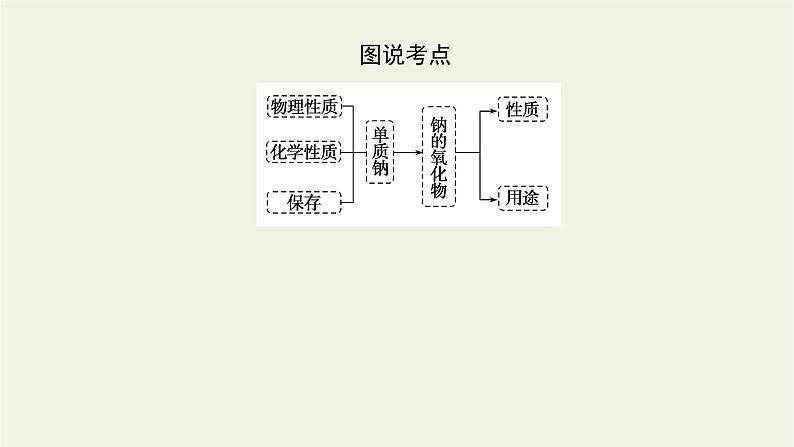
展开课程目标1.掌握钠的重要性质,了解其用途。2.学会用钠原子结构分析钠的化学性质的思维方式。3.了解钠的氧化物的性质与用途。
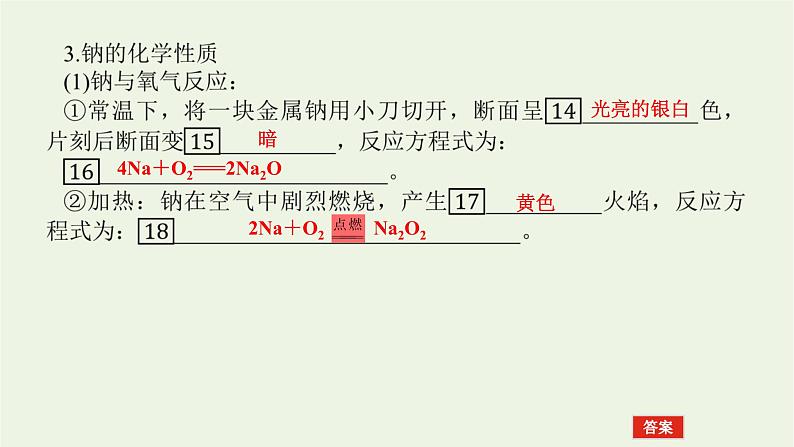
4Na+O2===2Na2O
2Na+2H2O===2NaOH+H2↑
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2CO2===2Na2CO3+O2
[即时自测]1.判断正误,正确的打“√”,错误的打“×”(1)钠元素在自然界以游离态形式存在。( )(2)金属元素在自然界都以化合态形式存在。( )(3)钠与氧气反应只能得到一种产物。( )(4)钠与水反应是置换反应。( )(5)过氧化钠为淡黄色固体。( )(6)Na2O2有漂白性。( )(7)Na2O2中阴、阳离子个数比为1∶1。( )
2.下列关于钠的性质叙述中,不正确的是( )A.切下一小块钠,投入水中,钠熔成小球,说明钠与水反应有热量放出B.从钠能与水反应可推知钠也能与盐酸反应C.钠在空气中燃烧生成氧化钠D.切开一块钠,呈银白色,很快变暗,说明钠常温下能与氧气反应
3.金属钠投入水中发生剧烈反应,并有氢气生成,装运金属钠的包装箱应贴的图标是( )
4.Na2O和Na2O2在下列哪一点性质上是相似的( )A.颜色 B.水溶液的酸碱性C.氧化性 D.漂白性
5.根据你对金属钠性质的了解,回答下列问题。(1)下列关于钠的叙述中,正确的是________。A.钠是银白色金属,密度比水的大B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠C.金属钠在空气中燃烧,生成氧化钠D.金属钠的熔点很高(2)由于金属钠很容易跟空气中的________等物质反应,通常将它保存在________里,以使它与________等隔绝。
解析:通过外观和钠与氧气反应的实验现象可知,钠的物理性质有:银白色、密度小、熔沸点低、质软、能导电、导热等,作为活泼的金属,钠易与O2等发生化学反应。(1)A选项中钠的密度比水的小,错误;C选项中有关钠在空气中燃烧的产物说法有误;D选项中有关金属钠熔点的描述不符合事实。只有B项正确。(2)由于金属钠很活泼,很容易跟空气中的氧气等物质反应,因此保存时应隔绝空气,通常保存在煤油里,这是因为钠的密度大于煤油的密度且钠与煤油不反应,钠在煤油中沉在底部而避免了与空气接触。
提升点1 钠的化学性质应用分析[例1] 将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )A.盐酸B.饱和氢氧化钠溶液C.FeCl3溶液D.CuSO4溶液
注意对比分析钠与水反应和钠与酸、碱、盐溶液反应现象的相似和差异。
【解析】 钠与水溶液反应均放出氢气;A项,发生反应为2Na+2HCl===2NaCl+H2↑,只有气体无沉淀;B项,NaOH溶液是饱和溶液,投入钠后,消耗水,析出氢氧化钠晶体;C项,钠与水反应生成的氢氧化钠还能进一步与FeCl3反应产生氢氧化铁沉淀;D项,钠与水反应生成的氢氧化钠还能进一步与CuSO4反应产生氢氧化铜沉淀。
[提升1] 将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述中不正确的是( )A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠B.“出汗”是因为生成的氢氧化钠吸收空气中的H2O在表面形成了溶液C.最后变成碳酸钠粉末D.该过程中的所有化学反应均为氧化还原反应
解析:钠露置在空气中表面迅速变暗,是因为Na与O2反应生成了Na2O,Na2O与水反应生成NaOH,NaOH又吸收空气中的H2O和CO2,生成Na2CO3·10H2O,Na2CO3·10H2O逐渐风化脱水,最后变成Na2CO3粉末,该过程中只有钠的氧化是氧化还原反应,D错误。
关键能力1.钠露置在空气中的变化过程分析金属钠长期露置于空气中最终完全转变为Na2CO3粉末,此过程中的主要变化与现象有:
钠与酸反应2Na+2HCl===2NaCl+H2↑2Na+2H+===2Na++H2↑钠与酸电离出的H+反应,所以比与水反应更剧烈。
发生的主要变化的化学方程式为:①4Na+O2===2Na2O②Na2O+H2O===2NaOH④2NaOH+CO2===Na2CO3+H2O,Na2CO3+10H2O===Na2CO3·10H2O⑤Na2CO3·10H2O===Na2CO3+10H2O
2.钠与盐溶液的反应钠与盐溶液反应时,首先与水反应生成NaOH,然后NaOH与盐发生复分解反应(若氢氧化钠不与盐反应,则只有钠与水的反应)。如Na与CuSO4溶液的反应:2Na+2H2O===2NaOH+H2↑ 2NaOH+CuSO4===Cu(OH)2↓+Na2SO4总反应式为:2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑。
提升点2 Na2O2的性质应用 [例2] (双选)对于反应:2Na2O2+2H2O===4NaOH+O2↑,下列说法中正确的是( )A.Na2O2是氧化剂,H2O是还原剂B.Na2O2既是氧化剂,又是还原剂C.该反应中电子转移的数目为4e-D.每有18 g H2O与足量Na2O2反应,则固体增重2 g
【解析】 在Na2O2与H2O的反应中,Na2O2中-1价氧元素原子之间发生电子转移,Na2O2既是氧化剂又是还原剂,电子转移的数目为2e-。根据元素守恒,固体增重质量等于参加反应的水中氢元素的质量,即18 g H2O参加反应,固体增重2 g。
[提升2] 在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )A.9∶4 B.1∶1C.7∶6 D.6∶7
Na2O2与CO2反应后固体的增重,可看作参加反应的“CO2”中“CO”的质量,Na2O2与H2O反应后固体的增重,可看作参加反应的“H2O”中“H2”的质量。
关键能力Na2O2与CO2、H2O反应的3个重要关系
1.金属钠着火时,能用来灭火的是( )A.水 B.湿抹布盖灭C.干沙 D.泡沫灭火剂
解析:钠着火时,不能用水、湿抹布或泡沫灭火剂灭火,因为钠跟水剧烈反应产生可燃性气体——氢气。钠或钾着火时一般用干沙覆盖。
2.(双选)将一小块金属钠投入下列物质的水溶液中,既能生成气体,又能生成沉淀的是( )A.MgSO4 B.BaCl2C.H2SO4 D.CuCl2
3.钠跟水的反应现象的表述错误的是( )A.Na浮于水面上 B.Na熔成小球C.Na四处游动 D.水溶液变红
解析:加入酚酞溶液才会变红。
4.下列关于钠的说法正确的是( )A.金属钠与氧气反应,条件不同,产物不同B.金属钠着火可用水扑灭C.少量的钠可保存在汽油中D.钠的化学性质活泼,可从CuSO4溶液中置换出Cu
解析:钠与氧气反应,在常温下生成Na2O,在加热时生成Na2O2,故A项对;若钠着火用水扑灭,钠与水反应生成可燃性气体H2,且水与钠燃烧的产物Na2O2反应生成O2,使燃烧更剧烈,故B项错;由于汽油易挥发且易燃烧,故C项错;由于钠与盐溶液反应时,首先是钠与水发生反应,生成的NaOH再与盐溶液反应,故D项错。
5.钠的氧化物有氧化钠和过氧化钠两种。(1)写出过氧化钠与水及二氧化碳反应的化学方程式,并分析电子转移的方向和数目,指出氧化剂、还原剂。
解析:(1)过氧化钠与水及二氧化碳的反应中,过氧化钠既是氧化剂又是还原剂。
(2)在呼吸面具和潜水艇里,用作氧气来源的物质是________。A.H2O2 B.Na2O2C.KClO3 D.KMnO4(3)把Na2O2投入到少量紫色石蕊溶液中,有什么现象?如何解释?__________________________________________________________________________________________________________________________________________。
石蕊溶液先变为蓝色,后变为无色。Na2O2与水反应生成的NaOH使石蕊溶液由紫色变为蓝色;Na2O2具有强氧化性、漂白性,因此片刻后,溶液由蓝色变为无色
解析: (2)因为Na2O2与CO2和水反应均可产生O2,故在呼吸面具和潜水艇里Na2O2用作O2来源的物质。(3)Na2O2具有强氧化性,可以使有机色质褪色。
苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物备课课件ppt: 这是一份苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物备课课件ppt,共36页。
2020-2021学年专题3 从海水中获得的化学物质第二单元 金属钠及钠的化合物备课ppt课件: 这是一份2020-2021学年专题3 从海水中获得的化学物质第二单元 金属钠及钠的化合物备课ppt课件,共60页。PPT课件主要包含了化合态,氯化钠,碳酸钠,硫酸钠,银白色,钠熔点低反应放热,钠的密度比水小,钠与水反应生成气体,钠与水反应生成碱,H2O等内容,欢迎下载使用。
2021学年第二单元 金属钠及钠的化合物备课课件ppt: 这是一份2021学年第二单元 金属钠及钠的化合物备课课件ppt,共18页。













