

高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质学案设计
展开2.了解浓硫酸的特性。
3.了解硫酸的应用。
图说考点
学业基础——自学·思记·尝试
[新知预习]
一、硫酸的制备
1.古代采用加热胆矾1 或绿矾2 的方法制取硫酸。
2.接触法制硫酸
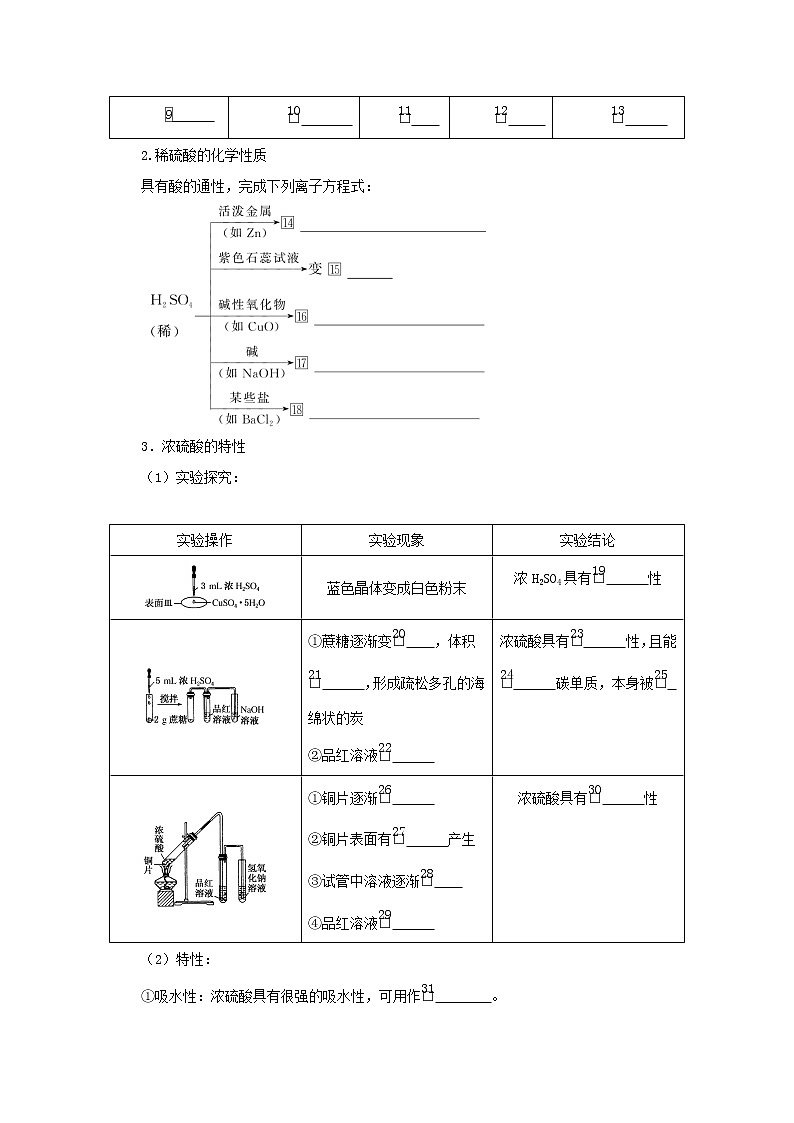
二、硫酸的性质和用途
1.浓硫酸的物理性质
2.稀硫酸的化学性质
具有酸的通性,完成下列离子方程式:
3.浓硫酸的特性
(1)实验探究:
(2)特性:
①吸水性:浓硫酸具有很强的吸水性,可用作 eq \(□,\s\up1(31)) 。
②脱水性:将 eq \(□,\s\up1(32)) 中的H、O元素按原子个数比 eq \(□,\s\up1(33)) 脱出。
③强氧化性:
4.硫酸的用途
(1)制造化肥、医药、农药。
(2)金属矿石的处理、金属材料的表面清洗。
(3)制取硫酸盐,制取难挥发性酸。
(4)化学试剂。
[即时自测]
1.判断正误,正确的打“√”,错误的打“×”
(1)用硫铁矿制硫酸的三步反应均为氧化还原反应。( )
(2)浓H2SO4常温下与铝、铁不反应。( )
(3)一定量的浓硫酸与铜反应时,即使铜过量,浓硫酸也不会完全反应。( )
(4)浓H2SO4有脱水性,所以常用作干燥剂。( )
(5)浓H2SO4与木炭反应既表现氧化性又表现出酸性。( )
2.
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如右图)中进行的,吸收塔里还装入了大量瓷环。下列有关说法不正确的是( )
A.从①处通入SO3,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
3.观察如图,并回答下列问题:
(1)该设备的名称叫 。
(2)矿石粉碎成细小矿粒的目的是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)该设备中发生反应的化学方程式是
________________________________________________________________________
________________________________________________________________________。
4.(1)填写硫酸在下列用途或反应中表现的性质(用字母填在横线上)。
A.难挥发性 B.强酸性 C.吸水性 D.脱水性 E.强氧化性 F.催化作用
①浓硫酸可用作气体干燥剂 ;
②往晶体硫酸铜中加浓硫酸,晶体变白 ;
③实验室制硝酸 ;
(化学方程式为NaNO3+H2SO4===HNO3↑+NaHSO4)
④浓硫酸与铜反应 ;
⑤浓硫酸使湿润的蓝色石蕊试纸先变红后又变黑 。
(2)用过量的锌与浓硫酸反应时,可能产生的气体有 ,理由是 。
核心素养——合作·探究·分享
硫酸制备中反应与条件的控制
[例1] 某小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。
已知:SO3遇水剧烈反应,放出大量热,产生酸雾;98.3%的浓H2SO4可以吸收SO3和酸雾。
供选试剂:蒸馏水、0.5 ml·L-1 BaCl2溶液、98.3%的浓H2SO4、2.0 ml·L-1 NaOH溶液、酸性KMnO4溶液。
(1)c中应选用的试剂是 ,e中试剂的作用是 ,f中收集的气体是 。
(2)某同学提出用饱和NaHSO3溶液代替98.3%的浓H2SO4,请你评价该方案是否可行,若可行不必说明理由;若不可行,简述其理由:
________________________________________________________________________。
[提升1] 工业上制硫酸的设备分为三大部分:沸腾炉、接触室、吸收塔,下图中的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
若在反应过程中有有毒气体产生,一定要有尾气吸收装置;计算生成的硫酸可利用关系式:FeS2~2H2SO4。
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的化学方程式: 。
(2)图中的乙、丙分别相当于工业上制取硫酸装置中的 、 。
(3)从乙装置中出来的气体有 。
(4)丙装置的作用为 ,丁中的现象为 。
(5)本实验设计还存在的较明显缺陷是 。
(6)假设在煅烧黄铁矿(含FeS2矿石)时,有5%的硫损失,在SO2的催化氧化过程中,有92%的SO2转化为SO3,在吸收塔中损失SO3的质量分数为0.6%。现有含FeS295%的黄铁矿100 t,则可制得98%的浓硫酸 t。
关键能力
1.接触法制硫酸的原理
三原理:化学平衡原理、热交换原理、逆流原理。
(1)化学平衡原理:增大反应物浓度、增大反应物间接触面积,能提高反应速率并使化学平衡向正反应方向移动,以充分提高原料利用率。(化学平衡移动内容将在《化学反应原理》中学习)
(2)热交换原理:在接触室中生成的热量经过热交换器,传递给进入接触室的需要预热的混合气体,为二氧化硫的接触氧化和三氧化硫的吸收创造了有利条件。
(3)逆流原理:液体由上向下流,气体由下向上升,两者在逆流过程中充分反应。
2.硫酸工业中的有关计算
(1)物质纯度、转化率、产率的计算
①物质纯度= eq \f(不纯物质中含纯物质的质量,不纯物质的总质量) ×100%
②原料利用率= eq \f(实际参加反应的原料量,投入原料总量) ×100%
③产率= eq \f(实际产量,理论产量) ×100%
(2)多步反应计算
①关系式法:先写出多步反应的化学方程式,然后找出反应物和生成物之间物质的量(或质量)之比,列出关系式,即可一步计算。
②元素守恒法:找出主要原料和最终产物之间物质的量的对应关系。找出此关系的简便方法,就是分析原料与产物之间所含关键元素原子个数的关系,如FeS2~2H2SO4、S~H2SO4。
特别提醒
对于接触法制硫酸要熟记四个“三”,即“三阶段,三设备,三反应,三原理”。 浓硫酸和稀H2SO4对比
[例2] 某学习小组在鉴别浓硫酸和稀硫酸时,设计了如下方案:
(1)其中可行的是 (填序号)。
(2)其中稍作改进就能成为可行方案的是 ,改进方法是________________________________________________________________________。
(3)完全错误的是 ,因为
________________________________________________________________________。
eq \a\vs4\al(状元随笔) 浓硫酸吸水性和脱水性的区别:
吸水性:浓硫酸吸取物质中本身存在的水或结晶水的性质。
脱水性:浓硫酸将组成有机物的H、O元素按原子个数比2∶1以“H2O”的形式脱去的性质
由此看出:二者的根本区别在于物质本身是否存在水分子。
[提升2] 下列关于浓硫酸的说法中,正确的是( )
A.浓硫酸与铜共热的反应中,浓硫酸既表现出强氧化性,又表现出酸性
B.浓硫酸有强氧化性,一定量的浓硫酸与足量的锌反应,不会有氢气产生
C.浓H2SO4具有吸水性,可以干燥任何气体
D.浓H2SO4是一种难挥发性酸,而HCl、HI、H2S是挥发性酸,可以用浓H2SO4分别与NaCl、KI、FeS等反应制取HCl、HI、H2S等气体
eq \a\vs4\al(状元随笔) 浓硫酸与锌反应,随着反应的进行,浓硫酸的浓度逐渐减小,稀硫酸的性质与浓硫酸的性质不同。
关键能力
浓硫酸强氧化性的表现
1.与金属的反应
(1)Fe、Al的钝化
常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
(2)与氢之前的活泼金属反应
Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O
规律:①浓硫酸既表现氧化性,又表现酸性;
②浓硫酸一旦变稀,就发生:Zn+H2SO4===ZnSO4+H2↑。
(3)与氢之后的不活泼金属(除Au、Pt外)反应
Cu+2H2SO4(浓) eq \(=====,\s\up7(△)) CuSO4+SO2↑+2H2O
规律:①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就会停止。
2.与非金属反应
C+2H2SO4(浓) eq \(=====,\s\up7(△)) CO2↑+2SO2↑+2H2O。
3.与还原性化合物的反应
常见的还原性物质FeSO4、Na2S、H2S、HBr、HI等均能被浓H2SO4氧化。
eq \a\vs4\al(状元随笔) 浓H2SO4与稀H2SO4氧化性的区别:
浓H2SO4具有强氧化性,原因是H2 eq \(S,\s\up6(+6)) O4―→ eq \(S,\s\up6(+4)) O2;
稀H2SO4具有弱氧化性,原因是 eq \(H,\s\up6(+1)) 2SO4―→H2。
学考评价——夯实·测控·演练
1.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室,按图所示密闭体系中气流的流向,则A处流出的气体为( )
A.SO2 B.SO3、O2
C.SO2、O2 D.SO2、SO3
2.浓硫酸和2 ml·L-1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如图。分析a、b曲线变化的原因是( )
A.a升华、b冷凝 B.a挥发、b吸水
C.a蒸发、b潮解 D.a冷凝、b吸水
3.(双选)下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有脱水性,能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取SO2时,浓硫酸表现出强氧化性
4.把1 g含脉石(SiO2)的黄铁矿样品在氧气流中灼烧,反应完全后得0.78 g残渣,则此黄铁矿的纯度是( )
A.33% B.66%
C.78% D.88%
5.下列叙述正确的是( )
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B.浓硫酸与单质碳反应的化学方程式为C+2H2SO4(浓) eq \(=====,\s\up7(△)) CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C.把足量铜粉投入到含2 ml H2SO4的浓硫酸中,加热得到气体体积标准状况下为22.4 L
D.将浓硫酸与浓硝酸混合时,应将浓硫酸缓缓注入盛浓硝酸的容器中
6.某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如图所示装置。实验中他们取6.4 g铜片与12 mL 18 ml/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余。
(1)为防止空气污染,请补画如图虚框中的实验装置,并注明所需要的试剂名称。
(2)写出铜跟浓硫酸反应的化学方程式: 。
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:________________________________________________________________________
________________________________________________________________________。
(4)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的 (填写字母序号)。
A.铁粉 B.BaCl2溶液 C.银粉
练后感悟
浓、稀硫酸的鉴别方法
第2课时 硫酸的制备与性质
学业基础
新知预习
CuSO4·5H2O FeSO4·7H2O 沸腾炉 4FeS2+11O2 eq \(=====,\s\up7(高温)) 2Fe2O3+8SO2 接触室 2SO2+O2 eq \(,\s\up7(催化剂),\s\d5(△)) 2SO3 吸收塔 SO3+H2O===H2SO4 无色 eq \(□,\s\up1(10)) 黏稠、油状液体 eq \(□,\s\up1(11)) 较高 eq \(□,\s\up1(12)) 难挥发 eq \(□,\s\up1(13)) 易溶 eq \(□,\s\up1(14)) 2H++Zn===Zn2++H2↑ eq \(□,\s\up1(15)) 红 eq \(□,\s\up1(16)) 2H++CuO===Cu2++H2O eq \(□,\s\up1(17)) H++OH-===H2O eq \(□,\s\up1(18)) SO eq \\al(\s\up1(2-),\s\d1(4)) +Ba2+===BaSO4↓ eq \(□,\s\up1(19)) 吸水 eq \(□,\s\up1(20)) 黑 eq \(□,\s\up1(21)) 膨胀 eq \(□,\s\up1(22)) 褪色 eq \(□,\s\up1(23)) 脱水 eq \(□,\s\up1(24)) 氧化 eq \(□,\s\up1(25)) 还原 eq \(□,\s\up1(26)) 溶解 eq \(□,\s\up1(27)) 气泡 eq \(□,\s\up1(28)) 变蓝 eq \(□,\s\up1(29)) 褪色 eq \(□,\s\up1(30)) 强氧化 eq \(□,\s\up1(31)) 干燥剂 eq \(□,\s\up1(32)) 有机物 eq \(□,\s\up1(33)) 2∶1 eq \(□,\s\up1(34)) 钝化 eq \(□,\s\up1(35)) Cu+2H2SO4(浓) eq \(=====,\s\up7(△)) CuSO4+SO2↑+2H2O eq \(□,\s\up1(36)) C+2H2SO4(浓) eq \(=====,\s\up7(△)) CO2↑+2SO2↑+2H2O
即时自测
1.答案:(1)× (2)× (3)√ (4)× (5)×
2.解析:首先明确该装置(设备)在吸收SO3过程中是采用逆流原理进行吸收的,即98.3%的硫酸是从吸收塔顶喷下,而SO3是从吸收塔底部通入的。这样有利于气、液的充分接触,吸收效果好。从吸收塔上部导出的气体是N2、没有起反应的O2和少量SO2,直接排入大气会污染环境,所以应用吸收剂吸收或循环使用。
答案:C
3.答案:(1)沸腾炉 (2)①增大矿石跟空气的接触面积,使之燃烧充分 ②提高原料的利用率 (3)4FeS2+11O2 eq \(=====,\s\up7(高温)) 2Fe2O3+8SO2
4.解析:浓硫酸使蓝色硫酸铜晶体变白,是因为浓硫酸的吸水性而不是脱水性。
答案:(1)①C ②C ③AB ④BE ⑤BD
(2)SO2和H2 浓硫酸与锌反应放出SO2气体,随着反应的进行,浓硫酸变为稀硫酸,锌与稀硫酸反应放出H2
核心素养
例1 【解析】 (1)该装置中a可干燥SO2、O2并使两者充分混合,控制气体流速;b为SO2与O2的反应装置;c可验证反应后混合气体中含有SO3,所以c中试剂是0.5 ml·L-1 BaCl2溶液;d的作用是吸收SO3和酸雾;e的作用是通过酸性高锰酸钾溶液吸收SO2而褪色(或变浅),检验和除去混合气体中的SO2;f中收集的气体是氧气。(2)用饱和NaHSO3溶液代替98.3%的浓硫酸,不可行,其理由是SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验。
【答案】 (1)0.5 ml·L-1 BaCl2溶液 检验和除去SO2 O2
(2)SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验
提升1 解析:乙装置相当于接触室,将SO2催化氧化为SO3,由于该反应是一个可逆反应,故从乙装置中出来的气体中含有SO2、O2、SO3;丙装置相当于吸收塔,用浓硫酸吸收SO3;丁装置是用水吸收SO3,SO3溶于水会放出大量的热,使水汽化为水蒸气,从而形成酸雾;本实验中缺少尾气吸收装置。(6)FeS2的实际用量为100 t×95%×(1-5%)×92%×(1-0.6%)=82.5 t。设可制得98%的浓硫酸的质量为x,由关系式:FeS2~2H2SO4,则 eq \f(120,82.5 t) = eq \f(2×98,98%x) ,解得x=137.5 t。
答案:(1)4FeS2+11O2 eq \(=====,\s\up7(高温)) 2Fe2O3+8SO2
(2)接触室 吸收塔
(3)SO2、O2、SO3
(4)吸收SO3 有酸雾产生
(5)缺少尾气吸收装置
(6)137.5
例2 【解析】 (1)甲、丙、戊分别利用浓硫酸的脱水性、溶解时放出大量的热、吸水性设计,方案可行。(2)乙中常温下铝遇浓硫酸使铝钝化,加热即可反应。而常温下铝片可与稀硫酸反应产生H2。(3)丁错误,挥发性酸遇浓氨水才能产生白烟,浓硫酸不属于挥发性酸。
【答案】 (1)甲、丙、戊 (2)乙 加热 (3)丁 硫酸是高沸点酸,不挥发
提升2 解析:Cu+2H2SO4(浓) eq \(=====,\s\up7(△)) CuSO4+SO2↑+2H2O,每2 ml H2SO4参与反应时,其中1 ml H2SO4作氧化剂,被还原成SO2,而另1 ml H2SO4起酸的作用,生成CuSO4,A正确;浓硫酸具有强氧化性,浓硫酸与足量的锌反应生成二氧化硫,随着反应的进行,浓硫酸变稀,稀硫酸与锌反应生成氢气,B不正确;浓硫酸不能干燥碱性气体和还原性气体,C不正确;浓硫酸具有强氧化性,所以强还原性气体既不能用浓硫酸制备,也不能用浓硫酸干燥,D不正确。
答案:A
学考评价
1.解析:进入热交换器预热的是SO2和O2的混合物,据此可排除A、B、D。在预热过程中,混合气体虽具备了合成SO3的温度,但无催化剂,因此A处流出的气体中应无SO3。
答案:C
2.解析:本题考查学生对浓、稀硫酸在吸水与其中水分挥发的差异。浓H2SO4敞口放置时,易吸收空气中的H2O而增重,稀H2SO4敞口放置水分挥发,质量减小。两种溶液都存在吸水与水分的挥发两个过程,只不过浓H2SO4以吸收水分为主,溶液质量增加;而2 ml·L-1的稀H2SO4以水分挥发为主,质量减小。
答案:B
3.解析:A项常温下浓硫酸能使铁、铝钝化,故可用铁质、铝质容器盛放浓H2SO4。B项浓硫酸使蔗糖炭化,体现了浓硫酸的脱水性。C项铜与浓硫酸在加热条件下发生反应,部分H2SO4被还原生成SO2,起氧化剂的作用,还有一部分H2SO4生成CuSO4,起酸的作用。D项实验室中用浓硫酸与固体亚硫酸钠反应来制取二氧化硫,在两种反应物中硫元素处于相邻价态,根据氧化还原反应规律知,它们之间是不可能发生氧化还原反应的,应为复分解反应,其原理是用难挥发性酸制易挥发性酸,强酸制弱酸。因而在此反应中浓硫酸表现的是难挥发性和酸性。
答案:BC
4.解析:本题采用差量法计算。设1 g样品中含FeS2的质量为x。
eq \f(480,x) = eq \f(160,0.22 g) ,x=0.66 g。黄铁矿的纯度为 eq \f(0.66 g,1 g) ×100%=66%。
答案:B
5.解析:A项浓硫酸具有吸水性,但由于其具有强氧化性和酸性,故不能用来干燥具有还原性的气体和碱性气体(NH3);B项金属与浓硫酸反应时,生成相应的盐、SO2和H2O,此时浓硫酸显酸性和强氧化性,而与S、C等非金属单质作用时,由于没有盐生成,故只显强氧化性;C项Cu与浓硫酸反应时,浓硫酸浓度逐渐降低,当反应到一定程度变为稀硫酸时,反应自行停止,故产生的SO2不足22.4 L;浓硫酸遇水放出大量热,所以浓硫酸与水及含水的液体混合时,应将浓硫酸缓缓注入水或含水液体中,D正确。
答案:D
6.答案:(1)
(2)Cu+2H2SO4(浓) eq \(=====,\s\up7(△)) CuSO4+SO2↑+2H2O
(3)反应过程中H2SO4被不断消耗,且生成的水逐渐增多使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应
(4)A
三原料
三设备
三阶段
三反应
硫黄或含硫矿石、空气、98.3%的浓硫酸
3
SO2的制取和净化
4____________
5
SO2氧化成SO3
6____________
7
SO3的吸收
8____________
颜色
状态
沸点
挥发性
水溶性
9
eq \(□,\s\up1(10))
eq \(□,\s\up1(11))
eq \(□,\s\up1(12))
eq \(□,\s\up1(13))
实验操作
实验现象
实验结论
蓝色晶体变成白色粉末
浓H2SO4具有 eq \(□,\s\up1(19)) 性
①蔗糖逐渐变 eq \(□,\s\up1(20)) ,体积 eq \(□,\s\up1(21)) ,形成疏松多孔的海绵状的炭
②品红溶液 eq \(□,\s\up1(22))
浓硫酸具有 eq \(□,\s\up1(23)) 性,且能 eq \(□,\s\up1(24)) 碳单质,本身被 eq \(□,\s\up1(25))
①铜片逐渐 eq \(□,\s\up1(26))
②铜片表面有 eq \(□,\s\up1(27)) 产生③试管中溶液逐渐 eq \(□,\s\up1(28))
④品红溶液 eq \(□,\s\up1(29))
浓硫酸具有 eq \(□,\s\up1(30)) 性
操作
结论
甲
投入火柴梗
变黑者为浓硫酸
乙
加入金属铝片
产生刺激性气味气体者为浓硫酸
丙
分别加入到盛水的试管中
放出大量热者为浓硫酸
丁
用玻璃棒蘸浓氨水靠近盛酸的试剂瓶瓶口
冒白烟者为浓硫酸
戊
加到CuSO4·5H2O晶体中
变白者为浓硫酸
现象
浓H2SO4
稀H2SO4
物理性质
加入水中
放出大量热
无明显现象
观察状态
黏稠状液体
黏稠度较小的液体
密度
浓H2SO4密度较大,相同体积时,浓H2SO4质量大
化学性质
铁片
因铁被钝化而无明显现象
产生大量气泡
铜片(加热)
有气泡产生,溶液变蓝
无明显现象
白纸
立即变黑
无明显现象
胆矾
蓝色变为白色
无颜色变化
苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第2课时学案设计: 这是一份苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第2课时学案设计,共9页。学案主要包含了硫酸的工业制备,浓硫酸的性质等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第二课时学案: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第二课时学案,共12页。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第2课时导学案: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第2课时导学案,共12页。学案主要包含了硫酸的工业制备,浓硫酸的性质 硫酸盐等内容,欢迎下载使用。













