
人教版 (2019)选择性必修2第一节 共价键第1课时导学案
展开
这是一份人教版 (2019)选择性必修2第一节 共价键第1课时导学案,共5页。
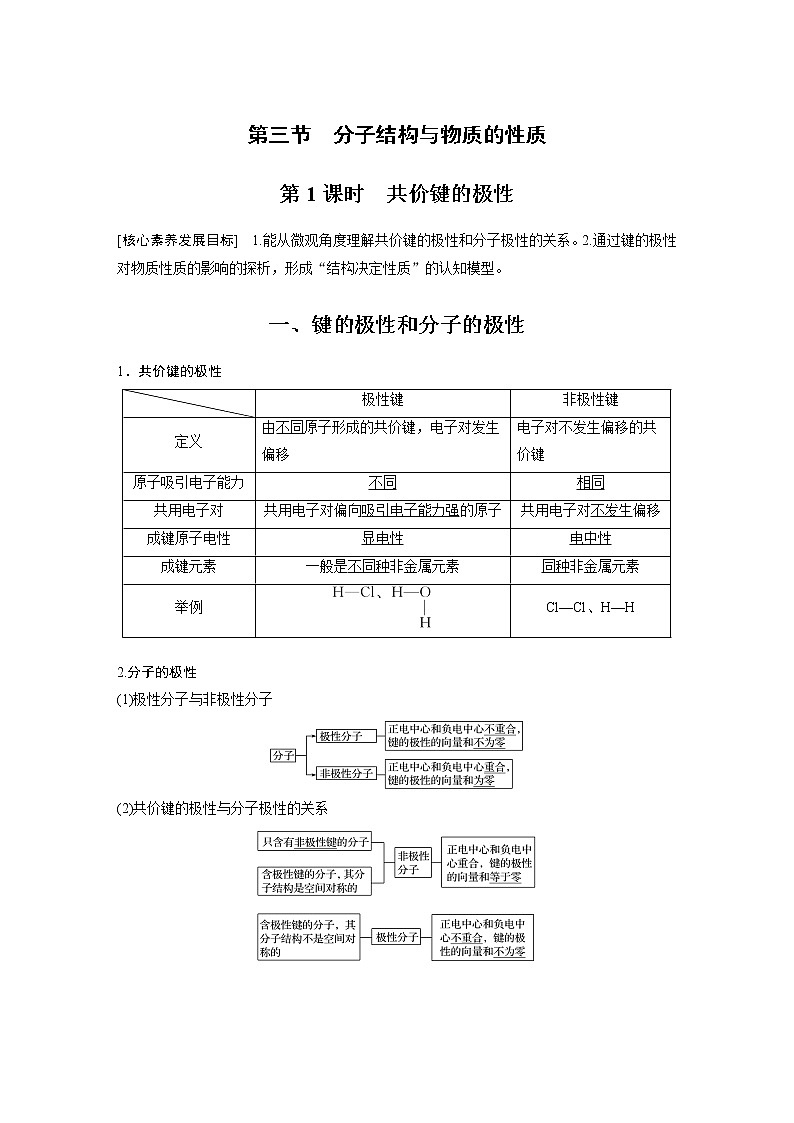
第三节 分子结构与物质的性质第1课时 共价键的极性[核心素养发展目标] 1.能从微观角度理解共价键的极性和分子极性的关系。2.通过键的极性对物质性质的影响的探析,形成“结构决定性质”的认知模型。一、键的极性和分子的极性1.共价键的极性 极性键非极性键定义由不同原子形成的共价键,电子对发生偏移电子对不发生偏移的共价键原子吸引电子能力不同相同共用电子对共用电子对偏向吸引电子能力强的原子共用电子对不发生偏移成键原子电性显电性电中性成键元素一般是不同种非金属元素同种非金属元素举例Cl—Cl、H—H 2.分子的极性(1)极性分子与非极性分子(2)共价键的极性与分子极性的关系 1.回答下列问题①H2 ②O2 ③HCl ④P4 ⑤C60 ⑥CO2 ⑦CH2==CH2 ⑧HCN ⑨H2O ⑩NH3 ⑪BF3 ⑫CH4 ⑬SO3 ⑭CH3Cl ⑮Ar ⑯H2O2(1)只含非极性键的是________;只含极性键的是______,既含极性键又含非极性键的是________。(2)属于非极性分子的是__________,属于极性分子的是________。答案 (1)①②④⑤ ③⑥⑧⑨⑩⑪⑫⑬⑭ ⑦⑯ (2)①②④⑤⑥⑦⑪⑫⑬⑮ ③⑧⑨⑩⑭⑯2.(2019·河北唐山一中高二月考)有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法中,正确的是( )A.假设为平面四边形,则该分子一定为非极性分子B.假设为四面体形,则该分子一定为非极性分子C.假设为平面四边形,则该分子可能为非极性分子D.假设为四面体形,则该分子可能为非极性分子答案 C解析 3.简要回答表面活性剂的去污原理。答案 表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。 1.键的极性判断(1)从组成元素判断①同种元素:A—A型为非极性共价键;②不同种元素:A—B型为极性共价键。(2)从电子对偏移判断①有电子对偏移为极性共价键;②无电子对偏移为非极性共价键。(3)从电负性判断①电负性相同为非极性共价键;②电负性不同为极性共价键。2.键的极性和分子极性的关系(1)极性分子中一定含有极性键,可能含有非极性键(如H2O2)。(2)非极性分子中有的只含非极性键(如O2),有的只含极性键(如BF3等),有的既含极性键又含非极性键(如CH2==CH2等)。特别提醒:①稀有气体分子是非极性分子,不含共价键;②臭氧是极性分子。二、键的极性对化学性质的影响键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。羧酸的酸性大小与其分子的组成和结构有关,如下表所示:不同羧酸的pKa羧酸pKa丙酸(C2H5COOH)4.88乙酸(CH3COOH)4.76甲酸(HCOOH)3.75氯乙酸(CH2ClCOOH)2.86二氯乙酸(CHCl2COOH)1.29三氯乙酸(CCl3COOH)0.65三氟乙酸(CF3COOH)0.23 1.三氟乙酸的酸性大于三氯乙酸酸性的原因。提示 由于氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。2.三氯乙酸的酸性大于二氯乙酸酸性的原因。提示 由于Cl3C—比Cl2CH—多一个氯原子,使Cl3C—的极性大于Cl2CH—的极性,导致三氯乙酸的羧基中的羟基的极性更大,更易电离出氢离子。3.甲酸的酸性大于乙酸酸性的原因。提示 烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。4.试比较下列有机酸的酸性强弱。①CF3COOH ②CCl3COOH ③CHCl2COOH ④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH答案 ①>②>③>④>⑤>⑥1.下列叙述正确的是( )A.构成单质分子的微粒一定含有共价键B.由非金属元素组成的化合物不一定是共价化合物C.非极性键只存在于双原子单质分子里D.不同元素组成的多原子分子里的化学键一定都是极性键答案 B解析 A项,稀有气体单质分子均为单原子分子,没有共价键;B项,NH4Cl为离子化合物;C、D两项,如Na2O2、H2O2等分子中含有非极性键。2.下列叙述中正确的是( )A.卤化氢分子中,卤素的非金属性越强,共价键的极性越大,热稳定性也越强B.以极性键结合的分子,一定是极性分子C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极性键D.非极性分子中,各原子间都应以非极性键结合答案 A解析 卤素中非金属性越强,键的极性越大,A项正确;以极性键结合的双原子分子一定是极性分子,但以极性键结合形成的多原子分子,也可能是非极性分子,如CO2,B项错误;A2B型如H2O、H2S等,AB2型如CO2、CS2等,判断其是否是极性分子的依据是看分子中是否含有极性键及分子的空间结构是否对称。如CO2、CS2为直线形,分子的空间结构对称,为非极性分子;如H2O,有极性键,分子的空间结构不对称,为极性分子,C项错误;多原子分子,其分子的空间结构对称,这样的非极性分子中可能含有极性键,D项错误。3.下列中心原子采取sp2杂化且为非极性分子的是( )A.CS2 B.H2S C.SO2 D.SO3答案 D4.下列叙述正确的是( )A.NO、N2O、NO2、NH3都是非极性分子B.CO2、SO3、BCl3、NF5都是非极性分子C.H2O、NH3是极性分子,分子中的H—O比N—H的极性弱D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子答案 B解析 根据ABn型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,若不相等则为极性分子,可判断:A项中中心原子N原子价电子数为5,四种化合物中没有一种氮元素的化合价为+5,故A项错误;B项中心原子C、S、B、N的化合价等于其价电子数,CO2、SO3、BCl3、NF5均为非极性分子,故B项正确;O的电负性比N的电负性强,对成键电子对的吸引力也强,形成O—H比N—H的极性强,C项错误;NCl3分子中N原子化合价与其价电子数不等,故D项错误。5.①PH3分子的空间结构为三角锥形,②BeCl2分子的空间结构为直线形,③CH4分子的空间结构为正四面体形,④CO2为直线形分子,⑤BF3分子的空间结构为平面三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是( )A.①⑥为极性分子,②③④⑤为非极性分子B.只有④为非极性分子,其余为极性分子C.只有②⑤是极性分子,其余为非极性分子D.只有①③是非极性分子,其余是极性分子答案 A解析 非极性键只能由相同种类的原子之间形成,极性分子只能由不同种类的原子之间形成。但在形成分子的时候,主要取决于分子的结构,当分子中的电子云能均匀分布的时候,分子则无极性,否则分子有极性。④CO2分子为直线形,极性抵消,为非极性分子;③CH4为正四面体,故极性也可抵消,为非极性分子;②BeCl2分子为直线形分子,故极性可抵消,为非极性分子;⑤BF3分子为平面三角形,极性抵消,故为非极性分子;⑥NF3中由于N原子的孤电子对对F原子的排斥作用,使电子不能均匀分布,故为极性分子;①PH3中P原子的孤电子对对H原子的排斥作用,使电子不能均匀分布,故为极性分子。6.在HF、H2O、NH3、CS2、CH4、N2分子中:(1)以非极性键结合的非极性分子是________。(2)以极性键相结合,具有直线形结构的非极性分子是________。(3)以极性键相结合,具有三角锥形结构的极性分子是________。(4)以极性键相结合,具有正四面体结构的非极性分子是________。(5)以极性键相结合,具有V形结构的极性分子是____。(6)以极性键相结合,而且分子极性最大的是________。答案 (1)N2 (2)CS2 (3)NH3 (4)CH4 (5)H2O (6)HF解析 不同元素间形成的共价键均为极性键,以极性键形成的分子,正负电荷中心重合的为非极性分子,不重合的为极性分子。
相关学案
这是一份高中化学人教版 (2019)选择性必修2第一节 共价键第1课时导学案,共5页。
这是一份高中化学人教版 (2019)选择性必修2第一节 共价键第1课时导学案及答案,共10页。
这是一份高中化学鲁科版 (2019)选择性必修2第1节 共价键模型第1课时学案