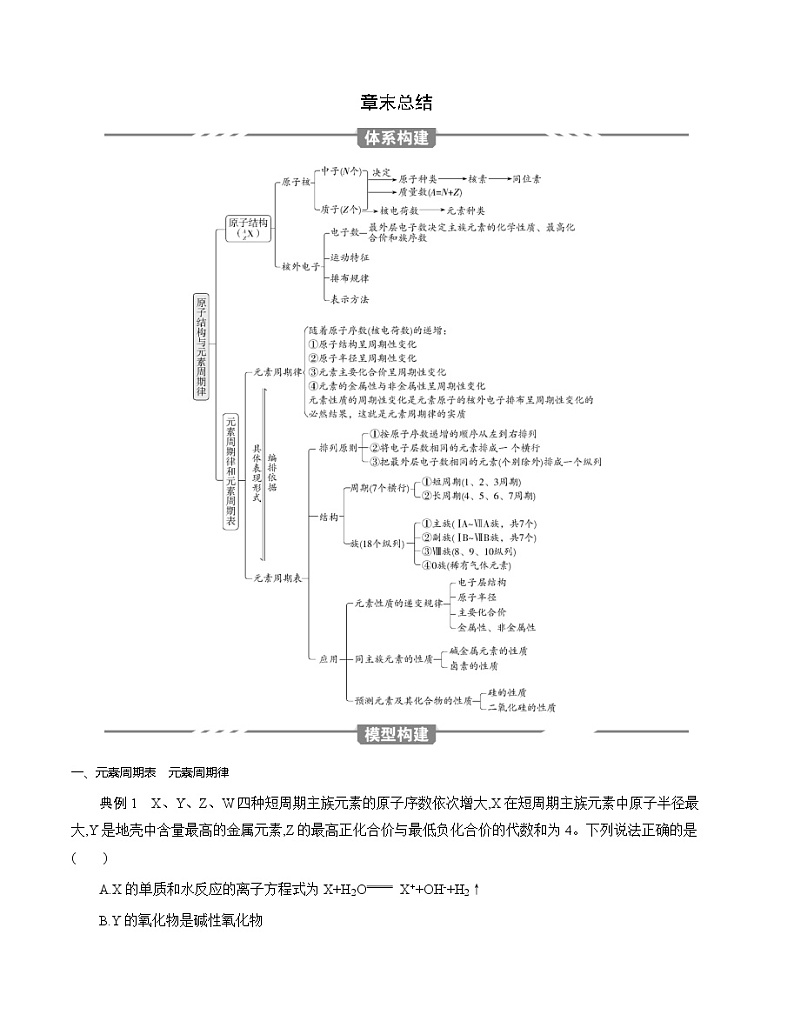

2021-2022学年高中化学新鲁科版必修第二册 第1章原子结构 元素周期律学案
展开
这是一份2021-2022学年高中化学新鲁科版必修第二册 第1章原子结构 元素周期律学案,共4页。
章末总结一、元素周期表 元素周期律典例1 X、Y、Z、W四种短周期主族元素的原子序数依次增大,X在短周期主族元素中原子半径最大,Y是地壳中含量最高的金属元素,Z的最高正化合价与最低负化合价的代数和为4。下列说法正确的是( )A.X的单质和水反应的离子方程式为X+H2O X++OH-+H2↑B.Y的氧化物是碱性氧化物C.最高价氧化物对应水化物的碱性:X<YD.气态氢化物的稳定性:Z<W答案 D X、Y、Z、W分别为Na、Al、S、Cl。A项,离子方程式未配平;B项,Al2O3是两性氧化物;C项,NaOH的碱性强于Al(OH)3的;D项,Cl的非金属性强于S的,故稳定性:H2S<HCl。变式训练1 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。下列说法不正确的是( )A.X的简单氢化物的热稳定性比W的强B.Y的简单离子与X的简单离子具有相同的电子层结构C.ZX2可使湿润的紫色石蕊试纸先变红后褪色D.Z与X属于同一主族,与Y属于同一周期答案 C 由题可知,W为氮,X为氧,Y为钠,Z为硫。同周期主族元素从左至右,简单氢化物的热稳定性逐渐增强,H2O的热稳定性比NH3的强,A项正确;氧离子(O2-)和钠离子(Na+)核外都有10个电子,B项正确;SO2能使湿润的紫色石蕊试纸变红,但不能使其褪色,C项错误;氧、硫位于同主族,钠、硫位于同周期,D项正确。变式训练2 有六种短周期元素A、B、C、D、E、F,原子序数依次增大。主族元素中,A的原子半径最小;B元素的原子最外层电子数是内层电子数的两倍;C为地壳中含量最多的元素;D是原子半径最大的短周期主族元素,D的单质燃烧时火焰呈现黄色,D的单质在加热条件下与C的单质充分反应,可以得到与E的单质颜色相同的固态化合物;D与F形成的化合物DF是常用的调味品。试根据以上叙述回答下列问题:(1)写出下列元素名称:A ,B ,C ,D 。 (2)E在元素周期表中的位置: 。 (3)F的简单离子结构示意图: 。 (4)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为 。 (5)能说明E原子的得电子能力比F原子 (填“强”或“弱”)的事实是 (举一例)。 答案 (1)氢 碳 氧 钠 (2)第3周期ⅥA族(3)(4)2Na2O2+2H2O 4NaOH+O2↑(5)弱 氯气能从硫化钠溶液中置换出S(答案合理即可)解析 据“主族元素中,A的原子半径最小”知A为氢元素;据“C为地壳中含量最多的元素”知C为氧元素;B原子结构为,所以B为碳元素;据“D是原子半径最大的短周期主族元素”知D为钠元素,Na在O2中燃烧生成的Na2O2为淡黄色固体,所以E为硫元素;据原子序数大于E和“D与F形成的化合物DF是常用的调味品”知F为氯元素。二、元素“位”“构”“性”三者的关系及应用典例2 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期数与族序数相等。下列判断不正确的是( )A.最简单气态氢化物的热稳定性:R>QB.最高价氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>RD.含T的盐中,T元素只能存在于阳离子中答案 D 根据“T所处的周期数与族序数相等”可推断T为铝元素,Q、R、W依次为硅、氮和硫元素。R和Q的最简单气态氢化物的热稳定性:NH3>SiH4;最高价氧化物对应水化物的酸性:H2SiO3<H2SO4;原子半径:Al>Si>N;含Al的盐中,Al元素还可以存在于阴离子[Al(OH)4]-中,因此D项错误。变式训练3 短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较中正确的是( )A.元素非金属性:Z>Y>XB.最高价氧化物对应水化物的酸性:Z>YC.原子半径:Z<Y<XD.简单氢化物的稳定性:Z<Y<X答案 D X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素;X、Y位于同一主族,故Y为硫元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为磷元素。同周期主族元素自左向右非金属性逐渐增强,同主族元素自上而下非金属性逐渐减弱,所以非金属性:P<S<O,即Z<Y<X,故A错误;非金属性:P<S,元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,故B错误;同周期主族元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,所以原子半径:P>S>O,即Z>Y>X,故C错误;非金属性:P<S<O,元素的非金属性越强,对应简单氢化物越稳定,所以简单氢化物稳定性:Z<Y<X,故D正确。变式训练4 a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的氢化物分子由四个原子构成。试推断:(1)b元素在周期表中的位置: 。 (2)e的氧化物中,符合阴、阳离子个数比为1∶2的氧化物的化学式为 。 (3)b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 。 A.常温下,b的单质呈固态,d的单质呈气态B.d的简单氢化物的稳定性强于b的简单氢化物C.b与d形成的化合物中,b呈正价D.d的氢化物的沸点高于b的氢化物答案 (1)第2周期ⅣA族 (2)Na2O2、Na2O (3)O BC解析 根据“b原子最外层电子数是内层电子数的2倍”可推断b为碳元素,根据“c的氢化物分子由四个原子构成”可推断c为氮元素,则d为氧元素,e为钠元素,a为氢元素。






