
高中化学人教版 (2019)选择性必修2第一节 物质的聚集状态与晶体的常识第2课时练习题
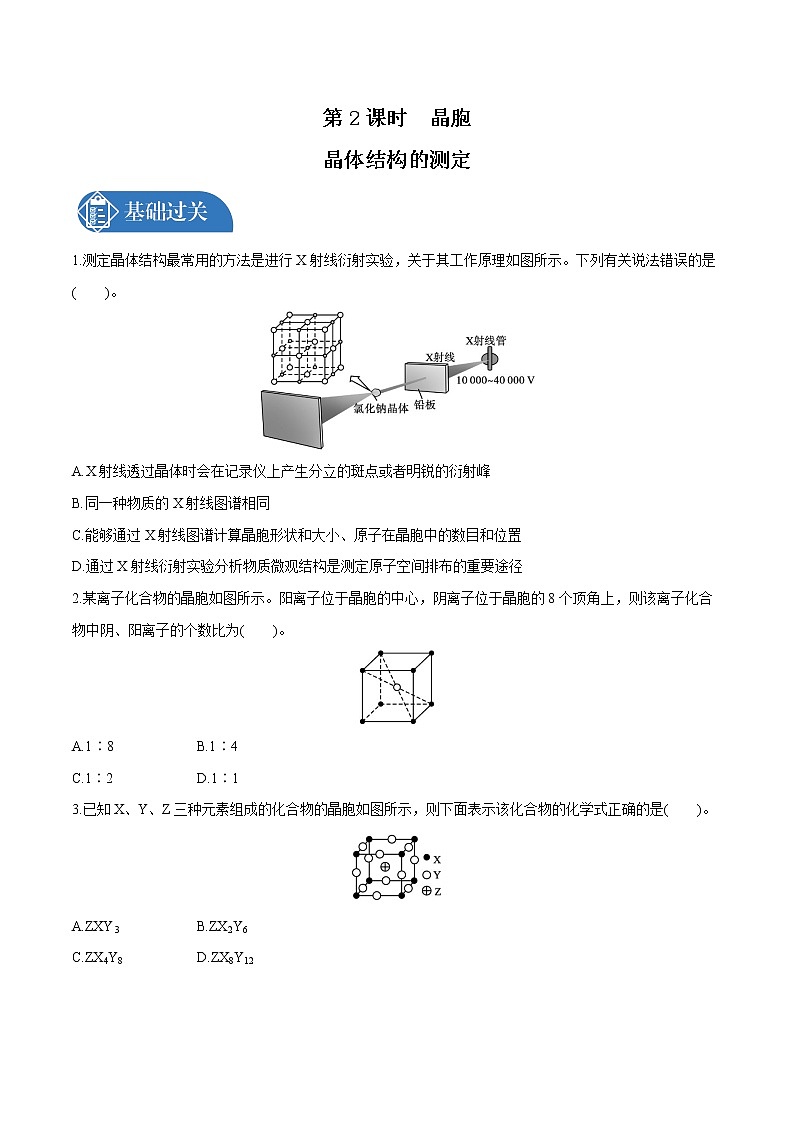
展开1.测定晶体结构最常用的方法是进行X射线衍射实验,关于其工作原理如图所示。下列有关说法错误的是( )。
A.X射线透过晶体时会在记录仪上产生分立的斑点或者明锐的衍射峰
B.同一种物质的X射线图谱相同
C.能够通过X射线图谱计算晶胞形状和大小、原子在晶胞中的数目和位置
D.通过X射线衍射实验分析物质微观结构是测定原子空间排布的重要途径
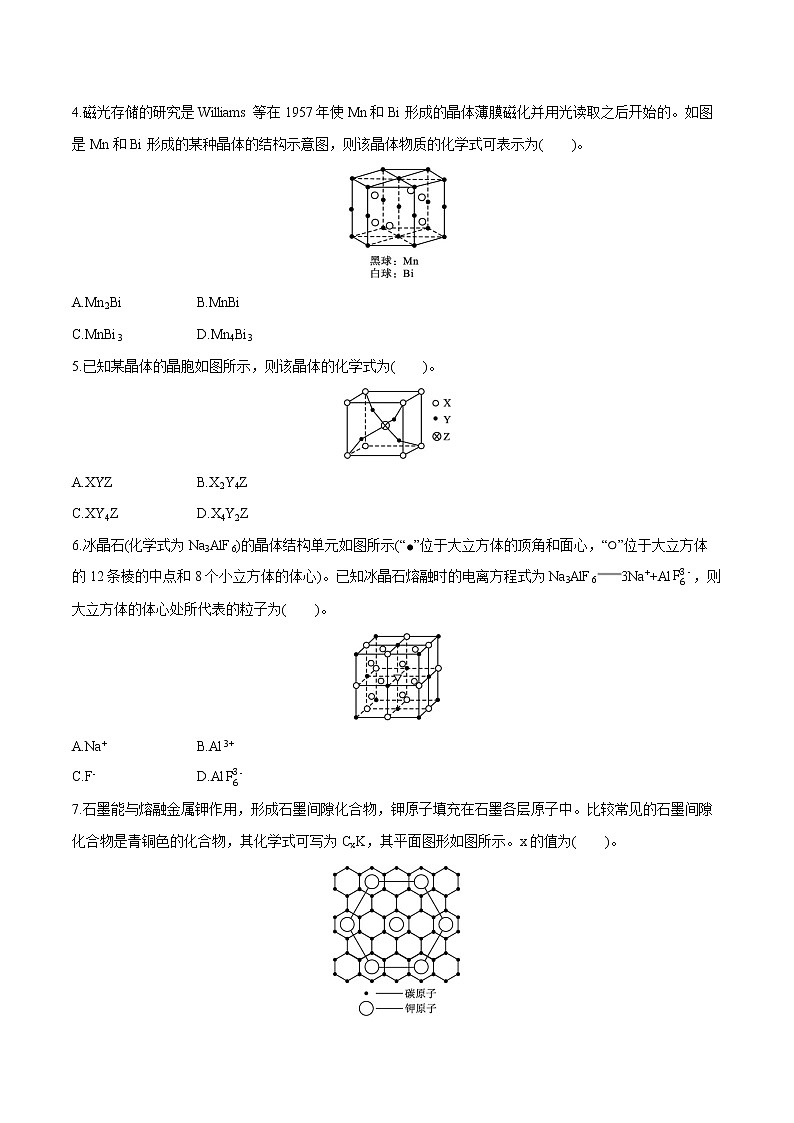
2.某离子化合物的晶胞如图所示。阳离子位于晶胞的中心,阴离子位于晶胞的8个顶角上,则该离子化合物中阴、阳离子的个数比为( )。
A.1∶8B.1∶4
C.1∶2D.1∶1
3.已知X、Y、Z三种元素组成的化合物的晶胞如图所示,则下面表示该化合物的化学式正确的是( )。
A.ZXY3B.ZX2Y6
C.ZX4Y8D.ZX8Y12
4.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。如图是Mn和Bi形成的某种晶体的结构示意图,则该晶体物质的化学式可表示为( )。
A.Mn2BiB.MnBi
C.MnBi3D.Mn4Bi3
5.已知某晶体的晶胞如图所示,则该晶体的化学式为( )。
A.XYZB.X2Y4Z
C.XY4ZD.X4Y2Z
6.冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(“”位于大立方体的顶角和面心,“”位于大立方体的12条棱的中点和8个小立方体的体心)。已知冰晶石熔融时的电离方程式为Na3AlF63Na++AlF63-,则大立方体的体心处所代表的粒子为( )。
A.Na+B.Al3+
C.F-D.AlF63-
7.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )。
A.8B.12C.24D.60
8.某物质的晶体内部一截面上原子的排布情况如图所示,则该晶体的化学式可表示为( )。
A.A2BB.AB
C.AB2D.A3B
9.如图为氯化钠的晶胞结构示意图(氯化钠晶体是由钠离子和氯离子交替排列而构成的)。已知氯化钠的M=58.5g·ml-1,氯化钠的密度是2.2g·cm-3,阿伏加德罗常数为6.02×1023ml-1,则氯化钠的晶胞体积约为( )。
×10-22cm3×10-21cm3
×10-24cm3×10-23cm3
10.右图所示为热敏电阻PTC元件的主要成分的晶体结构,该结构是具有代表性的最小重复单位。该晶体经X射线实验分析测定,重复单位为正方体,棱长为403.1pm,顶角位置为B原子所占,体心位置为C原子所占,所有棱的中点位置为A所占。据图回答下列问题。
(1)若将B置于晶胞的体心,C置于晶胞的顶点,则A处于立方体的什么位置?
(2)在该物质的晶体中,每个B周围与它距离相等且最近的B有 个,它们在空间呈 形状分布。
11.某晶体的晶胞结构如图所示,X位于立方体顶角,Y位于立方体中心。请回答下列问题。
(1)晶体中每一个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体的化学式是 。
(2)晶体中在每个X周围与它距离相等且最接近的X共有 个。
(3)晶体中距离最近的2个X分别与1个Y形成的两条线的夹角为 。
12.据报道,首例带结晶水的晶体在5K下呈现超导性,该晶体的化学式为Na0.35CO2·1.3H2O。该晶体具有CO2的层状结构(如图所示)。下列用粗线画出的层状结构重复结构单元示意图(小球表示C原子,大球表示O原子),其中不能描述其化学组成的是( )。
13.纳米材料的表面粒子数占总粒子数的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面粒子数与总粒子数之比为( )。
A.7∶8B.13∶14
C.1∶1D.26∶27
14.如图是氯化铯晶体的晶胞结构示意图。已知晶体中2个最近的铯离子的核间距离为acm,氯化铯的摩尔质量为Wg·ml-1,则氯化铯晶体的密度为( )。(设NA为阿伏加德罗常数的值)
A.2WNAa3g·cm-3B.W2NAa3g·cm-3
C.WNAa3g·cm-3D.Wa3NAg·cm-3
15.氯化钠晶体是由钠离子(图中的“”)和氯离子(图中的“”)构成的,且均为等距离的交错排列。已知氯化钠的密度是2.2g·cm-3,阿伏加德罗常数为6.02×1023ml-1。在氯化钠晶体中两个距离最近的钠离子的核间距离最接近于( )。
NaCl晶体结构模型
A.3.0×10-8cmB.3.5×10-8cm
C.4.0×10-8cmD.5.0×10-8cm
16.(1)元素铜的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 。
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,该功能陶瓷的化学式为 。
(3)某晶体的晶胞结构如图所示。该晶体的化学式是 ,在晶体中1个Ti原子、1个C原子周围距离最近的O原子数目分别为 、 。
17.通过X射线衍射实验对Cu的测定结果如下:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g·cm-3,Cu的原子半径为 cm(阿伏加德罗常数的值为NA,只要求列式表示)。
1.【答案】B
【解析】同一种物质的晶体状态和非晶体状态的X射线图谱不同。
2.【答案】D
【解析】阴离子位于晶胞的8个顶角,晶胞中阴离子的个数为8×18=1,阳离子位于晶胞的中心,晶胞中阳离子的个数为1。
3.【答案】A
【解析】由晶胞可知X占据8个顶角,属于该晶胞的X的数目为8×18=1;Y占据12条棱的中间,属于该晶胞的Y的数目为12×14=3;Z占据该晶胞的体心,属于该晶胞的Z的数目为1。故该化合物的化学式为ZXY3。
4.【答案】B
【解析】该晶胞中含有Mn的个数为12×16+6×13+2×12+1=6,含有Bi的个数为6,则该晶体物质的化学式为MnBi。
5.【答案】C
【解析】X原子位于晶胞顶角,该晶胞含有的X原子数目为8×18=1;Y原子位于该晶胞内,共有4个,因此该晶胞中含有的Y原子数目为4;Z只有1个,位于晶胞的体心上,故该晶体的化学式为XY4Z。
6.【答案】A
【解析】该晶胞中“”个数=8×18+6×12=4,“”个数=12×14+8=11,根据冰晶石的化学式可知,冰晶石中Na+和AlF63-的个数之比为3∶1,据此可判断出大立方体的体心“”所代表的粒子与“”代表的粒子相同,为Na+。
7.【答案】A
【解析】可选取题图中6个钾原子围成的正六边形为结构单元,每个钾原子被3个正六边形共用,则该结构单元中实际含有的钾原子数为6×13+1=3,该六边形内实际含有的碳原子数为24,故钾原子数与碳原子数之比为1∶8。
8.【答案】B
【解析】由该晶体一截面上原子的排布情况可知,每一个A原子周围有4个B原子,每一个B原子周围有4个A原子。故该晶体的化学式可表示为AB。
9.【答案】A
【解析】该晶胞中钠离子个数为1+12×14=4,氯离子个数为8×18+6×12=4,晶胞密度ρ=MNA×4V,则V=4MρNA=4×58.52.2×6.02×1023cm3=1.77×10-22cm3。
10.【答案】(1)面心
(2)6 正八面体
【解析】(1)由原图可以看出它的化学式为BCA3。当B位于晶胞的体心,C位于晶胞的顶角时,要求化学式不变,则A的位置有两种可能,即在面心或棱的中点。由题中晶胞结构图可以看出,在每个B的周围和它等距离且最近的A有6个(距离为棱长的一半);如果在棱的中点,则和它等距离且最近的A有12个(距离为面对角线的一半),故只有A处于立方体的面心时才与题中晶胞结构图相符。(2)由题中晶胞结构图可以看出,在每个B的周围和它等距离且最近的B有6个,这6个B在空间构成了正八面体。
11.【答案】(1)4 8 XY2(或Y2X)
(2)12
(3)109°28'
【解析】(1)同时吸引的粒子个数即指在某粒子周围距离最近的其他种类的粒子个数,观察晶胞结构图可知,Y位于立方体的体心,X位于立方体的顶角,每个Y同时吸引着4个X,而每个X同时被8个立方体共用,每个立方体的体心都有1个Y,所以每个X同时吸引着8个Y,所以该晶体的化学式为XY2或Y2X。(2)晶体中每个X周围与它最接近的X之间的距离应为如图所示立方体的面对角线。故晶体中在每个X周围与它距离相等且最接近的X共有12个。(3)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知晶体中距离最近的2个X分别与1个Y形成的两条线的夹角为109°28'。
12【答案】D
【解析】CO2的重复结构单元示意图中C、O原子数目之比应为1∶2,结合均摊法计算判断。A项,粗线画出的重复结构单元中含有C原子的个数为1,含有O原子的个数为4×12=2,C原子与O原子的个数比是1∶2,正确;B项,粗线画出的重复结构单元中含有C原子数为1+4×14=2,含有O原子数为4,C原子与O原子数之比为1∶2,正确;C项,粗线画出的重复结构单元中含有C原子数为4×14=1,含有O原子数为4×12=2,C原子与O原子数之比为1∶2,正确;D项,粗线画出的重复结构单元中含有C原子数为1,含有O原子数为4×14=1,所以C原子与O原子数之比为1∶1,错误。
13.【答案】D
【解析】由题意知一个氯化钠晶胞即为一个氯化钠纳米颗粒,则其表面粒子数=8+6+12=26,总粒子数=表面粒子数+中心粒子数=26+1=27。
14.【答案】C
【解析】晶体中2个最近的铯离子的核间距离为acm,相邻顶点上铯离子的核间距离最近,为acm,即晶胞的棱长为acm,则晶胞的体积V=a3cm3,该晶胞中含有Cs+的个数=8×18=1,Cl-个数为1,晶胞密度ρ=WNA×1a3g·cm-3=WNAa3g·cm-3。
15.【答案】C
【解析】从NaCl晶体结构模型中分割出一个小立方体,如图所示,a表示其棱长,d表示两个Na+的核间距离。每个小立方体含Na+个数为18×4=12,含Cl-个数为18×4=12,即每个小立方体含Na+—Cl-离子对为12个。则a3cm3×2.2g·cm-3=12×58.5g·ml-16.02×1023ml-1,解得a≈2.81×10-8cm,又因为d=2a,故NaCl晶体中两个距离最近的Na+的核间距离为d=2×2.81×10-8cm≈4.0×10-8cm。
16.【答案】(1)CuCl
(2)2 BN
(3)CTiO3 6 12
【解析】(1)晶胞中灰球代表的粒子有4个,白球代表的粒子有6×12+8×18=4个,所以该氯化物的化学式为CuCl。
(2)每个氮化硼晶胞中含有白球表示的原子个数为8×18+1=2,灰球表示的原子个数为1+4×14=2,所以每个晶胞中含有N原子和B原子各2个;N的电负性大于B,所以该陶瓷的化学式为BN。
(3)每个晶胞中含有O的数目为6×12=3,含C的数目为8×18=1,含Ti的数目为1,故该晶体的化学式为CTiO3。Ti原子位于晶胞的中心,其周围距离最近的O原子位于6个面的中心,所以周围距离最近的O原子数目为6;C原子位于晶胞的顶角,O原子位于晶胞的面心,所以C原子周围距离最近的O原子数目为12。
17.【答案】24×34×649.00×NA
【解析】根据晶胞的结构图可知,晶胞中含有铜原子个数为8×18+6×12=4,设晶胞的棱长为acm,则a3cm3×ρg·cm-3×NAml-1=4×64g·ml-1,所以a=34×64ρ·NA,晶胞的面对角线为2acm,面对角线的14为Cu原子半径,所以Cu原子半径为24×34×649.00×NAcm。
高中化学人教版 (2019)选择性必修2第一节 物质的聚集状态与晶体的常识第2课时课后练习题: 这是一份高中化学人教版 (2019)选择性必修2第一节 物质的聚集状态与晶体的常识第2课时课后练习题,共7页。试卷主要包含了某离子化合物的晶胞如图所示,冰晶石的晶体结构单元如图所示,如图为氯化钠的晶胞结构示意图等内容,欢迎下载使用。
人教版 (2019)第一节 物质的聚集状态与晶体的常识第2课时练习: 这是一份人教版 (2019)第一节 物质的聚集状态与晶体的常识第2课时练习,共7页。试卷主要包含了基础巩固,能力提升等内容,欢迎下载使用。
化学选择性必修2第一节 物质的聚集状态与晶体的常识第2课时课后作业题: 这是一份化学选择性必修2第一节 物质的聚集状态与晶体的常识第2课时课后作业题,共4页。试卷主要包含了下列有关晶胞的叙述,正确的是,对于某晶胞,某离子化合物的晶胞如图所示等内容,欢迎下载使用。













