

人教版 (2019)选择性必修2第三节 金属晶体与离子晶体第3课时导学案
展开
这是一份人教版 (2019)选择性必修2第三节 金属晶体与离子晶体第3课时导学案,共14页。
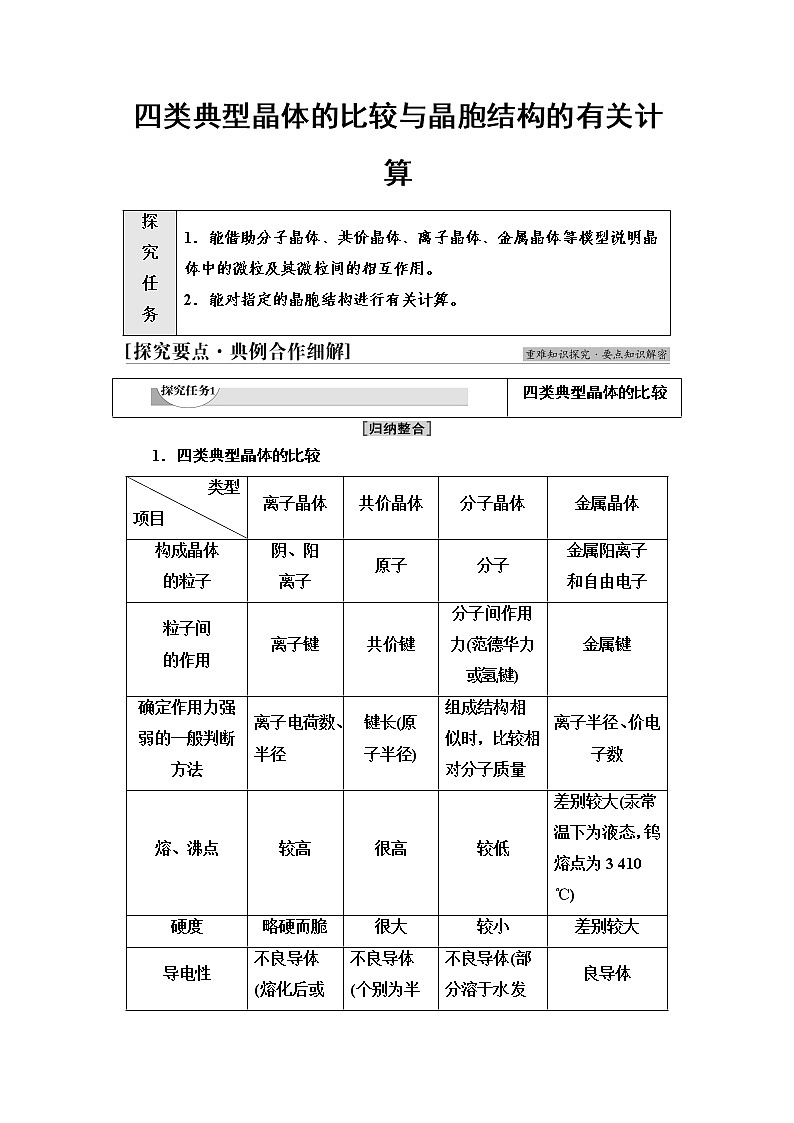
四类典型晶体的比较与晶胞结构的有关计算
探 究 任 务
1.能借助分子晶体、共价晶体、离子晶体、金属晶体等模型说明晶体中的微粒及其微粒间的相互作用。
2.能对指定的晶胞结构进行有关计算。
四类典型晶体的比较
1.四类典型晶体的比较
类型
项目
离子晶体
共价晶体
分子晶体
金属晶体
构成晶体
的粒子
阴、阳
离子
原子
分子
金属阳离子
和自由电子
粒子间
的作用
离子键
共价键
分子间作用力(范德华力或氢键)
金属键
确定作用力强弱的一般判断方法
离子电荷数、半径
键长(原
子半径)
组成结构相似时,比较相对分子质量
离子半径、价电子数
熔、沸点
较高
很高
较低
差别较大(汞常温下为液态,钨熔点为3 410 ℃)
硬度
略硬而脆
很大
较小
差别较大
导电性
不良导体(熔化后或溶于水导电)
不良导体(个别为半导体)
不良导体(部分溶于水发生电离后导电)
良导体
溶解性
多数易溶
一般不溶
相似相溶
一般不溶于水,少数与水反应
机械
加工性
不良
不良
不良
优良
延展性
差
差
差
优良
(1)离子晶体中一定存在离子键,可能存在共价键,一定不存在分子间作用力。
(2)只有分子晶体中存在单个分子。
(3)某些离子晶体的熔点高于某些共价晶体的熔点。
如MgO(2 852 ℃)>SiO2(1 710 ℃)。
(4)某些分子晶体的熔点高于某些金属晶体的熔点。
如碱金属熔点较低。
(5)个别金属的熔点高于某些共价晶体的熔点。
如钨(3 410 ℃)>SiO2(1 710 ℃)。
(6)合金的熔点一般低于各成分金属的熔点。
2.晶体熔、沸点高低的比较方法
(1)不同类型晶体熔、沸点的比较
①不同类型晶体的熔、沸点高低一般规律:共价晶体>离子晶体>分子晶体。
②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)同种类型晶体熔、沸点的比较
①共价晶体
原子半径越小→键长越短→键能越大→熔、沸点越高。如熔点:金刚石>硅晶体。
②离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高。如熔点:MgO>NaCl>CsCl。
③分子晶体
a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高。如沸点:H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。如熔、沸点:SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。如熔、沸点:Na<Mg<Al。
【例1】 (2021·湖北武汉部分重点中学高二期末)下列为几种晶体或晶胞的示意图:
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成晶体的是__________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_______________________________________________________________。
(3)每个Cu晶胞中实际占有__________个Cu原子;CaCl2晶体中Ca2+的配位数为__________。
(4)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是____________________________________。
[解析] (1)共价晶体中原子间以共价键结合,则粒子之间以共价键结合形成晶体的是金刚石晶体。
(2)熔点高低的一般规律:共价晶体>离子晶体>分子晶体,冰和干冰属于分子晶体,熔点:冰>干冰;MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2;金刚石是共价晶体,熔点最高,则熔点由高到低的顺序为金刚石>MgO>CaCl2>冰>干冰。
(3)Cu原子占据晶胞的面心和顶角,则每个Cu晶胞中实际占有的Cu原子数为×8+×6=4;根据氯化钙的晶胞图可知,每个Ca2+周围距离最近且相等的Cl-有8个,所以CaCl2晶体中Ca2+的配位数为8。
(4)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还因为水分子间存在氢键。
[答案] (1)金刚石晶体
(2)金刚石>MgO>CaCl2>冰>干冰
(3)4 8
(4)H2O分子之间能形成氢键
1.下列说法中正确的是( )
A.固态时能导电的物质一定是金属晶体
B.熔融状态能导电的晶体一定是离子晶体
C.水溶液能导电的晶体一定是离子晶体
D.固态不导电而熔融状态导电的晶体一定是离子晶体
D [四种晶体在不同状态下的导电性区别如下:
分子晶体
共价晶体
金属晶体
离子晶体
]
固态
不导电
不导电
(晶体硅导电)
导电
不导电
熔融状态
不导电
不导电
导电
可导电
水溶液
有的可导电
-
-
可导电
2.Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物
NaF
MgF2
SiF4
熔点/K
1 266
1 534
183
(1)解释表中氟化物熔点差异的原因:
a.________________________________________________。
b.________________________________________________。
(2)硅在一定条件下可以与Cl2反应生成SiCl4,试判断SiCl4的沸点比CCl4的________(填“高”或“低”),理由__________________________________
__________________________________________________________________。
[解析] (1)先比较不同类型晶体的熔点。NaF、MgF2为离子晶体,阴、阳离子以离子键结合,离子键作用力强,SiF4固态时为分子晶体,分子间以范德华力结合,范德华力较弱,故NaF和MgF2的熔点都高于SiF4的熔点。b.再比较相同类型晶体的熔点。Na+的半径比Mg2+半径大,Na+所带电荷数小于Mg2+,所以MgF2的离子键比NaF的离子键强度大,MgF2熔点高于NaF熔点。
(2)SiCl4和CCl4组成、结构相似,SiCl4的相对分子质量大于CCl4的相对分子质量,SiCl4的分子间作用力大于CCl4的分子间作用力,故SiCl4的熔点高于CCl4的熔点。
[答案] (1)a.NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2的熔点远比SiF4的熔点要高 b.因为Mg2+的半径小于Na+的半径且Mg2+所带电荷数较大,所以MgF2的离子键强度大于NaF的离子键强度,故MgF2的熔点高于NaF (2)高 SiCl4和CCl4组成、结构相似,SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高
晶胞结构的有关计算
晶体结构的考查主要依据晶胞的计算模式——均摊法来确定晶胞中原子、离子或者分子等粒子的数目,进而依据数学中的几何知识来解决关于晶体结构以及与晶体结构相关的知识,如晶胞体积、晶体密度以及晶体结构中微粒数目等等。
1.用均摊法确定晶胞中微粒数目,进而确定物质的化学式
均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有属于这个晶胞。
(1)长方体(正方体)晶胞中不同位置的粒子数的计算。
①处于顶角的粒子,同时为8个晶胞所共有,每个粒子有属于该晶胞;
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有属于该晶胞;
③处于面上的粒子,同时为2个晶胞所共有,每个粒子有属于该晶胞;
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非长方体(正方体)晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶角(1个碳原子)被3个六边形所共有,每个六边形占有1个碳原子的。
2.晶体密度
晶体的密度可由公式ρ=求解,其中m指一个晶胞中微粒的质量,V指晶胞的体积。
3.空间利用率
×100%
例如(1)简单立方(见图1):a=2r(a为晶胞边长,r为微粒半径)
空间利用率=×100%=52%
图1 图2
(2)体心立方(见图2):
a2+2a2=(4r)2 a=
空间利用率×100%=68%
【例2】 (1)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
①在该晶胞中,Cu+的配位数是__________。
②若该晶胞的边长为a pm,则Cu2O的密度为________________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
(2)砷化镓为第三代半导体材料,晶胞结构如图所示,砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g·mol-1,阿伏加德罗常数的值为NA,则砷化镓晶体的密度表达式是__________g·cm-3。
(3)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中A处Li的原子坐标参数为;B处As的原子坐标参数为;C处Li的原子坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数a=594 pm,NA表示阿伏加德罗常数的值,则其密度为__________ g·cm-3(列出计算式即可)。
(4)元素铜的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
甲 乙 丙
若已知铜元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数的值,则该晶体的密度为______________g·cm-3(用含M、d、NA的代数式表示)。
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。
①储氢原理:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱心和面心,则形成的储氢化合物的化学式为__________。
②测知镧镍合金晶胞体积为9.0×10-23 cm3,则镧镍合金的晶体密度为___________________________________ (列出计算式即可)。
[解析] (1)①根据氧化亚铜的化学式和晶胞结构分析,在该晶胞中,每个O2-和4个Cu+相连,每个Cu+和2个O2-相连,故Cu+的配位数是2。②根据氧化亚铜的晶胞结构可知,晶胞的质量为 g,若该晶胞的边长为a pm=a×10-10 cm,则晶胞的体积为a3×10-30 cm3,则Cu2O的密度为 g·cm-3。
(2)砷化镓晶体中最近的砷和镓原子的核间距为晶胞体对角线长的,则晶胞的棱长为 cm,每个晶胞中含有4个砷原子和4个镓原子,所以密度表达式为ρ== g·cm-3= g·cm-3。
(3)①根据晶胞结构可知,C处Li的原子坐标参数为。
②该晶胞中Li、As、Zn原子的个数都为4,根据化学式可知该晶体的密度ρ== g·cm-3。
(4)由题图可知铜晶胞中含有的铜原子数目为8×+6×=4。若已知铜元素的原子半径为d cm,则由图丙知,其晶胞的面对角线长是4d cm,所以晶胞的边长是2d cm,则该晶体的密度ρ== g·cm-3= g·cm-3。
(5)①根据均摊法,储氢后晶胞中La的个数为8×=1,Ni的个数为8×+1=5,H的个数为8×+2×=3,因此该储氢化合物的化学式为LaNi5H3。②根据密度的定义,晶胞的质量为 g,体积为9.0×10-23 cm3,密度为 g·cm-3。
[答案] (1)①2 ② (2)
(3)① ②
(4)
(5)①LaNi5H3 ② g·cm-3
3.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种三维骨架结构,下列对该晶体叙述错误的是( )
A.该晶体类型是共价晶体
B.晶体的空间最小环共由6个原子构成
C.晶体中碳原子数与C—O化学键数目之比为1∶4
D.该晶体中碳原子和氧原子的个数之比为1∶2
B [根据题干,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种三维骨架结构,不存在单个分子,属于共价晶体,A正确;该晶体的空间最小环由6个碳原子和6个氧原子构成,因此晶体的空间最小环共由12个原子构成,B错误;该晶体中,每个碳原子形成4个C—O共价键且没有共用,所以C原子数与C—O化学键数目之比为1∶4,C正确;晶体中每个碳原子均以四个共价单键与氧原子结合,每个氧原子和2个碳原子以共价单键相结合,所以碳、氧原子个数之比为1∶2,D正确。]
4.(1)如图1所示为二维平面晶体结构示意图,化学式为AX3的晶体是__________(填序号)。
图1 图2
(2)图2为金属铜的晶胞,请完成下列各题。
①该晶胞“实际”拥有的铜原子数是__________。
②设该晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g·cm-3,NA为阿伏加德罗常数的值,则NA=__________(用a、ρ表示)。
[解析] (1)①中6个X原子构成一个正六边形,每个X原子被3个这样的正六边形共有,正六边形的中心有1个A原子,所以每个正六边形中X原子的实际个数是6×=2,则表示的化学式是AX2;②中6个X原子构成一个正六边形,每个X原子被2个这样的正六边形共有,正六边形的中心有1个A原子,所以每个正六边形中X原子的实际个数是6×=3,则表示的化学式是AX3。(2)①用“均摊法”求解,该晶胞“实际”拥有的铜原子数为8×+6×=4;②·64=ρ·a3,NA=。
[答案] (1)② (2)①4 ②
对于晶体结构的计算,要善于用宏观的立体几何结构分析晶胞的微观结构。分清各原子、离子、分子在空间的相对位置,利用立体几何的知识,把抽象的化学概念转变成具体的数学问题。
1.下列物质所属晶体类型分类正确的是( )
A
B
C
D
共价晶体
石墨
生石灰
碳化硅
金刚石
分子晶体
冰
固态氨
氯化铯
干冰
离子晶体
氮化铝
食盐
明矾
芒硝
金属晶体
铜
汞
铝
铁
D [石墨为混合型晶体,生石灰、氯化铯为离子晶体,氮化铝为共价晶体。]
2.下表给出几种化合物的熔点和沸点:
物质
NaCl
MgCl2
AlCl3
CCl4
熔点/℃
801
714
190
-22.9
沸点/℃
1 465
1 412
178
76.8
关于表中4种化合物有下列说法,其中正确的是( )
①AlCl3在加热时可升华 ②CCl4属于分子晶体 ③1 500 ℃时NaCl可形成气体分子 ④AlCl3是典型的离子晶体
A.①②④ B.③④ C.①②③ D.①②③④
C [根据各物质的熔、沸点判断,AlCl3和CCl4为分子晶体;AlCl3的沸点低于熔点,所以可升华;NaCl为离子晶体,但1 500 ℃高于其沸点,故1 500 ℃时以分子形式存在。]
3.(2021·山东潍坊高二期中)高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法中正确的是( )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O
B.晶体中每个K+周围有8个O,每个O周围有8个K+
C.晶体中与每个K+距离最近且相等的K+有8个
D.晶体中,0价氧与-2价氧的数目之比为2∶1
A [该晶胞中钾离子个数为8×+6×=4,超氧根离子个数为1+12×=4,所以钾离子和超氧根离子个数之比为4∶4=1∶1,超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O,A正确;根据题图可知,晶体中每个K+周围有6个O,每个O周围有6个K+,B错误;晶体中与每个K+距离最近且相等的K+个数为3×8×=12,C错误;晶胞中K+与O个数分别为4、4,所以1个晶胞中有8个氧原子,根据电荷守恒可得,-2价氧原子数目为2,所以0价氧原子数目为8-2=6,所以晶体中,0价氧原子与-2价氧原子的数目之比为3∶1,D错误。]
4.金属钠晶体的晶胞为体心立方堆积,实验测得钠的密度为ρ g·cm-3。已知钠的相对原子质量为a,设阿伏加德罗常数的值为NA,假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切。则钠原子的半径r为( )
A. cm B. cm
C. cm D. cm
C [因为金属钠晶体的晶胞为体心立方堆积,所以每个晶胞中含有钠原子数为1+8×=2,设晶胞边长为x cm,根据ρ=得,ρ=,所以x=,晶胞的体对角线长为棱长的倍,则体对角线长为 cm,所以钠原子半径r= cm。]
5.(2021·福建泉港一中高二月考)如图甲、乙、丙分别为CaF2、H3BO3(层状结构,层内的H3BO3分子间通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
甲 CaF2晶胞 乙 H3BO3层状结构
丙 铜晶体中铜原子堆积模型
(1)图甲所示的CaF2晶体中与Ca2+最近且等距离的F-数为__________,图丙中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________。
(2)三种晶体中熔点最低的是__________,该晶体受热熔化时,克服的微粒之间的相互作用为__________。
(3)结合CaF2晶体的晶胞示意图,已知两个距离最近的Ca2+核间距为a×10-8 cm,计算CaF2晶体的密度为__________g·cm-3(精确到小数点后一位,NA用具体数值代入计算)。
[解析] (1)由图甲可知F-的配位数为4,Ca2+与F-的数目之比为1∶2,则离Ca2+最近且等距离的F-数目为4×2=8;图丙中未标号的铜原子与所在密置层的4、5、6、7、8、9号铜原子紧密相邻,与上一密置层的1、2、3号铜原子和下一密置层的10、11、12号铜原子紧密相邻,故未标号的铜原子形成晶体后周围最紧邻的铜原子数为12。
(2)CaF2属于离子晶体,Cu属于金属晶体,H3BO3属于分子晶体,三种晶体中熔点最低的是H3BO3,H3BO3分子之间存在氢键、范德华力,H3BO3晶体受热熔化时,需要克服氢键、范德华力。
(3)由图甲可知,两个距离最近的Ca2+核间距为面对角线长的一半,则晶胞棱长为×a×10-8 cm,一个晶胞中实际拥有Ca2+的数目为8×+6×=4,F-数目为8,则CaF2晶体的密度为≈ g·cm-3。
[答案] (1)8 12
(2)H3BO3 范德华力和氢键
(3)
相关学案
这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体第2课时导学案,共12页。学案主要包含了离子晶体,过渡晶体与混合型晶体等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体第2课时学案,共17页。学案主要包含了离子晶体,过渡晶体与混合型晶体等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体第2课时学案设计,共12页。学案主要包含了离子晶体,过渡晶体与混合型晶体等内容,欢迎下载使用。









