

高中化学第一节 物质的聚集状态与晶体的常识第2课时学案
展开第2课时 晶胞 晶体结构的测定
必备知识·自主学习
一、晶胞
1.概念:描述晶体结构的基本单元。
2.结构:
晶胞一般都是平行六面体,晶体是由无数晶胞无隙并置而成。
(1)无隙:相邻晶胞之间无任何间隙。
(2)并置:所有晶胞都是平行排列的,取向相同。
(3)所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
3.晶胞中粒子数目的计算
平行六面体(立方体形)晶胞中粒子数目的计算。
(1)晶胞的顶角原子是8个晶胞共用;
(2)晶胞棱上的原子是4个晶胞共用;
(3)晶胞面上的原子是2个晶胞共用。
(1)由晶胞构成的晶体,其化学式是否表示一个分子中原子的数目?
提示:由晶胞构成的晶体,其化学式不表示一个分子中原子的数目,只表示每个晶胞中各类原子的最简整数比。
(2)如图为离子晶体空间构型示意图:(阳离子,阴离子)以M代表阳离子,以N表示阴离子,写出各离子晶体的组成表达式:
A__MN__、B__MN3__、C__MN2__。
提示:在A中,含M、N的个数相等,故组成为MN;在B中,含M:×4+1=(个),含N:×4+2+4×=(个),M∶N=∶=1∶3;在C中含M:×4=(个),含N为1个,M∶N=1∶2。
二、晶体结构的测定
1.测定晶体结构最常用的仪器是X射线衍射仪。在X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
2.由衍射图形获得晶体结构的信息包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等。
关键能力·合作学习
知识点一 “均摊法”突破晶胞组成的计算
均摊法:若某个粒子为n个晶胞所共有,则该粒子1/n属于该晶胞。
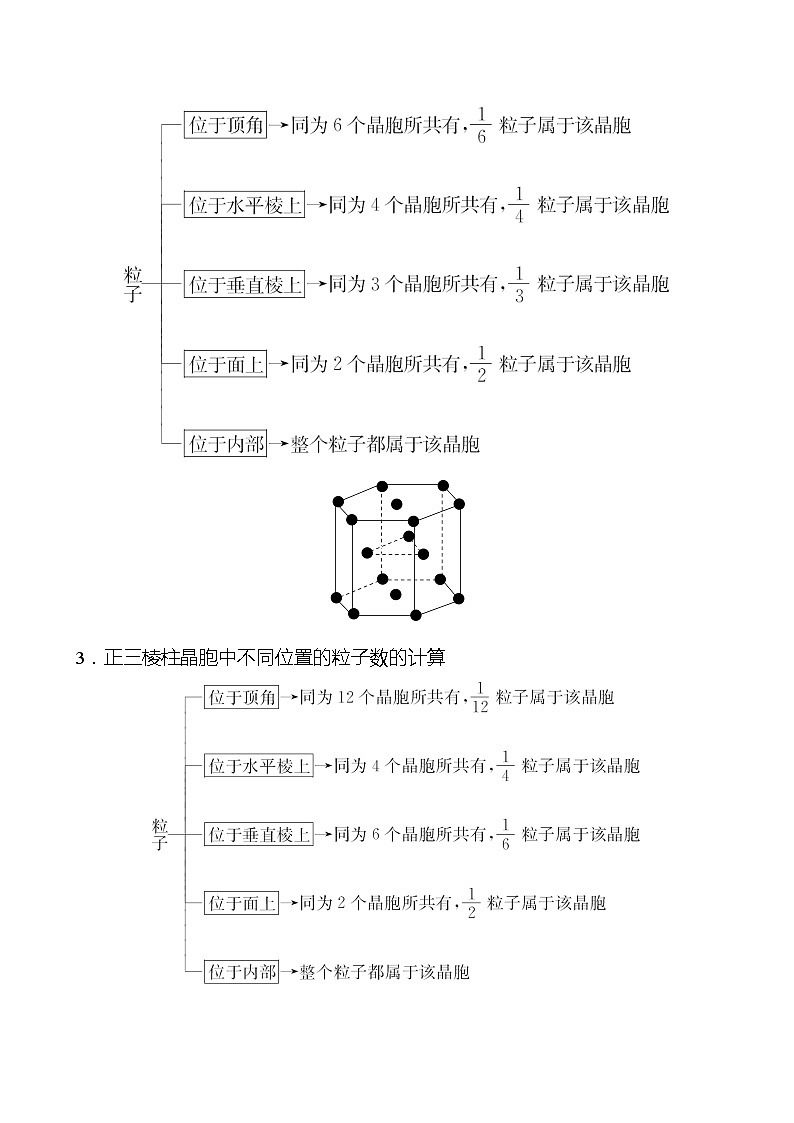
1.长方体(正方体)晶胞中不同位置的粒子数的计算:
2.正六棱柱晶胞中不同位置的粒子数的计算
3.正三棱柱晶胞中不同位置的粒子数的计算
(1)晶胞中粒子个数的计算,要正确分析晶胞中任意位置上的一个粒子被几个晶胞所共用。
(2)根据均摊法计算出1个晶胞中,各种原子个数的最简整数比可确定该物质的化学式。
(3)对于独立原子构成的分子,其分子式的确定则不能用均摊法。如由金属原子M和非金属原子N构成的气态团簇分子,如图所示,顶角和面上的原子是M原子,棱中心和体心的原子是N原子,由于M、N原子并不存在共用关系,所以由气态团簇分子结构图可知,其分子式可由示意图查原子个数来确定,M原子共14个,N原子13个,即分子式为M14N13。
(1)(思维升华)晶胞都是晶体中最小的平行六面体吗?
提示:不是。常规的晶胞是平行六面体,而有的晶胞为六棱柱或三棱柱。
(2)任何晶胞中,位于顶点上的粒子,一定被8个晶胞共有吗?
提示:不一定。长方体(包括立方体)晶胞中位于顶点上的粒子同为8个晶胞共有,而正六棱柱晶胞中,顶点上的粒子被6个晶胞共有。
【典例】某晶体结构模型如图所示,则该晶体的化学式是_________________;在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为________个、________个。
【解析】晶胞中含有O:6×=3个,含Co:8×=1个,含Ti:1个,故化学式为CoTiO3。Ti原子位于晶胞的中心,其周围距离最近的O原子位于6个面的中心,所以周围距离最近的O原子数目为6个;Co原子位于晶胞的顶点,O原子位于晶胞的面心,所以Co原子周围距离最近的O原子数目为12个。
答案:CoTiO3 6 12
【补偿训练】
(1)中一个A周围距离最近且相等的B有多少个?
提示:6个。
(2)中一个B周围距离最近且相等的A有多少个?
提示:8个。
解答晶体结构计算,关键是对晶体进行晶胞组成和空间关系两种分析。计算方法为:以一个晶胞为研究对象,根据m=ρ·V,其一般的计算规律和公式可表示为×n=ρ×a3,其中M为晶体的摩尔质量,n为晶胞所占有的粒子数,NA为阿伏加德罗常数,ρ为晶体密度,a为晶胞参数。
1.(2021·连云港高二检测)现有四种晶体,其构成粒子(均为单原子核粒子)排列方式如图所示,其化学式正确的是( )
【解析】选C。B处于顶点位置,晶胞中B原子数目=8×=1,A处于体心,晶胞中A原子数目=1,故化学式为AB,A错误;E、F均处于顶点位置,晶胞中E、F原子数目=4×=,故化学式为EF,B错误;Z处于顶点,Z原子数目=8×=1,Y处于面心,Y原子数目=6×=3,X处于体心,晶胞中X原子数目=1,故化学式为XY3Z,C正确;A处于顶点、面心,晶胞中A原子数目=8×+6×=4,B处于体心、棱中心,晶胞中B原子数目=1+12×=4,故化学式为AB,D错误。
2.20世纪60年代,材料王国里出现了能储存氢的金属和合金,统称为储氢合金,这些金属或合金具有很强的捕捉氢的能力,在一定的温度和压力条件下,氢分子在合金(或金属)中先分解成单个的原子,而这些氢原子便“见缝插针”般地进入合金原子之间的缝隙中,并与合金进行化学反应生成金属氢化物,外在表现为大量“吸收”氢气,同时放出大量热。如图是一种镍基合金储氢后的晶胞结构图:
(1)该合金的化学式为________。
(2)该合金储氢后,含1 mol La的合金可吸附H2的数目为____________。
【解析】(1)该晶胞中La位于顶点,个数为8×=1,Ni位于面心和体心,个数为8×+1=5。
(2)该晶胞中La位于顶点,个数为8×=1,H2有8个位于棱上,2个位于面心,个数为8×+2×=3,故含1 mol La的合金可吸附H2的数目为3NA。
答案:(1)LaNi5 (2)3NA
【补偿训练】
1.(2021·咸阳高二检测)如图所示的晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
A.8;BaTi8O12 B.8;BaTi4O9
C.6;BaTiO3 D.3; BaTi2O3
【解析】选C。由结构可知,Ba位于体心为1个,Ti位于顶点,为8×=1个,O位于棱心,为12×=3个,其化学式为BaTiO3,晶体内“Ti”紧邻的氧原子在棱上,则晶体内与每个“Ti”紧邻的氧原子数为=6个,化学式为BaTiO3。
2.某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为( )
A.A2B B.AB C.AB2 D.A3B
【解析】选B。在A原子的周围有4个B原子,同样在B原子的周围有4个A原子,故A、B原子的个数比为1∶1。
知识点二 晶体密度的计算
1.计算晶胞棱长
晶胞模型 | 晶胞棱长(a)与粒子半径(r)关系 |
a=2r | |
a=4r | |
a=4r | |
a=2r | |
a=8r |
2.计算晶体密度
以一个晶胞为研究对象,根据晶胞质量m=ρ×V,由公式×n=ρ×a3进行计算,其中M为晶体的摩尔质量,n为晶胞所占有的粒子数,NA为阿伏加德罗常数,ρ为晶体密度,a为晶胞棱长。
(1)晶胞棱长计算的公式是什么?
提示:a=。
(2)根据晶胞参数和晶体密度,如何计算阿伏加德罗常数?
提示:NA=。
【典例】(2020·全国Ⅲ卷) 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是__________。根据对角线规则,B的一些化学性质与元素______________的相似。
(2)NH3BH3分子中,N—B化学键称为____________键,其电子对由__________
提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O===3NH+B3O+9H2,B3O的结构为。在该反应中,B原子的杂化轨道类型由__________变为__________。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是________________。与NH3BH3原子总数相等的等电子体是________________(写分子式),其熔点比NH3BH3________(填“高”或“低”),原因是在NH3BH3分子之间,存在______________,也称“双氢键”。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
氨硼烷晶体的密度ρ=__________g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
【思维建模】解答有关晶体密度计算问题的思维流程如下:
【解析】(1)H、B、N中,H的电子层数最少,原子半径最小(H是所有元素中原子半径最小的元素);而B、N同周期,电子层数相同,但是N的核电荷数大,所以原子半径小,所以三种元素中原子半径最大的是B。由于周期表中B的对角线元素为Si,所以根据对角线规则,B的一些化学性质与元素Si的相似。
(2)NH3BH3分子是由NH3与BH3结合而成的,其中NH3分子中N原子具有孤电子对,而BH3分子中B原子具有空轨道,所以二者通过N与B原子之间形成配位键而结合生成NH3BH3。NH3BH3中B原子的价层电子对数为4,发生sp3杂化,而中B的价层电子对数为3,发生sp2杂化。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),故电负性N>H,而与B原子相连的H呈负电性(Hδ-),故电负性H>B,所以电负性大小顺序是N>H>B;与NH3BH3原子总数相等的等电子体是CH3—CH3,由于NH3BH3分子中,存在Hδ+与Hδ-,二者之间存在静电作用力,而CH3—CH3只存在Hδ+,不存在Hδ-,所以熔点NH3BH3>CH3—CH3。
(4)由图可知晶胞体积为2a×2b×2c=8abc (pm3)=8abc×10-30(cm3);而每个晶胞中氨硼烷质量为 g,所以晶体的密度ρ= g·cm-3。
答案:(1)B 硅(或Si) (2)配位 N sp3 sp2
(3)N>H>B CH3—CH3 低 Hδ+与Hδ-的静电引力
(4)
有关立方晶胞的计算公式
(1)立方晶胞的棱长a与面对角线、体对角线的关系:
①面对角线长=a;②体对角线长=a。
(2)立方晶胞的密度ρ与棱长a、晶胞内微粒数n之间的关系:a3ρ=·M(M为晶体的摩尔质量)。
1.(2021·西安高二检测)已知在晶体中仍保持一定几何形状的最小单位称为晶胞。干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子。实验测得25 ℃时干冰晶体的晶胞棱长为a cm,其摩尔质量为M g·mol-1,则该干冰晶体的密度为(单位:g·cm-3)( )
A. B. C. D.
【解析】选D。每个顶点上的二氧化碳分子被8个晶胞共用,每个面心上的二氧化碳分子被两个晶胞共用,所以该晶胞中二氧化碳分子个数=8×+6×=4,ρ===g·cm-3,故D正确。
2.(2021·湖南选择考节选)硅、锗(Ge)及其化合物广泛应用于光电材料领域。下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
①已知化合物中Ge和O的原子个数比为1∶4,图中Z表示___________________
原子(填元素符号),该化合物的化学式为____________________;
②已知该晶胞的晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则该晶体的密度ρ=______________g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
【解析】①由晶胞结构可知,晶胞中位于顶点、面心、棱上和体内的X原子为8×+6×+4×+3=8,位于体内的Y原子和Z原子分别为4和16,由Ge和O原子的个数比为1∶4可知,X为Mg原子、Y为Ge原子、Z为O原子,则晶胞的化学式为Mg2GeO4; ②由晶胞的质量公式可得:=abc×10-21×ρ,解得ρ=×1021 g·cm-3。
答案:①O Mg2GeO4 ②×1021
【补偿训练】
(2021·郑州高二检测)已知元素A为O,元素B为Na,A与B能够形成化合物F,其晶胞结构如图所示,
晶胞棱长参数a cm,F的化学式为____________,晶胞中A原子的配位数为________________,列式计算晶体F的密度______________(g·cm-3)(仅需列出表达式)。
【解析】A和B能够形成化合物F为离子化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×+6×=4,N(Na)∶N(O)=2∶1,则形成的化合物为Na2O;由晶胞结构可知B(Na)原子配位数为4,结合化学式可知A(O)原子配位数为4×2=8;晶胞的质量为 g,晶胞的体积为a3 cm3,则晶体F的密度为(g·cm-3)。
答案:Na2O 8
三言两语话重点
1.晶胞是描述晶体结构的基本单元,晶体由无数晶胞无隙并置而成。
2.晶体中所有晶胞的形状及其内部的原子种类、个数以及几何排列是完全相同的。
3.晶胞中微粒数目采用“均摊法”确定。
4.通过X射线衍射实验可测定晶体的结构。
课堂检测·素养达标
1.(2021·淮安高二检测)下列有关晶胞的叙述错误的是( )
A.晶胞是描述晶体结构的基本单元
B.整块晶体中,相邻晶胞之间没有间隙
C.晶胞一般都是平行六面体
D.晶胞都是正八面体
【解析】选D。 晶胞是晶体微观空间里的一个基本重复单元,A正确;在晶体中,晶胞是最小的结构单元,在它的上、下、前、后、左、右无隙并置地排列着无数晶胞,“无隙”是指相邻晶胞之间没有任何间隙,B正确;晶体结构的基本单元叫晶胞,结构一般来说,晶胞为平行六面体,C正确;晶体结构一般来说,晶胞为平行六面体,不是正八面体,D错误。
2.区分晶体和非晶体最可靠的科学方法是( )
A.观察外观是否规则
B.测定是否有固定的熔点
C.进行X射线衍射实验
D.验证是否有各向异性
【解析】选C。晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X射线衍射可以看到微观结构,故选C。
3.(2021·揭阳高二检测)对于某晶胞(如图所示)的描述错误的是( )
A.该晶胞是所在晶体内最小的平行六面体
B.该晶胞的每个顶点上和每个面的面心上都各有一个原子
C.平均每个晶胞中有14个原子
D.平均每个晶胞中有4个原子
【解析】选C。 晶胞是最小的重复单元,为六方面心结构,A正确;该晶胞是六方面心结构,在晶胞的每个顶点上和每个面的面心上都各有一个原子,B正确;由于顶点为8个晶胞所共有,面为2个晶胞所共有,所以平均每个晶胞中含有的原子个数为8×+6×=4个,即平均每个晶胞中有4个原子,C错误;根据选项C分析可知每个晶胞中有4个原子,D正确。
【补偿训练】
(2021·北京海淀区高二检测)某离子化合物的晶胞如图所示。阳离子位于晶胞的中心,阴离子位于晶胞的8个顶点上,则该离子化合物中阴、阳离子的个数比为( )
A.1∶8 B.1∶4
C.1∶2 D.1∶1
【解析】选D。由图可知,阳离子位于晶胞的中心,属于该晶胞的数目为1;阴离子位于晶胞的8个顶点上,属于该晶胞的数目为8×=1。因此,阴离子与阳离子的个数比为1∶1。
4.(2021·衢州高二检测)金属钠晶体(如图)为体心立方晶胞,晶胞的棱长为a,假定金属钠原子为等径的刚性球,且晶胞中处于体对角线上的三个球相切,则钠原子的半径r为( )
A. B.a C.a D.2a
【解析】选B。 金属钠晶体为体心立方晶胞,晶胞的棱长为a,则晶胞的体对角线为a;假定金属钠原子为等径的刚性球,且晶胞中处于体对角线上的三个球相切,则晶胞的体对角线为钠原子半径的4倍,所以4r=a,则钠原子的半径r为a,故选B。
素养新思维
5.(2021·石家庄高二检测)如图为NaCl晶胞结构示意图(晶胞棱长为a nm)
(1)能准确证明其是晶体的方法是_______________________________________
__________________________________________________________________。
(2)晶体中,Cl-位于Na+所围成的正________面体的体心,该多面体的棱长是________nm。
(3)晶体中在每个Na+的周围与它最近且等距离的Na+共有________个。
(4)Na+半径与Cl-半径的比值是________(保留小数点后三位,=1.414)。
(5)在1 413 ℃时,NaCl晶体转变成氯化钠气体。现有5.85 g NaCl晶体,使其气化测得气体体积为1.12 L(已换算为标准状况),则此时氯化钠气体的分子式为________。
【解析】(1)能准确证明其是晶体的方法是X射线衍射法或X射线衍射实验;(2)晶体中,以Na+为中心,在它的上下前后左右有6个Cl-,Cl-位于Na+所围成的正八面体的体心,如图,该多面体的棱长=图中对角线长的一半=a nm;(3)晶体中,以Na+为中心的三个垂直的面上各有4个Na+,在每个Na+的周围与它最近且等距离的Na+共有12个;(4)根据图可知,NaCl晶体中阴、阳离子的最短距离为棱长的一半即 nm,氯离子的半径为面对角线离子的半径为面对角线(氯离子相切)的,即为a nm,由图可知,钠离子的半径为(-a) nm,所以Na+半径与Cl-半径的比为≈0.414。
(5)1 mol氯化钠晶体的质量=1 mol×58.5 g·mol-1=58.5 g标准状况下,气体体积为1.12 L的氯化钠的物质的量=1.12 L/(22.4 L·mol-1)=0.05 mol,M=
5.85 g/0.05 mol=117 g·mol-1,所以氯化钠气体的分子式为Na2Cl2或(NaCl)2。
答案:(1)X射线衍射法(或X射线衍射实验) (2)八 a (3)12
(4)0.414 (5)Na2Cl2或(NaCl) 2
人教版 (2019)选择性必修2第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识学案设计: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识学案设计,共13页。学案主要包含了物质的聚集状态,晶体与非晶体,晶胞,晶体结构的测定等内容,欢迎下载使用。
2020-2021学年第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识第1课时导学案及答案: 这是一份2020-2021学年第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识第1课时导学案及答案,共15页。学案主要包含了物质的聚集状态,晶体与非晶体等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 物质的聚集状态与晶体的常识第2课时学案设计: 这是一份高中化学人教版 (2019)选择性必修2第一节 物质的聚集状态与晶体的常识第2课时学案设计,共19页。学案主要包含了晶胞,晶体结构的测定等内容,欢迎下载使用。













