




考点18 根据化学方程式的计算-备战2022年中考化学一轮复习考点帮·学案
展开根据化学方程式的考查是中考的必考内容之一,题目将由物质的单一计算逐渐向混合物的计算、与溶液的计算、化学式的计算综合考查,有一定的难度,学习时提倡由浅入深,分类练习,逐步掌握这部分内容。主要的命题点有:
①已知一种反应物或生成物的质量,计算恰好完全反应时另一种反应物或生成物的质量;
②含杂质(杂质不参加反应)的反应物或生成物质量的计算。
考查重点
1. 根据质量守恒定律进行简单计算
2. 根据化学方程式进行简单计算
3. 含杂质(杂质不参加反应)的反应物或生成物质量的计算
重点考向
考向一、根据质量守恒定律进行简单计算
依据:
化学反应前后反应物和生成物的总质量不变
方法:
原子守恒和质量守恒综合运用,结合比例知识简单计算
跟踪训练
1.(2020甘肃天水)在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
下列说法正确的是( )
A.x等于90
B.b可能是单质
C.c一定是催化剂
D.参加反应的a与d的质量比为7:8
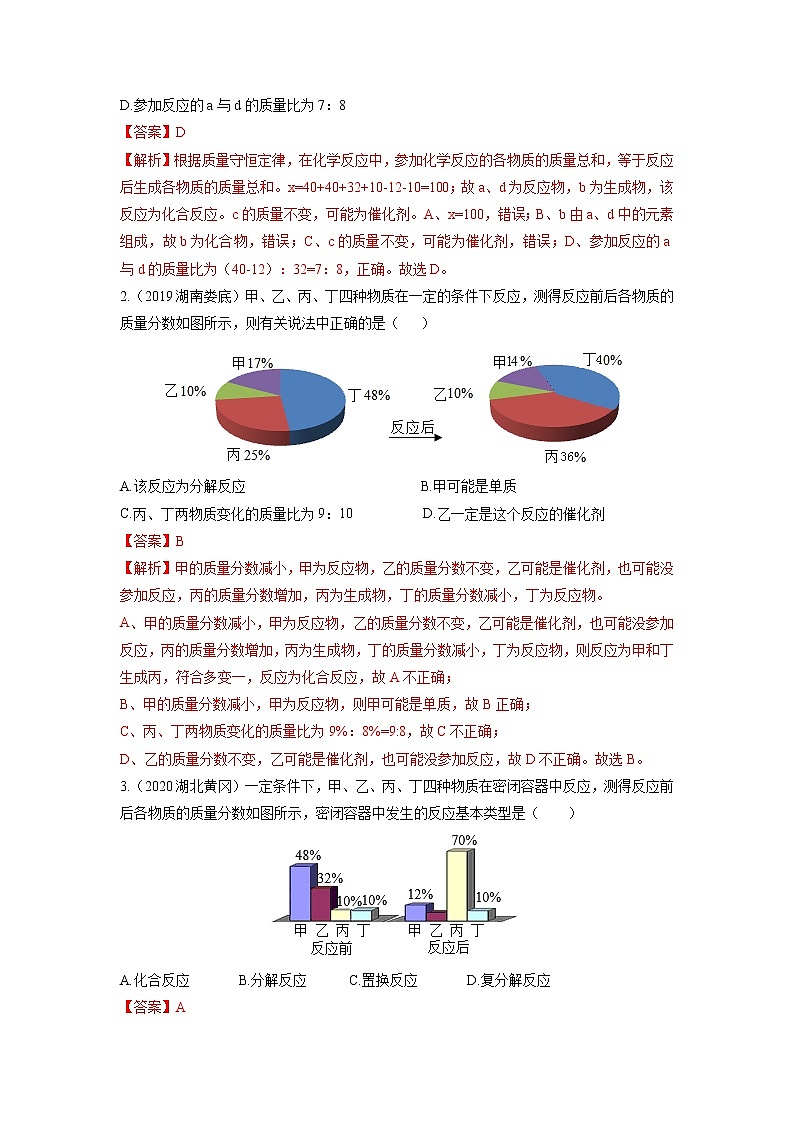
2.(2019湖南娄底)甲、乙、丙、丁四种物质在一定的条件下反应,测得反应前后各物质的质量分数如图所示,则有关说法中正确的是( )
A.该反应为分解反应 B.甲可能是单质
C.丙、丁两物质变化的质量比为9:10 D.乙一定是这个反应的催化剂
3.(2020湖北黄冈)一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,密闭容器中发生的反应基本类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
4. 30g某有机物M在氧气中完全燃烧,生成44gCO2和18gH2O,下列说法不正确的是( )
A.M含有C、H、O三种元素
B.M中氧元素的质量分数约为53.3%
C.完全燃烧时,M与消耗O2的质量比为15:16
D.3.0gM在2.4gO2氧气中燃烧生成2.4gCO、1.2CO2和1.8gH2O
5.某有机物在9.6g氧气中恰好完全燃烧,生成8.8gCO2和5.4gH2O,下列说法正确的是( )
A.该有机物只含碳、氢两种元素
B.该有机物中一定含有碳、氢元素,可能含有氧元素
C.该有机物中一定含有碳、氢、氧三种元素
D.无法确定
6.化学是以实验为基础的学科,当您走进化学实验室时,会发现有些药品装在棕色瓶中这是因为这些药品见光,在紫外线作用下容易分解,您预测硝酸银见光分解不可能得到的产物是( )
A.N2B.NOC.NO2D.NH3
真题再现
1. 甲、乙、丙、丁四种物质在密闭容器内充分混合反应,测得反应前后各物质的质量关系如图所示。则有关说法中不正确的是( )
A.丁一定是化合物
B.参加反应的甲和乙质量比为2:7
C.丙可能是该反应的催化剂
D.x的值是7
2.在密闭容器内,有甲、乙、丙、丁四种物质,甲、丁的相对分子质量之比为1:9.在一定条件下充分混合反应,测得反应过程中t1、t2时刻的质量分数如图所示,下列说法正确的是( )
A.乙一定是该反应的催化剂
B.生成的甲、丙两物质的质量比为8:1
C.该反应方程式中丁和甲的计量数之比为1:1
D.某时刻,若ω甲为18%,则ω丙为32%
3.(广西北部湾经济区2020年中考化学试题)下图是制取乙醇的反应微观示意图。下列说法正确的是( )
A.反应前后共有四种分子
B.反应物中只有一种物质是氧化物
C.反应前后催化剂的性质不变
D.参加反应的和分子个数比是3:2
4.(云南省昆明市2020年中考化学试题)在一个密闭容器中,有a、b、c、d四种物质,反应前各物质的质量关系如下图刻度纸所示(例如:d的质量为2g)。
在一定条件下发生反应,反应结束后,再次测得各物质的质量变化,并通过刻度的移动来表示,且记录在同一张刻度纸上:刻度线Ⅰ向右移动9格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
A.反应结束后c的质量为14g
B.该反应可能为置换反应
C.a、b变化的质量比一定为9:17
D.a、d的相对分子质量之比一定为9:8
5.(江苏省盐城市2020年中考化学试题)将一定质量的甲醇(CH3OH)和氧气(O2)置于密闭容器中点燃,一段时间后反应停止,测得反应后各物质的质量,相关数据如下表所示。下列说法不符合事实的是( )
A.m>n
B.X中一定含有碳元素
C.无法判断X中是否含有氧元素
D.生成物中C、H两种元素的质量比为3∶1
6. 工业上合成SO3的反应原理为2SO2+O2 eq \\ac(\s\up7(△),\(===,====)) 2SO3。一定条件下,在一密闭容器内放入 SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为g)如下表所示。下列说法错误的是( )
A.丁物质一定是V2O5
B.d=15
C.丙物质是O2
D.t3时,生成乙的总质量为75 g
7.在化学反应2A+B2=2C中,已知20gA和足量B2充分反应后,生成30g C.已知B2的相对分子质量为32,则C的相对分子质量是( )
A.20B.32C.48D.96
8.有下列化学方程式:A+3B=2C+2D,7gA与24gB恰好完全反应。生成D的质量是9g。若C的相对分子质量为44,则B的相对分子质量为( )
A.16 B.32 C.36 D.96
考向二、利用化学方程式计算
1.要明确解题思路
解题时,一般思路:先找出题中涉及的化学反应,并正确书写化学方程式;找出题中所提供的数据与化学方程式中各物质的直接或间接关系;确定哪些数据能直接代入化学方程式,如果所给数据与化学方程式中各物质的关系仅仅是间接关系,那么必须分析清楚该数据是通过什么“中介”与各物质产生联系的,再列出相应的比例式。
2.利用化学方程式计算的步骤
(1)根据题意设未知量(用x,y等字母表示)。
(2)写出反应的化学方程式。
(3)写出相关物质的化学计量数与相对原子质量的乘积以及已知量、未知量。
(4)列出比例式,求未知数。
(5)简明地写出答案。
规律总结:化学方程式的计算可简记为“设”“写”“找”“列”“答”。
知识拓展
根据化学方程式计算的常见类型
1.已知一种物质的质量,求另一种物质的质量
这种题型是按照化学方程式计算的重点,重在按计算格式进行计算。
根据化学方程式计算,实际上是利用化学方程式中各物质的质量比来计算(这是隐含的已知条件),因此只要已知化学方程式中任一反应物或生成物质量,就可求出其他物质的质量。
2.含字母的化学方程式的计算
利用含字母的化学方程式计算时,它的解题依据同样是利用相关物质的质量比列比例式计算,不过它的物质质量比是隐含的已知条件,它的计算方法一般有两种:
(1)通过相对分子质量进行转换,即用相对分子质量与化学计量数乘积表示。
(2)利用参加反应的反应物或生成物的质量来表示。
例如:在反应A+3B=2C+3D中,C和D的相对分子质量比为22∶9,若2.3 g A与足量B充分反应,生成2.7 g D,则在此反应中,参加反应的B与生成的C之间的质量比为多少?
已知C、D的相对分子质量比为22∶9,那么在该反应中C、D的质量比为(22×2)∶(3×9)=44∶27,已知生成D的质量2.7 g,列比例式可求出生成C的质量4.4 g,再根据质量守恒定律可得出参加反应的B质量为2.7 g+4.4 g-2.3 g=4.8 g,那么B、C质量比为4.8 g∶4.4 g=12∶11。
解题时应注意:
(1)相对分子质量比并不一定等于物质的质量比,两者之间转换时,一定要结合化学方程式中的化学计量数。
(2)当题目中的数据较多时,不要乱,不要放弃,要学会有条理地将数据按题意写在相应物质下面,然后合理利用。
3.气体参加反应或求气体体积的计算。
化学方程式表示的是各物质之间的质量关系,若有一定体积的气体参加反应,则先要将气体的体积换算成气体的质量;若要求出待求气体的体积数,则要先根据化学方程式求出气体的质量,再将其换算成体积。
气体的体积与气体的质量的换算关系为:气体的质量=气体的体积×气体的密度。
4.与实验相结合的化学方程式计算
在化学计算的考查中,有些地方的中考试题中往往将化学方程式计算与实验数据的分析处理综合在一起,难度较大。解答时需要认真分析实验现象,通过化学计算,得出正确结论。
5.利用坐标图像进行化学方程式的计算
(1)识标:理解坐标图中横、纵坐标的含义,找出横、纵坐标的关系,再结合教材,联系相应的知识点。
(2)明点:曲线中的特殊点(起点、终点、顶点、转折点、交叉点等)表示了什么化学意义。
(3)析线:曲线的走向、变化趋势,揭示各段曲线的变化趋势及其含义。根据横、纵坐标的含义可以得出:在一定范围内,随“横坐标量”的增加,“纵坐标量”逐渐增加或减小。超过一定范围后,随“横坐标量”的增加,“纵坐标量”减小或增加,或者达到某种平衡状态。若为多重变化曲线坐标图,要分别揭示其变化趋势,然后对比分析,找出符合题意的曲线或结论或解题所用的数据信息等。
综上,解题时要把图像表示的意义与化学知识有机地结合起来,准确地找出图像与化学反应之间量的关系,根据化学方程式进行相关计算。
6.表格型化学方程式的计算
表格数据分析型的化学方程式计算题的特点是以表格的形式给出有关量之间的关系,根据表格中的数据进行分析、处理,最终解答有关问题。解答此类试题应注意的问题:
(1)要读懂题意,对表格数据进行分析,筛选有价值的信息,获取相关数据、性质、规律,形成解题思路。
(2)若是多次或多组数据和条件,则需通过比较、对比分析、确定出恰好完全反应的量(即可以用于计算的量),然后依据题意来进行计算。
(3)要善于根据表中数据的变化规律找出与所给问题的关系。如表中显示固体(或溶液)质量不再减少、气体(或沉淀)不再增加等,即意味着反应不再进行。
方法技巧
1.有关化学方程式计算的要点归纳
(1)三个要领:①步骤要完整;②格式要规范;③计算要准确。
(2)三个关键:①准确书写化学式;②化学方程式要配平;③准确计算相对分子质量总和。
(3)三个注意:
①由于方程式只能反映物质间的质量比,因此代入方程式中的各个量必须是质量。由于方程式中各物质是纯净物,因此代入方程式中的量必须是纯净物的质量。
②计算时单位必须统一(必须是质量单位,如果是体积单位,需结合密度换算成质量单位)。
③对题目中所给“适量”“足量”“过量”“恰好完全反应”“完全反应”“反应一段时间”等词语要准确把握和理解。
2.利用化学方程式计算的常用方法
(1)多步反应关系法
对于涉及两个或两个以上相互关联的化学方程式的计算,可找出有关物质的关系式,通过它们的关系量来求解。
(2)差量法
在根据化学方程式的计算中,有时题目给出的条件是反应前后的物质的质量差,用差量法十分简便。此法的关键是分析反应前后形成差量的原因,找出差量和已知量、未知量之间的关系,然后再列比例式求解。
(3)守恒法
化学中常用的“守恒”包括元素质量守恒、物质质量守恒等。
①元素守恒包含化学反应前后元素的种类守恒和元素的质量守恒两种情况。可应用确定物质元素组成(化学式),确定物质质量。
②物质质量守恒可用于给出化学反应中其他参加反应的反应物或生成物的物质质量,求某一反应物或生成物的质量;寻找化学反应前后表现出来的质量差,得出气体或沉淀的质量,进行计算。
跟踪训练
1.(2020湖北荆门)将12.5g混有二氧化锰的氯酸钾固体加热至质量不再减少,冷却后称量固体的质
量为7.7g。
(1)反应时生成氧气的质量为 g。
(2)计算反应前固体中二氧化锰的质量分数(要求写出计算过程)。
2.(2020湖南衡阳)鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,取12.5g干燥的鸡蛋壳,捣碎放在烧杯中,然后向其中滴加某浓度的稀盐酸滴加过程中产生气体质量与所加稀盐酸质量的关系如图所示(鸡蛋壳中除CaCO3外的其他成分都不溶于水,也不与稀盐酸反应)。试计算:
(1)产生CO2的质量为 g。
(2)该鸡蛋壳中CaCO3的质量分数;
(3)所用稀盐酸溶质的质量分数。
3.(2020安徽)碳酸氢钠是面点膨松剂的主要成分之一。
小芳同学研究反应2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间量的关系。
(1)理论计算:1.26g NaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量(写出计算过程)。
(2)实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后质量变化值 (填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是 。
真题再现
1. 甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH+nO2eq \\ac(\s\up7(点燃),\(====,=====))mCO2+2CO+16H2O。若反应生成3.6 g水,请计算:
(1)m的值是 。
(2)参加反应的氧气质量是多少克?(写出规范计算步骤)
2.为测定某过氧化钠样品的纯度,将2 g该样品与足量X发生如下反应(杂质不参与反应):2Na2O2+2X═4NaOH+O2↑,生成气体质量与时间的关系如图所示。回答问题:
(1)过氧化钠中钠、氧元素的质量比为 ;物质X的化学式为 。
(2)生成氧气的质量是 g。
(3)计算2克该样品中过氧化钠的质量。
3.某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0 g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如表):
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为 0.96 g;
(2)原混合物中二氧化锰的质量分数是多少?(写出计算过程,结果精确到0.1%)
4.在实验室制取氧气时,取MnO2和KClO3的固体混合物30.5g,加热至不再产生气体为止,收集到一定质量的氧气。某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出。加水的质量与剩余固体的质量见下表:(提示:MnO2是不溶于水的固体粉末)
试求:
(1)原混合物中MnO2的质量为 g。
(2)制得氧气的质量为多少克?
5.某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0 g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如表):
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为 0.96 g;
(2)原混合物中二氧化锰的质量分数是多少?(写出计算过程,结果精确到0.1%)
6.有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成等,某学习小组进行了以下探究,请参与并完成有关计算:(Zn+H2SO4=ZnSO4+H2↑)
(1)取样品20g和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤,干燥后称得其质量为13.5g。该样品中铜的质量分数为 。
(2)再取三份不同质量的样品,分别加入到三份100g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
7.某同学取一定质量的氯酸钾和二氧化锰加热,记录产生氧气的质量与反应时间的关系如图所示,请计算混合物中氯酸钾的质量。
8.某学习小组在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量的变化如图所示。请计算:
(1)反应结束后生成氧气的质量为 g。(结果精确到0.1g)
(2)冷却至室温,将剩余的固体溶解在85.1g水中,充分溶解后过滤,计算所得不饱和溶液中溶质的质量分数。(结果精确到0.1%)
考向三、含杂质的反应物(或生成物)质量的计算
(1)将含杂质的已知物质量换算为纯物质质量,其关系式为:纯度=eq \f(纯物质质量, 含杂质物质物质质量)×100%,纯物质质量=含杂质物质质量×纯度。
(2)将纯物质质量代入化学方程式进行计算。
(3)将计算得到的纯物质质量换算成含杂质物质质量:含杂质物质质量为=eq \f(纯物质质量, 纯度)。
跟踪训练
1.用1000t含有氧化铁80%的赤铁矿石,理论上可以炼出含铁97%的生铁的质量约是( )
A.560t B.571t C.577t D.583t
2.充分煅烧20t含碳酸钙80%的石灰石,可制得含杂质的生石灰的质量为( )
A. 8.96t B. 11.2t C. 10t D. 12.96t
真题再现
1.现有384t含Fe2O3 80%赤铁矿石,理论上可炼出含铁96%的生铁的质量为( )
A. 320t B. 224t C. 206 t D. 112t
2.某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96%的生铁63 t,假设在炼制过程中损失10%铁元索,则理论上需要含杂质20%的赤铁矿石的质量是( )
A. 120 t B. 108 t C. 96 t D. 84 t物质
a
b
c
d
反应前的质量/g
40
40
10
32
反应后的质量/g
12
x
10
0
物质
CH3OH
O2
H2O
CO2
X
反应前质量/g
m
12.8
0
0
0
反应后质量/g
0
0
10.8
8.8
n
物质
甲
乙
丙
丁
t1
100
5
80
5
t2
60
55
a
b
t3
40
c
d
5
反应前
反应后
NaHCO3/g
锥形瓶+稀硫酸/g
锥形瓶+反应后溶液/g
1.26
24.59
25.36
反应时间/min
1.0
1.5
2.0
2.5
3.0
剩余固体质量/g
2.55
2.25
2.10
2.04
2.04
编号
1
2
3
4
加水的质量(g)
20
20
20
20
剩余固体的质量(g)
14.5
8.1
6
6
反应时间/min
1.0
1.5
2.0
2.5
3.0
剩余固体质量/g
2.55
2.25
2.10
2.04
2.04
实验序号
①
②
③
样品的质量/g
10
20
30
生成气体的质量/g
0.1
0.2
0.25
考点14 化学式意义、书写和计算-备战2022年中考化学一轮复习考点帮·学案: 这是一份考点14 化学式意义、书写和计算-备战2022年中考化学一轮复习考点帮·学案,文件包含考点14化学式意义书写和计算-备战2022年中考化学一轮复习考点帮解析版docx、考点14化学式意义书写和计算-备战2022年中考化学一轮复习考点帮原卷版docx等2份学案配套教学资源,其中学案共42页, 欢迎下载使用。
考点11 元素-备战2022年中考化学一轮复习考点帮·学案: 这是一份考点11 元素-备战2022年中考化学一轮复习考点帮·学案,文件包含考点11元素-备战2022年中考化学一轮复习考点帮解析版docx、考点11元素-备战2022年中考化学一轮复习考点帮原卷版docx等2份学案配套教学资源,其中学案共37页, 欢迎下载使用。
考点10 微观模型-备战2022年中考化学一轮复习考点帮·学案: 这是一份考点10 微观模型-备战2022年中考化学一轮复习考点帮·学案,文件包含考点10微观模型-备战2022年中考化学一轮复习考点帮解析版docx、考点10微观模型-备战2022年中考化学一轮复习考点帮原卷版docx等2份学案配套教学资源,其中学案共35页, 欢迎下载使用。












