

所属成套资源:2021_2022学年新教材高中化学练习含解析鲁教版选择性必修1
- 2021_2022学年高中化学第二章化学反应方向限度与速率第一节化学反应的方向三练习含解析鲁教版选择性必修1 试卷 0 次下载
- 2021_2022学年高中化学第二章化学反应方向限度与速率第一节化学反应的方向五练习含解析鲁教版选择性必修1 试卷 0 次下载
- 2021_2022学年高中化学第二章化学反应方向限度与速率化学反应的选择与反应条件的优化三含解析鲁教版选择性必修1练习题 试卷 0 次下载
- 2021_2022学年高中化学第二章化学反应方向限度与速率化学反应的选择与反应条件的优化五含解析鲁教版选择性必修1练习题 试卷 0 次下载
- 2021_2022学年高中化学第二章化学反应方向限度与速率化学反应的选择与反应条件的优化四含解析鲁教版选择性必修1练习题 试卷 0 次下载
化学选择性必修1微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化当堂检测题
展开
这是一份化学选择性必修1微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化当堂检测题,共19页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。
一、单选题,共15小题
1.对于可逆反应C(s) + CO2 (g) ⇋ 2CO(g),反应的化学平衡常数的表达式为( )
A.B.
C.D.
2.某反应由两步反应A→B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( )
A.两步反应均为吸热反应B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变D.整个反应中ΔH=E1-E4
3.中国锅炉燃煤采用沸腾炉逐渐增多,采用沸腾炉好处在于( )
A.增大煤炭燃烧时的燃烧热并形成清洁能源
B.减少炉中杂质气体(如SO2等)的形成
C.提高煤炭的热效率并减少CO2的排放
D.使得燃料燃烧充分,从而提高燃料的利用率
4.在一定温度下,体积不变的密闭容器中,可逆反应X(g)+3Y(g)⇌2Z(g)达到平衡的标志是( )
A.气体总质量保持不变B.X、Y、Z的浓度都相等
C.X、Y、Z的浓度不再发生变化D.X、Y、Z的分子数之比为1:3:2
5.下列说法正确的是
A.太阳能、潮汐能、煤、电能都是一级能源
B.用热的纯碱溶液去油污利用了盐类水解的原理
C.盛放 NaClO 溶液的试剂瓶用磨口玻璃塞
D.常温下,吸热反应肯定不能自发进行
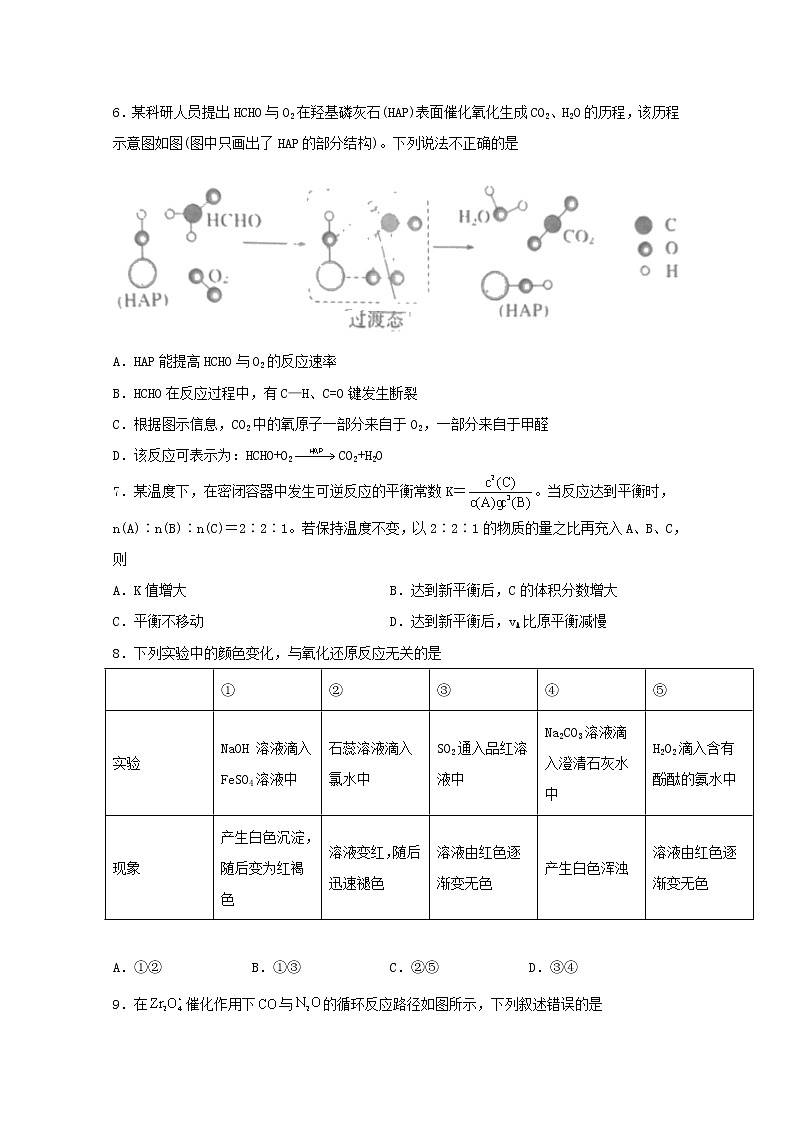
6.某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。下列说法不正确的是
A.HAP能提高HCHO与O2的反应速率
B.HCHO在反应过程中,有C—H、C=O键发生断裂
C.根据图示信息,CO2中的氧原子一部分来自于O2,一部分来自于甲醛
D.该反应可表示为:HCHO+O2CO2+H2O
7.某温度下,在密闭容器中发生可逆反应的平衡常数K=。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
A.K值增大B.达到新平衡后,C的体积分数增大
C.平衡不移动D.达到新平衡后,vA比原平衡减慢
8.下列实验中的颜色变化,与氧化还原反应无关的是
A.①②B.①③C.②⑤D.③④
9.在催化作用下与的循环反应路径如图所示,下列叙述错误的是
A.的作用是降低与反应所需的活化能,提高活化分子百分数,提高与反应的转化率
B.是反应中间产物
C.转化为的氧化剂是
D.催化循环的总反应为
10.为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。已知:CO2(g)+3H2 (g)-CH3OH(g)+H2O(g) △H="-49.0" kJ/ml。T1℃时,向体积为1 L的恒容密闭容器中充入l ml CO2和3 ml H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图F6-2所示,且平衡时体系压强为p1。下列叙述中不正确的是
A.0~3 min内,v(CO2)正=v(CH3OH)正
B.在T1℃时,若起始时向容器中充人2 ml CO2和6 ml H2,测得平衡时容器内压强为p2,则p2T1
11.下列关于反应过程中能量变化的说法正确的是
A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)== CH3CH3(g) ΔHΔH2,B不正确;
C. 光照和点燃只是引发反应的条件,不影响反应H2 (g)+Cl2(g)==2HCl(g)的ΔH,C不正确;
D. 在一定条件下,某可逆反应的ΔH=+100 kJ·ml-1,即反应物比生成物能量低100 kJ·ml-1,从而得出该反应正反应活化能比逆反应活化能大100 kJ·ml-1,D正确。
故选D。
12.D
【解析】根据Ka=c(H+)×c(F-)/c(HF), Ka/c(F-)=,随着溶液pH增大,酸性减弱,碱性增强,溶液中c(F-)逐渐增大,Ka/c(F-)逐渐减小, 不断减小,A错误;酸溶液抑制水的电离,酸性越强对水电离抑制程度越大,水电离出的c(H+)就越小,从图像可以看出,X 、Q、Y三点对应溶液的pH逐渐增大,酸性减弱,所以由水电离出的c(H+)应逐渐增大,B错误;HF的电离常数Ka=c(H+)×c(F-)/c(HF),当c(F-)= c(HF)时,溶液的pH=10-3.4ml/L,所以HF的电离常数Ka=1.0×10-3.4,C错误;0.1 ml/LNaF溶液水解平衡常数Kh=KW/Ka=1×10-14/1.0×10-3.4=10-10.6, Kh= c(HF)×c(OH-)/c(F-)= c2(OH-)/0.1=10-10.6, c(OH-)=10-5.8ml/L, c(H+)=10-8.2 ml/L, pH约为8.2,D正确;正确选项D。
13.D
【分析】
A、将容器的体积缩小到原来的一半,若平衡不移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的2.1倍,说明平衡向着生成A的方向移动了;
B、当反应物的物质的量之比等于系数值比时,则达到化学平衡时,反应物的转化率是相等的;
C、对于反应前气体体积不变,混合气体总的物质的量不变;
D、对于反应前后气体体积不变的反应,压强不会影响平衡移动。
【详解】
A、将容器的体积缩小到原来的一半,不考虑平衡移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的2.1倍,说明平衡向着生成A的方向移动了,体积缩小即增大压强,平衡向着气体体积减小的方向进行,所以m+n<p+q,A正确;
B、反应开始时,A、B的物质的量之比为m∶n,恰好等于方程式的系数值比,这种情况下平衡时,A、B的转化率相等,B正确;
C、往含有aml气体的平衡体系中再加入aml的B,平衡向正反应移动,因为m+n=p+q,达到新平衡时混合气体总的物质的量不变,达到新平衡时气体的总物质的量等于2aml,C正确;
D、若A为固体,若n>p+q,则增大压强,平衡向正向移动;若n=p+q, 则增大压强,平衡向不移动;若n0.8 当升高到一定温度以后,R渐渐转化为气态 气体物质两边的化学计量数相等,增大压强不改变平衡状态 N渐渐转化为非气态,增大压强平衡向左移动
【解析】
(1)在一定温度下,向一固定容积的密闭容器中加入 1ml M和 2ml N,发生下述反应:M(g)+2N(g)3Q(g)+2R(s)(放热反应),达到平衡时生成了1.8ml Q,
M(g)+2N(g)3Q(g)+2R(s)
起始量(ml) 1 2 0 0
变化量(ml) 0.6 1.2 1.8 1.2
平衡量(ml) 0.4 0.8 1.8 1.2
反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时Q仍为1.8ml,依据化学方程式计算平衡状态下逆向进行生成0.4mlM需要Q物质的量1.2ml,需要R物质的量为0.8ml,反应达到平衡状态R物质的量大于0.8ml,R的起始物质的量n(R)应满足的条件是:n(R)>0.8ml,故答案为>0.8;
(2)若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,形成这种结果的可能原因是R的摩尔质量和原平衡状态的平均摩尔质量相同,即M(R)=原平衡状态的相对分子质量,升高温度后R变化为气体,故答案为当温度升高到一定温度以后,R渐渐转化为气体;
(3)M(g)+2N(g)3Q(g)+R(s),在一定温度和常压下,将1ml M和2ml N充入该容器中,建立平衡之后,M的物质的量浓度为a ml/L。
①当压强为原来1.5倍时,M的平衡时物质的量浓度为m ml/L,测得m=1.5a,体积变化从a变化应1.5a,反应前后气体体积不变,压强减小,平衡不移动只是体积改变,故答案为气体物质两边的化学计量数相等,增大压强不改变平衡状态;
②当压强为原来10倍时,M的平衡时物质的量浓度为n ml/L,体积变化引起的浓度变化浓度应变化为10a,应为n=10a,而实际测定结果测得n>10a,证明平衡逆向进行,只能是增大压强,结合反应前后气体变化可知,可能N变化为非气体才符合,故答案为N渐渐转化为非气态,增大压强平衡向左移动。①
②
③
④
⑤
实验
NaOH 溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
SO2通入品红溶液中
Na2CO3溶液滴入澄清石灰水中
H2O2滴入含有酚酞的氨水中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
溶液由红色逐渐变无色
产生白色浑浊
溶液由红色逐渐变无色
A.增加碳的用量
B.升高温度
C.用CO吸收剂除去CO
D.加入催化剂
t / min
2
4
7
9
n(H2O)/ml
0.12
0.11
0.10
0.10
相关试卷
这是一份鲁科版 (2019)选择性必修1微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化巩固练习,共15页。试卷主要包含了单选题,共15小题,非选择题,共4小题等内容,欢迎下载使用。
这是一份化学选择性必修1第2章 化学反应的方向、 限度与速率微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化课时作业,共19页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修1微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化同步训练题,共16页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。










