

初中化学课题1 常见的酸和碱精品课堂检测
展开1.某化学小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是
A.该实验是将氢氧化钠溶液滴入稀盐酸中
B.a点所示溶液中,溶质只有NaCl
C.b点表示稀盐酸和氢氧化钠溶液恰好完全反应
D.向点c所示溶液中滴加紫色石蕊溶液,溶液变蓝色
2.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A.①②③④⑤B.②③④⑤
C.②③⑤D.②④⑤
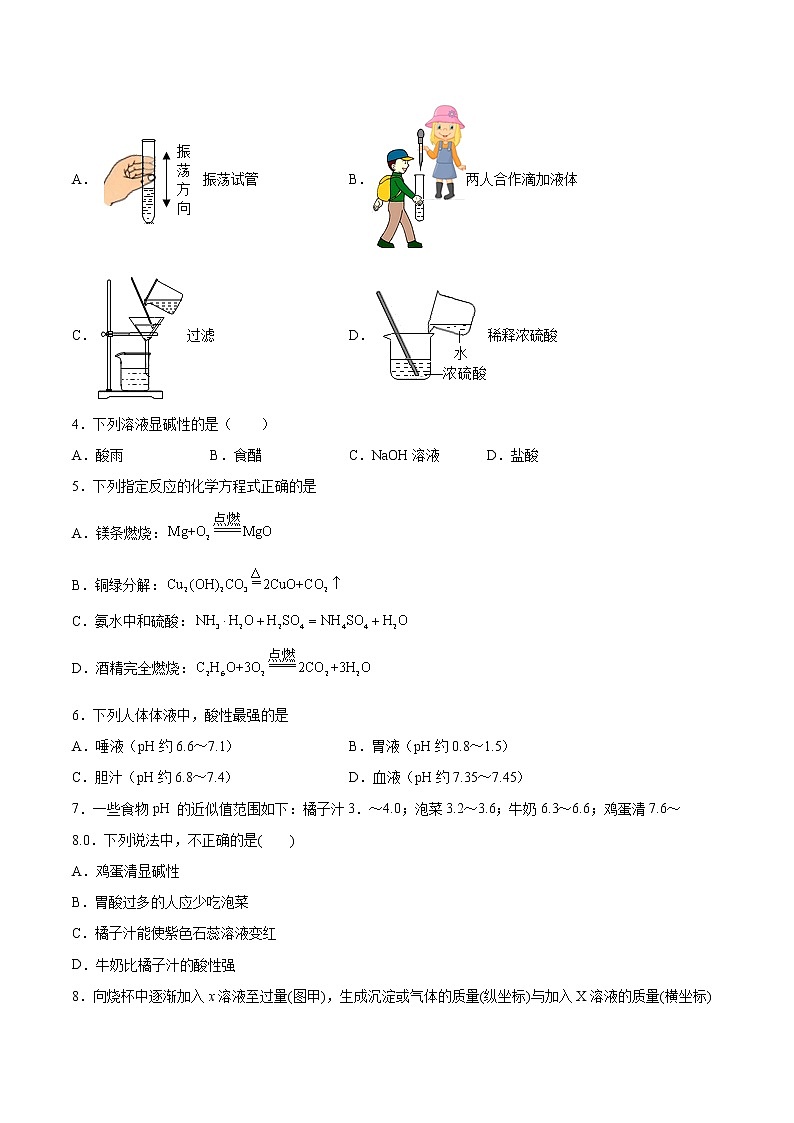
3.以下实验操作正确的是
A.振荡试管B.两人合作滴加液体
C.过滤D.稀释浓硫酸
4.下列溶液显碱性的是( )
A.酸雨B.食醋C.NaOH溶液D.盐酸
5.下列指定反应的化学方程式正确的是
A.镁条燃烧:
B.铜绿分解:
C.氨水中和硫酸:
D.酒精完全燃烧:
6.下列人体体液中,酸性最强的是
A.唾液(pH约6.6~7.1)B.胃液(pH约0.8~1.5)
C.胆汁(pH约6.8~7.4)D.血液(pH约7.35~7.45)
7.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
8.向烧杯中逐渐加入x溶液至过量(图甲),生成沉淀或气体的质量(纵坐标)与加入X溶液的质量(横坐标)关系不符合图乙的是( )
A.AB.BC.CD.D
9.下列能使紫色石蕊试液和无色酚酞试液均变色的是
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
10.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
11.如下列举了生活中常见的几种液体,其中能使紫色石蕊试液变蓝的溶液是( )
A.石灰乳B.苏打水C.白醋D.食盐水
二、简答题
12.某化学兴趣小组在学习碱的化学性质时,进行了如图所示的实验。
(1)图甲实验的目的是探究二氧化碳与氢氧化钠溶液确实发生了化学反应。写出该反应的化学方程式___________。
(2)图乙实验过程中没有观察到明显现象。若先向氢氧化钠溶液中加入_____,再逐滴滴加稀硫酸,可观察到_____的现象,证明稀硫酸与氢氧化钠溶液确实发生了化学反应。
(3)图丙实验中的现象为_____。
13.请按如图所示的硫酸知识网络填空(图中“—”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质):
(1)写出两个属于复分解反应的化学方程式:
① ______ ;
② ______ .
(2)总结出酸的两条化学性质:
① ______ ;
② ______ .
14.现有MgCO3和BaCO3组成的固体混合物6g,放入到100g某浓度的稀盐酸中恰好完全反应,得到不饱和溶液的质量为103.8g,则原固体混合物中Mg、Ba两种元素的质量分数总和为_____。
三、推断题
15.A~G是初中化学常见物质,各物质转化关系如图所示(“→”表示转化关系,“﹣”表示互相反应,反应条件、部分反应物和生成物已省略),其中D和F组成元素相同。
(1)物质A的化学式为_____。
(2)反应③的化学方程式为_____。
(3)图中的分解反应有_____(填序号)。
(4)根据反应②,B物质可以在实验室或生活中作_____。
16.A~G均为初中化学中常见的物质:其中A、C组成元素相同,E是红色单质.如图是它们之间的转化关系,请回答:
(1)写出反应①的化学方程式_______________,其中B物质在该反应中起_______作用.
(2)反应②中的现象为_________________.
(3)反应③的基本类型是____________反应.
17.某市某校“绿色”环保小组的同学用精密酸度计测得甲、乙、丙、丁四种废液的pH如下表。现请你和他们一起完成并回答下列问题:
(1)各取溶液少许,分别滴入1~2滴无色酚酞试液,能使酚酞试液变红的废液是____________。
(2)丁可能是______溶液。
(3)化学老师告知,乙、丙分别是未用完的氢氧化钡溶液和稀硫酸,为防止废液对环境的污染,小云将丙溶液逐滴滴入乙中,刚好完全反应,此时溶液的pH____(填“>”、“<”或“=”) 7,该反应的化学方程式为______。
四、实验题
18.二氧化碳的制取与性质是初中化学实验的重要内容,根据下图回答问题。
(1)仪器a的名称是 ___________ 。
(2)实验室用石灰石与稀盐酸反应制取CO2,应该选择的发生装置是 _________ (填序号)
(3)③中,若X为澄清石灰水,则③中可以观察到的现象是 _________________________ 。若X是水,④中能观察到紫色石蕊试纸变红,若④中紫色石蕊试纸没有变红,则X可能是 _______ (填序号)。
A NaOH溶液B CaCl2溶液 C 浓硫酸 D 稀盐酸
19.有三瓶失去标签的溶质质量分数为15%、10%、5%的盐酸。选择下列仪器和药品,设计两种不同的方案,辨别出三瓶盐酸
实验仪器:温度计、量筒、秒表、烧杯、试管、剪刀、镊子
药品:镁条
提示:镁条和盐酸反应速度很快,通过观察放出气泡的速度很难准确判断盐酸浓度的大小。
(1)写出镁与盐酸反应的化学方程式:_______________。
(2)实验的关键是控制三个变量:
①在的环境温度下进行实验。
②取相同质量的镁条。
③取_____________________。
(3)你的方案是:
方案一:测定_________________。
方案—:测定____________________。
五、计算题
20.现有赤铁矿样品(样品中的其他成分不参加反应,也不溶于水),取10g该混合物加入100g稀硫酸,恰好完全反应,再加入52g水,过滤得到2g滤渣和一定量不饱和滤液。计算:
(1)该赤铁矿样品中氧化铁的质量;
(2)加入的稀硫酸中溶质的质量分数;
(3)所得滤液中溶质的质量分数。
21.向一定质量的铁粉和碳酸钙粉末的混合物中加入足量的稀盐酸,共收集到2.6g混合气体。将混合气体通过足量的澄清石灰水中得到5g白色沉淀。
(1)混合固体中碳酸钙的质量为______g;
(2)2.6g混合气体中氢气的质量为_____g;
(3)求混合固体中铁的质量分数____。(已知:CaCO3+2HCl=CaCl2+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O Fe +2HCl=FeCl2+H2↑)
选项
烧杯中的物质
x溶液
A
稀硫酸
氯化钡溶液
B
氯化钠溶液
硝酸银溶液
C
硫酸和硫酸铜混合溶液
氢氧化钠溶液
D
碳酸氢钠溶液
稀盐酸
参考答案:
1.B 2.B 3.C 4.C 5.D 6.B 7.D 8.C 9.D 10.B 11.B
12. 2NaOH+CO2=Na2CO3+H2O 酚酞溶液 溶液由红色变为无色 有蓝色沉淀产生
13. Fe2O3+ 3H2SO4= Fe2(SO4)3+3H2O H2SO4+BaCl2=BaSO4↓+2HCl 酸和金属氧化物反应生成盐和水 金属和酸反应生成盐和氢气
14.50%
15. CaCO3 CO2+H2O=H2CO3 ①⑤ 干燥剂
16. 2H2O22H2O+O2↑ 催化 红色固体变黑 复分解
17. 乙 NaCl(答案合理即可) = Ba(OH)2+H2SO4===BaSO4↓+2H2O
18. 试管 ② 澄清石灰水变浑浊 AC
19. Mg+2HCl=MgCl2+H2↑ 相同体积的盐酸 不同浓度盐酸和镁条反应所需时间 不同浓度盐酸和镁条反应后所得溶液的温度
20.(1)8g;(2)14.7%;(3)12.5%
21.(1)5(2)0.4(3)69.1%
初中化学科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱同步达标检测题: 这是一份初中化学科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱同步达标检测题,共14页。试卷主要包含了单选题,综合应用题等内容,欢迎下载使用。
人教版九年级下册课题1 常见的酸和碱当堂检测题: 这是一份人教版九年级下册课题1 常见的酸和碱当堂检测题,共13页。试卷主要包含了单选题,综合应用题等内容,欢迎下载使用。
初中化学人教版九年级下册课题1 常见的酸和碱课后作业题: 这是一份初中化学人教版九年级下册课题1 常见的酸和碱课后作业题,共13页。试卷主要包含了单选题,简答题,推断题,实验题,计算题等内容,欢迎下载使用。













