





2022版中考化学大一轮培优训练及课件专题六 常见的酸和碱 55PPT课件
展开
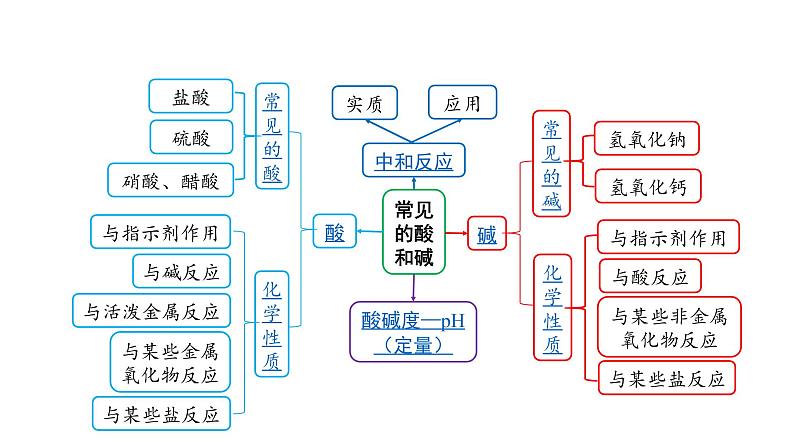
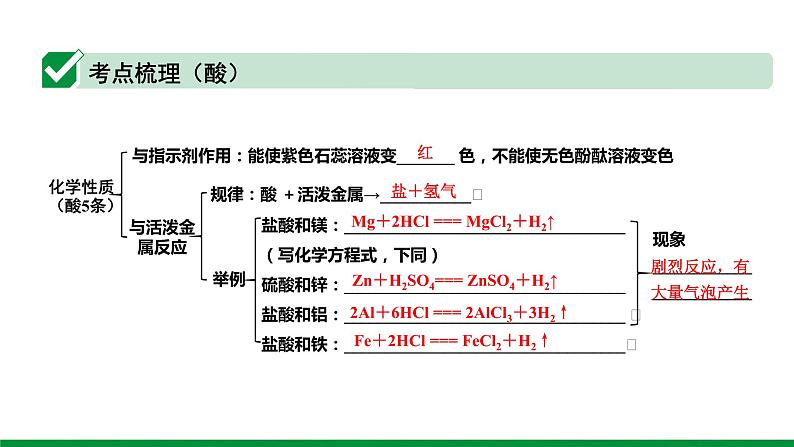
这是一份2022版中考化学大一轮培优训练及课件专题六 常见的酸和碱 55PPT课件,共55页。PPT课件主要包含了常见的酸和碱,~14,玻璃棒,pH试纸,常见的酸,浓硫酸,干燥剂,化学性质酸5条,与活泼金属反应,盐+氢气等内容,欢迎下载使用。
定义:溶液的酸碱度常用pH来表示,pH的范围通常为________ 溶液pH测定方法:用________ 蘸取少量待测液,滴在__________ 上,将试纸 显示的颜色与标准比色 卡对照,读出对应的pH
pH与溶液 酸碱性的 关系
pH7时,溶液显⑥______ 性
测定土壤的酸碱性,提供土壤改良依据 测定雨水的 pH(pH7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2的溶解度随温度升高而减小;②Ca(OH)2与空气中的CO2反应。他们设计以下方案进行探究,其中没有意义的是( )A. 将装有浊液的烧杯,用冰水冷却,恢复至t ℃,观察浑浊是否消失B. 取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生C. 取适量浊液,过滤,往滤液中加入Na2CO3溶液,观察是否有沉淀生成D. 其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
6.(2017福建14题7分)如图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
(1)A不可能是___(填标号)。a. Mg b. Fe c. Ag d. Zn(2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为______________________________。(3)若C为碳酸钠①C与D的反应属于_____________(填基本反应类型);②D与盐酸反应的化学方程式为______________________________(写一个);③将二氧化碳通入C溶液,可化合生成碳酸氢钠(NaHCO3),该反应的反应物有_____种。
Fe2O3+6HCl=== 2FeCl3+3H2O
Ca(OH)2+2HCl=== CaCl2+2H2O
7.(2016龙岩)“XX洁厕精”产品特性或注意事项如下:①轻松去除锈迹;②勿与碱性物质混合使用;③不适用于大理石地面,其中,与洁厕精含有盐酸有关的是( )A. 只有③ B. 只有①② C. 只有②③ D. ①②③8.(2019龙岩5月质检)古罗马贵族阶层发现一种金属器皿,用其盛葡萄酒可除掉酒中的酸而使酒味纯正。已知,除酸过程酸与金属间发生了置换反应。下列有关推断肯定错误的是( )A. 葡萄酒的pH<7B. 葡萄酒属于混合物C. 除酸过程的反应产物之一为H2D. 该金属比铜更不活泼
9.(2016福州)电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O 2H2↑+O2↑。电解一定质量氢氧化钠稀溶液的过程中,下列说法正确的是( )A. 溶液的pH减小B. 溶液中氢元素质量分数减少C. 溶液中钠元素质量变大D. 溶液中氢、氧元素质量比不变
10.(2014漳州)图中甲、乙、丙是初中化学常见的物质,用“——”连接的两种物质在溶液中可发生化学反应。下列说法不正确的是( )
A. 甲可以为盐B. 乙只能是氧化物或酸C. 丙只能是金属单质、盐或碱D. 其中一个反应能同时生成两种沉淀
11.(2016三明节选)了解日用化工品的成分,有利于我们正确使用。
(1)炉具清洁剂的pH____7(填“>”、“<”或“=”),使用时禁止与皮肤接触是因为氢氧化钠具有________性。(2)不能用洁厕灵清洗铁制品的原因是________________________(用化学方程式表示)。
12.(2014漳州)下面是某化学兴趣小组的同学对氢氧化钠部分性质的探究过程:
(1)用手触摸②的烧杯外壁,感觉发烫,这是由于氢氧化钠固体溶于水时会________(填“吸热”或“放热”),该溶液呈______色;③中的溶液显______色。
Fe+2HCl=== FeCl2+H2↑
(2)从③到④溶液的颜色变化不明显,说明④中的溶液呈______性(填“酸”或“碱”)。(3)c溶液和a溶液对比,c溶液颜色更浅。【提出问题】为什么继续通入过量的二氧化碳气体溶液颜色会更浅?【设计实验】
【实验结论】根据甲、乙两个实验得出的结论,写出甲实验中发生反应的化学方程式:_______________________________________。【实验反思】同种反应物在不同的条件下发生化学反应时,可能得到不同的产物。如:碳在氧气中燃烧可以生成________或______。
NaHCO3+HCl=== NaCl+H2O+CO2↑
13.(2014龙岩)小李在化学实验技能考查中,完成“用稀盐酸鉴别氢氧化钠溶液和碳酸钠溶液,并测碳酸钠溶液的pH”实验。
【实验一】小李取待测液甲、乙分别放置在试管①和②,再往两支试管中滴入稀盐酸,观察实验现象。根据现象推知,乙为碳酸钠溶液。(1)实验中,小李应观察到试管②的现象是______________________,该试管中反应的化学方程式为_________________________________________。
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
(2)老师指出:除盐酸外,还可使用其它试剂鉴别氢氧化钠和碳酸钠溶液。请你选择一种不属于酸的试剂,并将鉴别实验中的预期现象以及化学方程式填入下表。
CaCl2+Na2CO3=== CaCO3↓+2NaCl
(3)小李因操作错误,得出“Na2CO3溶液pH=3”的错误结论。指出小李操作错误之处。答:____________________________________________________________________。(4)指出小李记录的“实验现象”中不科学的地方。答:_________________。
取用实验一后试管②中的溶液,不是碳酸钠溶液,故所测pH不正确
【实验二】小李用玻璃棒蘸取“实验一”后试管②中的溶液沾在pH试纸上,观察试纸颜色变化并与标准比色卡对照,读出溶液的pH。小李的记录如下:
14.(2019福州5月质检)镁的课堂,“镁”的享受。资料①:镁可以在氮气、二氧化碳中燃烧;镁也能与水反应。资料②:常温下,各物质开始沉淀的pH如下表:
(1)镁元素的相关信息 “ ” ,画出镁原子的结构示意图:________。
用矿石(含MgO、Fe2O3、Al2O3和SiO2)制备氢氧化镁的流程示意图如下:
(2)从该流程推测SiO2具有的化学性质是___________________(写一条)。(3)操作①中盐酸与Fe2O3反应的化学方程式为________________________________。(4)实验室完成操作②所用玻璃棒的作用是______。(5)溶液Ⅰ中的阳离子有____种。(6)沉淀B的成分有____________________。Ⅲ.炼镁(7)工业上用电解融熔氯化镁制取镁,可用来冷却镁蒸气的气体可以是___________。Ⅳ.用镁(8)镁合金广泛用于携带式的器械和汽车行业中,达到轻量化的目的,主要利用其性质是________(写—点)。
Fe(OH)3、Al(OH)3
15.(2016泉州)中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是( )A. 用熟石灰改良酸性土壤B. 用含氢氧化镁的药物治疗胃酸过多C. 用盐酸除去铁锈D. 用氨水(NH3·H2O)处理工厂污水中的硫酸
16.(2019宁德5月质检)向盛有一定量氢氧化钠溶液的烧杯中逐滴加入稀盐酸(该反应是放热反应),下列不符合实验事实的是( )
17.(2016厦门)用化学方法可制取纯净的物质。化学兴趣小组应用中和反应原理制取氯化钠固体。(1)往装有氢氧化钠溶液的烧杯中滴入紫色石蕊试液,溶液呈________色。
(2)如图,往该烧杯中继续逐滴滴加稀盐酸至溶液恰好变为紫色,再往反应后的溶液加入活性炭,充分混合,过滤后得到无色滤液。
①加入活性炭的目的是__________;②在过滤操作中,玻璃棒的作用是________。
(3)用pH试纸测(2)中滤液的酸碱度,其操作方法:取pH试纸于玻璃片上,___________________________________________,把试纸显示的颜色与标准比色卡比较,读出溶液的pH。(4)若测得滤液的pH为8,继续往滤液滴加稍过量的盐酸,目的是______________;蒸发该滤液以除去过量的盐酸,该操作利用的盐酸性质是________。继续蒸发滤液得到固体的过程中,用玻璃棒不断搅拌的目的是__________________________________________________。
用干燥洁净的玻璃棒蘸取待测液滴到pH试纸上
使液体受热均匀,防止液体因局部过热导致液滴飞溅
18.(2015龙岩)酸溶液和碱溶液混合会发生怎样的变化呢?某班级同学开展如图1所示相关的实验。下面是两个小组的实验记录与分析。请根据要求回答问题:(1)甲组同学往一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸(室温下),反应中溶液温度的变化记录如下:根据表中数据分析:①当加入盐酸体积为_____mL时,表明NaOH与HCl恰好完全反应。此判断的依据是_________________________________________。
中和反应放热,恰好完全反应时放出热量最多
②当加入6 mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和___________________。③教材指出:酸与碱中和反应的结果是酸和碱各自的特性都消失。图2描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是________、________。(2) 请你参与完成乙组同学的实验记录与分析。
溶液由红色逐渐变成无色
Na2CO3+2HCl === 2NaCl+H2O+CO2↑
19.(传统文化)(2019株洲)造纸是我国古代四大发明之一。早期的纸张生产中,常采用纸表面涂敷某物质的工艺,但存在副作用,该物质易导致纸张发生酸性腐蚀,使纸张变脆易破损,该物质是( )A. 烧碱 B. 明矾 C. 草木灰 D. 熟石灰20.(2019泰安)如图是物质X溶于水发生解离后的微观示意图,其中能说明X是一种酸的是( )
21.(传统文化)(2019重庆B卷)假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )A. 硫酸亚铁溶液 B. 稀盐酸C. 浓硝酸和浓盐酸的混合物 D. 稀硫酸22.(2018枣庄)人若长期食用“镉大米”(镉含量超标)会引起痛痛病。研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),下列物质中可用于改良土壤结构,降低水稻对镉吸收率的是( )
A. 氯化钾B. 烧碱C. 熟石灰D. 硫酸亚铁(水溶液显酸性)
23.(2019常州)“化学棋”游戏规则:
①每粒棋子代表一种物质;②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉;③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子是( )
24.(数字化实验)(2019黄石)在蒸馏水中加入NaOH颗粒、不断搅拌,用温度传感器记录溶解过程的温度变化,如图a、c两点观察到溶液中有固体存在,b点固体完全消失。下列说法不正确的是( )
A. NaOH固体溶于水是放热过程B. a、c两点时,NaOH的溶解度相同C. b点时,该溶液一定为饱和溶液D. c点时的溶剂质量等于d点时的溶剂质量
25.(2019山西)合理选择清洁用品,可以营造整洁、卫生的厨房环境。以下是三种去污用品的相关信息。
(1)它们的用途与______紧密相关。(2)洗手时,不慎误用了油烟机清洗剂,会导致的不良后果是_____________。 (3)洗碗清洁剂去除油污时的现象属于__________。
26.(2019广州)氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是___________________________。(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是__________________________,发生反应的化学方程式是___________________________________。(3)画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注(水分子不用画出)。
用石蕊染成紫色的纸条变红
27.(数字化实验)(2019常州)中和反应是一类重要的化学反应。某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
相关课件
这是一份2022版中考化学大一轮培优训练及课件专题四 常见的溶液课件,共29页。PPT课件主要包含了常见的溶液,NH4NO3,不饱和溶液,饱和溶液,蒸发溶剂,降低温度,固体溶解度,溶解度,影响因素,气体溶解度等内容,欢迎下载使用。
这是一份2022版中考化学大一轮培优训练及课件微专题1 气体的制取课件,共44页。PPT课件主要包含了发生装置及原理,反应物状态,反应条件,A固体加热型,B固液常温型,化学性质,可以控制反应速率,收集装置,移出导管,熄灭酒精灯等内容,欢迎下载使用。
这是一份2022版中考化学大一轮培优训练及课件专题十四 化学与能源和资源的利用 44PPT课件,共44页。PPT课件主要包含了三者缺一不可,氧气或O2,可燃物,氧气或空气,最低温度,着火点,原理及方法,破坏燃烧条之一即可,有关图标,生活中的安全常识等内容,欢迎下载使用。








