




第5讲 中考化学流程图题-备战2022年中考化学二轮复习热点难点专题精品课件
展开考点1 回收利用型流程图题
考点2 物质制备型流程图题
考点3 分离除杂型流程图题
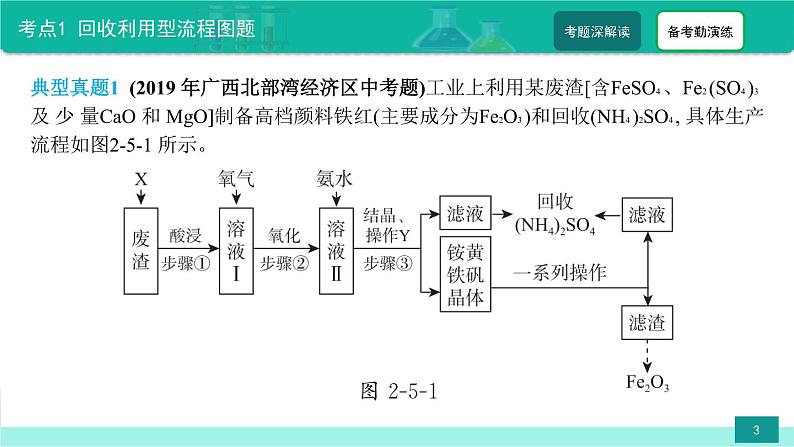
典型真题1 (2019 年广西北部湾经济区中考题)工业上利用某废渣[含FeSO4 、Fe2 (SO4 )3 及 少 量CaO 和 MgO]制备高档颜料铁红(主要成分为Fe2O3 )和回收(NH4 )2SO4 , 具体生产流程如图2-5-1 所示。
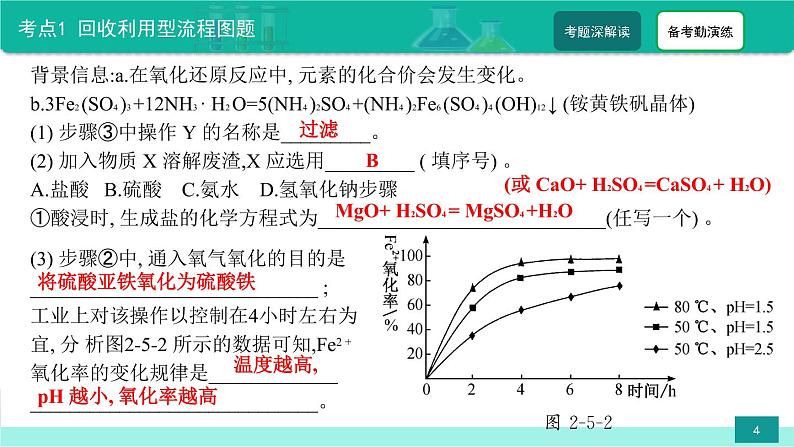
背景信息:a.在氧化还原反应中, 元素的化合价会发生变化。 b.3Fe2 (SO4 )3 +12NH3 · H2 O=5(NH4 )2SO4 +(NH4 )2Fe6 (SO4 )4 (OH)12 ↓ (铵黄铁矾晶体) (1) 步骤③中操作 Y 的名称是_________。 (2) 加入物质 X 溶解废渣,X 应选用_________ ( 填序号) 。 A.盐酸 B.硫酸 C.氨水 D.氢氧化钠步骤①酸浸时, 生成盐的化学方程式为_____________________________(任写一个) 。
(3) 步骤②中, 通入氧气氧化的目的是_____________________________ ; 工业上对该操作以控制在4小时左右为宜, 分 析图2-5-2 所示的数据可知,Fe2 + 氧化率的变化规律是__________________________________________。
(或 CaO+ H2SO4 =CaSO4 + H2O)
将硫酸亚铁氧化为硫酸铁
pH 越小, 氧化率越高
MgO+ H2SO4 = MgSO4 +H2O
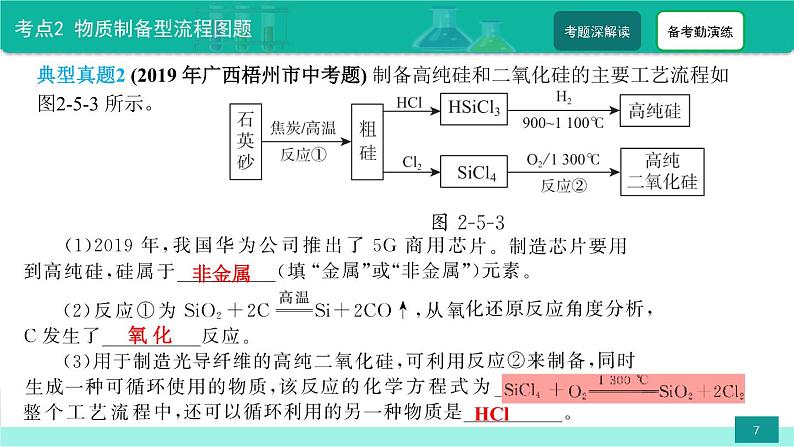
典型真题3 (2018 年广西北部湾经济区中考题)碳酸钡是一种重要的化工产品。某厂用含杂质二氧化硅的碳 酸钡做原料生产碳酸钡,其工艺流程如图2-5-4 所示。
(1) 为节约成本, 流程中的生成物可直接应用于生产流程的是____________; 加入过量的盐酸的目的是______________________________________________。
(2) 向氯化钡溶液中加入过量的氢氧化钾并通入二氧化碳, 其中生成碳酸钡的化学方程式是_________________________________________。 (3) 溶液 A 中溶质成分的可能组合有_____________________________________。 (4) 操作3 包括的两个操作是____________________。
BaCl2 + 2KOH + CO2 =BaCO3 ↓ +2KCl + H2 O
KOH、KCl; KOH、KCl、K2CO3 ;KOH、KCl、BaCl2
向原料中加入稀盐酸, 碳酸钡与稀盐酸反应生成的二氧化碳和氯化钡, 二氧化碳可直接应用于与过量的氢氧化钾、 氯化钡溶液反应生成碳酸钡沉淀; 向原料中加过量盐酸的目的是使碳酸钡完全反应而溶解。 向氯化钡溶液中加入过量的氢氧化钾, 氢氧化钾首先与前面流程中加入的过量盐酸反应, 然后与通入的二氧化碳反应生成碳酸钾和水,碳酸钾 再 和 氯 化 钡 发 生 反 应, 总 反 应 为 BaCl2 +2KOH+CO2 =BaCO3 ↓ +2KCl + H2 O, 所以反应后的溶液 A 的溶质成分有以下几种情况: ① 若二氧化碳、 氢氧化钾反应生成的碳酸钾恰好与溶液中的氯化钡完全反应, 则溶液 A 的溶质是 KOH 、KCl;②若二氧化碳、 氢氧化钾反应生成的碳酸钾与溶液中的氯化钡反应后还有剩余, 则溶液 A 的溶质 是KOH 、KCl、K2CO3 ; ③ 若通入的二氧化碳不足, 生成的碳酸钾不足以将溶液中的氯化钡反应完, 此时溶液中的溶质为 KOH、KCl、BaCl2 。 经过操作2(过滤) 后得到固体 A 和溶液 A, 固体 A 为碳酸钡, 其表面残留有少量的溶液 A, 要先洗涤沉淀, 然后干燥得到产品。
1.(2019 年娄底, 能力提升) 某品牌平板电视显示屏生 产 过 程 中 产 生 大 量 废 玻 璃 粉 末 ( 含 SiO2 、Fe2O3 、CeO2 等物质) , 以此粉末为原料进行资源回收, 其工艺流程如图2-5-5 所示。
已知:2NaOH+SiO2 = Na2SiO3 + H2O, Na2SiO3溶于水。 (1) 第①步操作的名称是__________。 (2) 第②步中加入过量稀硫酸的目的是__________________。 (3) 洗涤滤渣 B 的目的是除去____________ (填离子符号) , 提高产品的纯度。 (4) 若第④步中加的碱为 NaOH, 写出该反应的化学方程式: _______________________________________。
Ce2 (SO4 )3 +6NaOH=2Ce(OH)3 ↓+3Na2SO4
2.(2019 年江西, 能力提升)2020 年奥运会奖牌制作原料来自电子垃圾中提炼出来的金属。 从废线路板中提炼贵金属和制备硫酸铜晶体的一种工艺流程如图2-5-6 所示。
已知: 在酸性环境且有过氧化氢存在时, 铁和铜分别会转化为铁离子和铜离子。 (1) 操作①的名称是___________。 (2 ) 提炼出的贵金属可制作奖牌, 其成分是____________。 (3) 调节pH 的主要目的是除去滤液中的___________(填金属离子符号) 。 (4) 写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式:_________________________________。
Al3+ 和Fe3+
Cu+H2O2 +H2 SO4 = CuSO4 +2H2 O
3.(2019 年贺州, 能力提升) 利用含氧化铜和氧化锌的工业废料, 经过处理后可得到铜和七水硫酸锌(ZnSO4 · 7H2O) 晶体, 主要流程如图2-5-7 所示。
(1) 步骤①中, 加入的过量物质 A 是__________(填化学式) 。 (2) 步骤②中, 加入过量物质 C 的目的是_________________________(用化学方程式表示) 。(3) 步骤③的操作是___________。 (4) 步骤④ 中的操作是蒸发浓缩 、___________、过滤。
Zn+CuSO4 =Cu+ZnSO4
4.(2019 年柳州, 能力提升) 硝酸是一种重要的化工原料, 工业上常用“氨的催化氧化”制取硝酸, 工艺流程如图2-5-8 所示。
请回答下列问题: (1) 氨气是一种极易溶于水的气体, 氨的水溶液呈 ____(填“酸” “碱” 或“中”) 性, 氨气与盐酸反应的化学方程式是________________________________。 (2) 完成 NO2 转化为硝酸的化学方程式:3NO2 +________=2HNO3 +NO。 生成的 NO 是一种会对空气造成污染的气体, 工业上要将它回收利用。上述流程中还有一种物质也可以重复利用, 这种物质是_________________。 (3) 金属与浓硝酸反应生成的气体是 NO2 , 随着反应的进行, 当浓硝酸变为稀硝酸时, 生成的气体变成了 NO。现有24 g 镁与溶质质量为189 g 的浓硝酸 恰 好 完 全 反应, 则反应后溶液中溶 质的质量为 _____g, 生成气体的总质量为 ______g。
NH3 + HCl = NH4 Cl
5.(2019 年遵义, 能力提升) 海洋是人类宝贵的自然资源, 海水“制盐”体现了人类利用化学科学征服和改造自然的智慧。 通过晾晒海水, 可以得到粗盐, 粗盐中含有不溶性杂质( 如泥沙等) 和可溶性杂质(如 MgCl2 、CaCl2 等) , 工业上以粗盐为原料制取精盐, 其生产流程如图2-5-9 所示。
请回答下列问题: (1) 操作b 中玻璃棒的作用是__________。 (2) 加入 Na2CO3 溶液除去的离子是________(填离子符号) , 加入 NaOH 溶液发生反应的化学方程式为______________________________________。 (3) 滤液中溶质的主要成分是______________(填化学式) , 加入足量稀盐酸的目的是__________________________________________。 (4) 如果称量Ⅰ 中称得粗盐的质量为3 g, 称量Ⅱ 中称得精盐的质量为3.1 g, 那么下列分析正确的是___________(填序号) 。A.精盐的产率为103.3% B.蒸发中可能有水分没有蒸干 C.除杂过程中有 NaCl 生成
????????????????????????
MgCl2 +2NaOH =2NaCl +Mg(OH)2 ↓
除去除杂过程中加入的过量氢氧化钠和碳酸钠
6.(2019 年威海, 能力提升) 工业生产的氯化钾中含有少量杂质硫酸镁, 不能满足科研的需要, 在实验室提纯氯化钾的过程如图2-5-10 所示。
(1) 提纯过程所用试剂 X、Y 分别是_______、________(填溶质的化学式) , 所加试剂均稍过量的目的是____________________________________。 (2) 写出提纯过程中发生的一个反应的化学方程式:_______________________________________________________________________________________________________________________________________。 (3) 步骤Ⅲ 中, 实际参加反应的离子有________和________ (写符号) 。
把要除去的杂质全部除去
MgSO4 +Ba(OH)2 =BaSO4 ↓+ Mg (OH )2 ↓
[ 或 Ba (OH )2 + K2 CO3 =BaCO3 ↓ +2KOH、 K2 CO3 +2HCl =2KCl + H2 O +CO2 ↑ 、
KOH+HCl=KCl+H2O]
1.从大理石(主要杂质是氧化铁) 中提纯酸钙的一种实验流程如图2-5-11 所示。
(1) 红褐色沉淀的化学式是___________ 。 (2) 反应池Ⅰ 中用硝酸而不用稀硫酸的主要原因是__________________________________________________________________。 (3) 反应池Ⅱ 中加入过量氨水的目的是_______________________________________。 (4) 反 应 池 Ⅲ 中 , 生成碳酸钙的化学方程式是___________________________________。 (5 ) 过滤 B 中所得滤液在农业生产中的一种用途是______________。
硫酸和碳酸钙反应生成的硫酸钙是
微溶性物质, 反应不能进行完全
中和过量的硝酸, 并使铁离子完全沉淀
Ca(NO3 )2 +(NH4 )2CO3 =2NH4 NO3 +CaCO3 ↓
2.工业上可以用食盐和石灰石做原料制取纯碱(Na2 CO3 ) , 生 产 的 关 键 是 在 沉 淀 池 中 让 NaCl、NH3 、CO2 和 H2O 尽可能多地转化成 NaHCO3 (固体沉淀物)和 NH4Cl(溶液) , 主要生产流程如图2-5-12所示。
(1) 纯碱属于_________( 填“氧化物” “ 酸” “ 碱” 或“盐”) 。 (2) 若在实验室, 分离设备( Ⅰ ) 中的混合物用到的操作的名称是_______, 母液为 NaHCO3的______(填“饱和”或“不饱和”) 溶液。 (3) 在设备( Ⅱ ) 中, 固体 A 与水反应的化学方程式是____________________,该反应属于_______(填写基本反应类型) 反应。 (4) 对设备( Ⅱ ) 中的母液进行处理后, 除水以外可在本流程中再利用的物质有________________(写化学式) 。
H2O+CaO = Ca (OH )2
3.钛和钛合金被认为是21 世纪的重要金属材料, 它们具有很多优良的性能, 如熔点高, 密度小, 可塑性好等。 以钛铁矿( 主要成分为 FeTiO3 , 同时含有少量的 Fe2 O3 、FeO 等) 为 原 料 制 取 TiO2 , 再 由TiO2 制取金属 Ti 的工艺流程如图2-5-13 所示。
【查阅资料】钛、 镁在高温下能与空气中的氧气、二氧化碳等发生反应。 (1) 写出工艺流程中生成硫酸铁的化学方程式:_____________________________ ,该反应的基本类型是________反应。 (2) 操作2 的名称是_________。 (3) 工艺流程中的水解属于_______变化。 (4) 工业上常在高温和氩气氛围中, 用金属镁和TiCl4 反应制备 Ti, 氩气的作用是______________________________。 (5)TiO2 可与焦炭、 氯气在高温下反应, 该反应中, 氯气和碳按71 ∶ 12 的质量比参加反应, 反应的化学方程式为________________________________________。
Fe2O3 +3H2SO4 =Fe2 (SO4 )3 +3H2 O
防止钛、镁在高温时被氧化
第5讲 中考化学流程图题-备战2023年中考化学热点难点专题精品课件: 这是一份第5讲 中考化学流程图题-备战2023年中考化学热点难点专题精品课件,共28页。PPT课件主要包含了考题深解读,温度越高,非金属,HCl,二氧化碳,备考勤演练,◆中考题汇◆,使氧化铁充分反应,Fe3+,降温结晶等内容,欢迎下载使用。
第4讲 中考化学坐标曲线题-备战2023年中考化学热点难点专题精品课件: 这是一份第4讲 中考化学坐标曲线题-备战2023年中考化学热点难点专题精品课件,共36页。PPT课件主要包含了考点2溶解度曲线,考题深解读,备考勤演练,◆中考题汇◆,不饱和,◆模拟题汇◆等内容,欢迎下载使用。
第7讲 中考化学探究题-备战2023年中考化学热点难点专题精品课件: 这是一份第7讲 中考化学探究题-备战2023年中考化学热点难点专题精品课件,共60页。PPT课件主要包含了考题深解读,含有镁粉和炭粉,小苏打,产生白色沉淀,碳酸钠和氢氧化钠,漏斗烧杯,氯化钾KCl,反应也生成白色沉淀,稀盐酸,产生大量气泡等内容,欢迎下载使用。












