





新教材高考化学总复习专题二化学物质及其变化第3讲氧化还原反应课件
展开
这是一份新教材高考化学总复习专题二化学物质及其变化第3讲氧化还原反应课件,共60页。
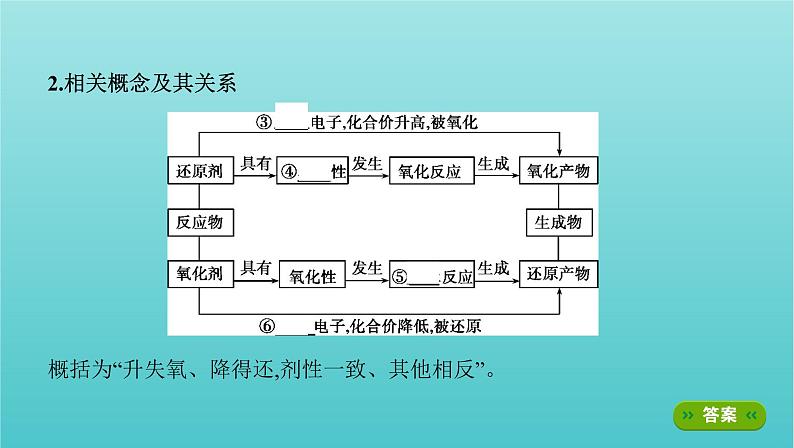
2.相关概念及其关系 概括为“升失氧、降得还,剂性一致、其他相反”。
思考1 反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中氧化剂和还原剂分别是哪种物质?该反应中的氧化产物是什么?生成1 ml Cl2时转移电子数目为
多少?
3.电子转移的表示方法(1)双线桥法:①标变价,②画箭头,③算数目,④说变化。
思考2 用双线桥法标出铜和浓硝酸反应时电子转移的方向和数目。 (2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数
目,不标“得到”或“失去”字样。
思考3 用单线桥法标出铜和稀硝酸反应时电子转移的方向和数目。
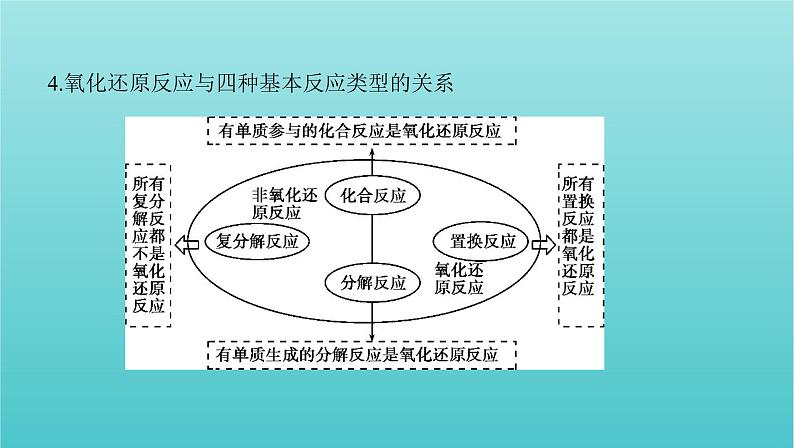
4.氧化还原反应与四种基本反应类型的关系
思考4 下面是氧化还原反应与四种基本反应类型间的关系图,请完成填空。 (1)一定属于氧化还原反应的是 置换 反应。(2)一定不属于氧化还原反应的是 复分解 反应。(3)有单质参加的化合反应或有单质生成的分解反应 一定 (填“一定”或“不一定”)属于氧化还原反应。
5.常见的氧化剂、还原剂(1)常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物
等。如:
(2)常见还原剂常见还原剂包括活泼的金属单质、非金属离子及低价态化合物、低价金属阳离子、非金属单质及其氢化物等。如:
(3)具有中间价态的物质既有氧化性,又有还原性
思考5 盐酸能发生下列反应:①Zn+2HCl ZnCl2+H2↑,②2HCl+CuO CuCl2+H2O,③MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,结合化学方程式分析,盐酸具有的性质有哪些?
提示 有酸性、氧化性和还原性。
1.易错易混辨析(正确的画“√”,错误的画“✕”)(1)非金属阴离子只具有还原性,金属阳离子只具有氧化性 ( )(2)有单质参加或有单质生成的化学反应一定是氧化还原反应 ( )(3)元素由化合态变成游离态时,可能被氧化,也可能被还原 ( )(4)金属单质只有还原性,非金属单质只有氧化性 ( )(5)因SO2具有氧化性,故可用于漂白纸浆 ( )(6)在反应2CuFeS2+O2 Cu2S+2FeS+SO2中,SO2既是氧化产物,又是还原产物 ( )
(7)Al原子比Na原子最外层电子数多,故还原性:Al>Na ( )(8)1 ml Cl2参加反应时一定得到2 ml电子 ( )(9)氯酸钾受热分解用双线桥法表示电子转移的方向和数目如下:
( )(10)氨的催化氧化用单线桥法表示电子转移如下: ( )
2.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于
阴影3区域的是 ( )A.Cl2+2NaI 2NaCl+I2B.NH4HCO3 NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O 4Fe(OH)3D.Fe2O3+3CO 2Fe+3CO2
3.下列关于氧化剂与还原剂的判断正确的是 ( )A.反应CH4+2O2 CO2+2H2O中,O2是氧化剂,CH4是还原剂B.反应Cl2+2NaOH NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂C.反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂D.反应2Na+2H2O 2NaOH+H2↑中,H2O既是氧化剂又是还原剂
4.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O
和一种未知物质X。(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 AsH3 。(2)已知2 ml KBrO3在反应中得到10 ml电子生成X,则X的化学式为 Br2 。(3)根据上述反应可推知 ac 。a.氧化性:KBrO3>H3AsO4b.氧化性:H3AsO4>KBrO3c.还原性:AsH3>Xd.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的化学计量数填入下列方框中,并
标出电子转移的方向和数目(用单线桥):
解析 (1)KBrO3在反应中得到电子,则另外一种化合价变化的元素的原子在
反应中失去电子被氧化,所给物质中砷元素化合价发生了变化,故低价态的
AsH3是还原剂。(2)2 ml KBrO3在反应中得到10 ml电子,说明溴元素在反应中降低了5价,所
以X的化学式为Br2。
考点一 氧化还原反应的理解和分析题组一 氧化还原反应的理解
1.高铁酸钾(K2FeO4)作净水剂,既能消毒杀菌,也能吸附水中悬浮物。K2FeO4
制备方法如下:Fe2O3+4KOH+3KClO 2K2FeO4+3KCl+2H2O。下列说法正确的是 ( )A.Fe2O3作还原剂B.KClO发生氧化反应C.反应后K元素化合价升高D.KClO失去电子
解析 反应中,Fe2O3中Fe元素的化合价由+3价升高为+6价,被氧化,Fe2O3
为还原剂,故A正确;反应中,KClO中Cl元素的化合价由+1价降低为-1价,被还
原,KClO为氧化剂,发生还原反应,故B错误;反应中,K元素化合价没有发生变
化,故C错误;反应中,KClO中Cl元素的化合价由+1价降低为-1价,得到电子,故
D错误。
2.(2020安徽全国示范高中名校联考)LiFePO4电池可用于电动汽车。已知:电
池放电时,电池反应为FePO4+Li LiFePO4。下列说法正确的是 ( )A.Li是氧化剂B.FePO4中磷元素被还原C.氧化产物和还原产物的质量之比为1∶1D.每消耗1 ml FePO4必有2 ml电子转移
解析 在反应FePO4+Li LiFePO4中,Li元素化合价升高,失电子,被氧化,Li是还原剂,FePO4中Fe元素化合价降低,FePO4作氧化剂,A项错误;FePO4中
P元素化合价没有变化,B项错误;LiFePO4既是氧化产物,又是还原产物,氧化
产物和还原产物的质量之比为1∶1,C项正确;Fe元素化合价由+3价降低到+2
价,则每消耗1 ml FePO4必有1 ml电子转移,D项错误。
1.氧化还原反应概念的“两大误区”(1)某元素由化合态变为游离态时,误认为元素只能被还原。(2)误认为反应中若有一种元素被氧化,则一定有另一种元素被还原。
2.破除氧化(还原)剂认识模型定式(1)在氧化还原反应中,非金属单质不一定只作氧化剂。如C+H2O(g) H2+CO中,C是还原剂,H2是还原产物。(2)氧化还原反应中的反应物不一定都是氧化剂或还原剂,有的反应物可能既
不是氧化剂也不是还原剂。如Cl2+H2O HCl+HClO中,H2O既不是氧化剂,也不是还原剂。
题组二 氧化还原反应的分析3.(2020浙江7月选考,10,2分)反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,氧化产物与还原产物的物质的量之比是 ( )A.1∶2 B.1∶1 C.2∶1 D.4∶1
4.下列化学反应中电子转移的表示方法正确的是 ( )A. B. C.
解析 B A项,SiO2中的Si得电子,C失电子;C项,Zn失电子;D项,箭头应指向H2SO4中的S元素。
1.双线桥表示方法
2.单线桥表示方法:
考点二 氧化还原反应的“三大”基本规律及其应用
1.氧化还原反应规律(1)价态规律①元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间
价态,既有氧化性又有还原性。如Fe3+、Cu2+只有氧化性,S2-、I-只有还原性,Cl2、Fe2+既有氧化性又有还原性。②价态归中规律不同价态的同种元素间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价 中间价”。而不会出现交叉现象。简记为“两相靠,不相交”。
如在反应KClO3+6HCl KCl+3Cl2↑+3H2O中,氧化产物是Cl2,还原产物也是Cl2,1 ml KClO3反应时转移电子数是5NA。③歧化反应规律“中间价 高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如Cl2+2NaOH NaCl+NaClO+H2O。1 ml Cl2反应时转移电子数为NA。(2)强弱规律①自发进行的氧化还原反应,一般遵循强氧化剂制弱氧化剂,强还原剂制弱还
原剂,即“由强制弱”。如根据反应Cl2+S2- S↓+2Cl-,可以确定氧化性:
Cl 2>S,还原性:S2->Cl-。②先后规律a.同时含有几种还原剂时,加入氧化剂,将按照还原性由强到弱的顺序依次反
应。如:在FeBr2溶液中通入少量Cl2时,因为还原性:Fe2+>Br-,所以Cl2先与Fe2+反
应。b.同时含有几种氧化剂时,加入还原剂,将按照氧化性由强到弱的顺序依次反
应。如在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所
以铁粉先与Fe3+反应。
(3)守恒规律氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。化合价有升必
有降,升高总数值等于降低总数值。守恒规律是氧化还原反应方程式配平与
计算问题的主要依据。
2.氧化性、还原性强弱的判断氧化性、还原性的强弱主要取决于物质得失电子的难易程度,与得失电子的
数目无关。可依据以下几个方面设计成实验判断:(1)依据反应原理氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。(2)两种物质直接反应如S+O2 SO2,氧化性:O2>S。(3)使比较对象与同一试剂反应a.一种物质反应,另一种物质不反应。如Na与冷水反应,Mg不能,还原性:Na>Mg。
b.反应的难易。如F2在黑暗条件下能与H2反应,Cl2与H2反应需光照或点燃,氧
化性:F2>Cl2。c.两种物质都反应,但反应的剧烈程度不同。如Na与水反应没有K与水反应
剧烈,还原性:K>Na。d.同一条件下,生成产物不同。如Fe+S FeS,2Fe+3Cl2 2FeCl3,氧化性:Cl2>S。(4)依据电化学原理原电池中,负极物质的还原性一般强于正极物质;用惰性电极电解混合溶液
时,在阴极先放电的阳离子的氧化性强,在阳极先放电的阴离子的还原性强。(5)某些氧化剂的氧化性或还原剂的还原性与反应的条件有关①温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。②浓度:如浓硝酸的氧化性比稀硝酸的氧化性强。③酸碱性:如KMnO4溶液的氧化性随溶液酸性的增强而增强。
例 已知强弱顺序:还原性I->Fe2+>Br->Cl-,氧化性Cl2>Br2>Fe3+>I2,下列反应的
化学方程式或叙述不成立的是 ( )A.Br2+2HI I2+2HBrB.2FeCl2+Cl2 2FeCl3C.2FeCl2+2HCl+I2 2FeCl3+2HID.Cl2通入NaBr和NaI的混合溶液中,I-先被氧化
解析 根据Br2+2HI I2+2HBr可知氧化性Br2>I2,符合题干已知条件,所以化学方程式成立,故A不选;根据2FeCl2+Cl2 2FeCl3可知氧化性Cl2>Fe3+,符合题干已知条件,所以化学方程式成立,故B不选;根据2FeCl2+2HCl+I2 2FeCl3+2HI可知氧化性I2>Fe3+,与题干已知条件矛盾,所以化学方程式不成立,
故C选;还原性:I->Br-,氧化剂氯气先氧化还原性强的离子,即优先氧化I-,叙述
成立,故D不选。
方法技巧假设法判断氧化还原反应能否进行已知物质的氧化性或者还原性的强弱关系,判断某一氧化还原反应能否发生
时可采用假设法。①先假设反应成立。②然后根据氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性的规律,列出假设反应中的上述关系。③结合题干条件判断该结论是否符合事实。符合事实,则反应成立;反之,则
不成立。
1.(2021宁夏青铜峡高级中学月考)已知反应:①Cl2+2KBr 2KCl+Br2;②KClO3+6HCl 3Cl2↑+KCl+3H2O;③2KBrO3+Cl2 Br2+2KClO3。下列说法正确的是 ( )A.上述三个反应都有单质生成,所以都是置换反应B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2C.反应②中还原剂与氧化剂的物质的量之比为6∶1D.若反应③中1 ml还原剂参加反应,则氧化剂得到电子的物质的量为2 ml
解析 反应②的反应物中没有单质,且生成物有3种,不是置换反应,故A
项错误。①Cl2+2KBr 2KCl+Br2中氧化剂是Cl2,氧化产物是Br2,所以Cl2的氧化性大于Br2;②KClO3+6HCl 3Cl2↑+KCl+3H2O中氧化剂是KClO3,氧化产物是Cl2,所以KClO3的氧化性大于Cl2;③2KBrO3+Cl2 Br2+2KClO3中氧化剂是KBrO3,氧化产物是KClO3,所以KBrO3的氧化性大于KClO3,故氧化性
由强到弱的顺序是KBrO3>KClO3>Cl2>Br2,故B项正确。②KClO3+6HCl 3Cl2↑+KCl+3H2O中氧化剂是氯酸钾,被氧化的HCl占参加反应的HCl的 ,所以还原剂和氧化剂的物质的量之比是5∶1,故C项错误。反应③中还原剂是
氯气,氧化剂是溴酸钾,该反应中1 ml还原剂参加反应,则氧化剂得到电子的
物质的量为2×(5-0)ml=10 ml,故D项错误。
2.(不定项)(2021福建龙岩上杭第一中学月考)向盛有KMnO4溶液的试管中加
入过量的MnSO4溶液,产生黑色沉淀,溶液由紫红色变为无色;过滤,向滤液中
加入少量的铋酸钠(NaBiO3)粉末,溶液又变为紫红色。下列推断错误的是( )A.氧化性:NaBiO3>KMnO4>MnO2B.生成8.7 g黑色沉淀,转移0.2 ml电子C.利用NaBiO3可以检验溶液中的Mn2+D.NaBiO3不能与浓盐酸发生反应生成氯气
解析 氧化还原反应中,氧化性:氧化剂大于氧化产物;氧化剂发生还原
反应化合价降低。在盛有KMnO4溶液的试管中加入过量的MnSO4溶液,产生
黑色沉淀,溶液由紫红色变为无色,说明KMnO4溶液可氧化MnSO4生成MnO2,
故氧化性:KMnO4>MnO2,在滤液中加入少量的铋酸钠粉末(NaBiO3),溶液变为
紫红色,说明NaBiO3可氧化MnSO4生成KMnO4,氧化性:NaBiO3>KMnO4,则氧
化性:NaBiO3>KMnO4>MnO2,故A正确;在盛有KMnO4溶液的试管中加入过量
的MnSO4溶液,产生黑色沉淀,离子方程式为2Mn +3Mn2++2H2O 5MnO2↓+4H+,生成5 ml MnO2时转移电子6 ml,所以生成8.7 g黑色沉淀,即 =0.1 ml MnO2,转移 ml=0.12 ml电子,故B错误;NaBiO3可将MnSO4氧化生成
KMnO4,溶液变为紫红色,所以利用NaBiO3可以检验溶液中的Mn2+,故C正确;因为实验室用二氧化锰与浓盐酸反应制氯气,说明氧化性:MnO2>Cl2,又氧化性:NaBiO3>MnO2,故NaBiO3可与浓盐酸发生反应生成Cl2,故D错误。
考点三 氧化还原反应方程式的书写、配平与相关计算
1.氧化还原反应方程式的配平方法(1)配平原则
(2)配平方法配平下列反应的化学方程式:MnO(OH)2+I-+H+ Mn2++I2+H2O
2.信息氧化还原反应方程式的书写一定条件下,向硫酸亚铁溶液中滴加碱性NaBH4溶液,溶液中B (B元素化合价为+3价)与Fe2+反应生成纳米Fe、H2和[B(OH)4]-,反应的离子方程式书写方
法和步骤如下:
3.计算(1)应用得失电子守恒解题的一般步骤
(2)多步连续氧化还原反应的有关计算题目涉及氧化还原反应较多,数量关系较为复杂,用常规方法求解比较困难,
只要中间各步反应过程中没有电子损耗,则可抓住起始反应物与最终产物,略
去中间过程,建立两者间的得失电子守恒关系,快速求解。
例1 某强氧化剂XO(OH 被Na2SO3还原。如果还原2.4×10-3 ml XO(OH ,需用30 mL 0.2 ml·L-1的Na2SO3溶液,那么X元素被还原后的价态是 ( )A.+2 B.+1 C.0 D.-1
例2 完成并配平下列反应的离子方程式: 2 Ce3++ 1 H2O2+ 6 H2O
→ 2 Ce(OH)4↓+ 6H+ 。
方法技巧信息类方程式的“缺项”配平对于化学方程式,所缺物质往往是酸、碱或水。
题组训练题组一 氧化还原反应的配平
1.(2021贵州铜仁思南中学第二次月考)NaNO2是一种食品添加剂,它能致癌。
酸性KMnO4溶液与NaNO2反应的化学方程式为Mn +N + Mn2++N +H2O。下列叙述中正确的是 ( )A.该反应中N 被还原B.反应过程中溶液的pH减小C.生成1 ml NaNO3需消耗0.4 ml KMnO4D. 中的粒子是OH-
解析 N 中N元素的化合价由+3价升至+5价,N 被氧化,Mn 中Mn元素的化合价由+7价降至+2价,根据得失电子守恒和原子守恒可知反应的离子
方程式为2Mn +5N +6H+ 2Mn2++5N +3H2O,反应过程中酸性减弱,溶液的pH增大,生成1 ml硝酸钠需消耗0.4 ml高锰酸钾,方框中粒子是H+。
2.(2021山东德州齐河实验中学月考)把图b的碎纸片补充到图a中,可得到一
个完整的离子方程式。下列有关该离子方程式的说法正确的是 ( ) A.配平后的化学计量数依次为3、1、2、6、3B.若有1 ml S被氧化,则生成2 ml S2-C.氧化剂与还原剂的物质的量之比为1∶2D.2 ml S参加反应有3 ml电子发生转移
解析 配平后的离子方程式为3S+6OH- 2S2-+S +3H2O,A项错误;有1 ml S被氧化时,生成2 ml S2-,B项正确;氧化剂与还原剂的物质的量之比为
2∶1,C项错误;3 ml S参加反应有4 ml电子发生转移,则2 ml S参加反应有 ml电子发生转移,D项错误。
题组二 氧化还原反应的计算3.在一定条件下PbO2与Cr3+反应,产物是Cr2 和Pb2+,则与1.0 ml Cr3+反应所需PbO2的物质的量为 ( )A.3.0 ml B.1.5 ml C.1.0 ml ml
解析 已知Pb由+4价变为+2价,Cr由+3价变为+6价,设所需PbO2的物质的
量为x ml,则有1.0 ml×(6-3)=x ml×(4-2),解得x=1.5,故B正确。
4.(2020安徽蚌埠第二中学期中考试)a ml FeS与b ml FeO投入V L c ml·L-1
的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中N 的量为 ( )A.62(a+b)g B.186(a+b)gC.(cV- ) ml D.(cV- ) ml
1.(2020山东,2,2分)下列叙述不涉及氧化还原反应的是 ( )A.谷物发酵酿造食醋 B.小苏打用作食品膨松剂C.含氯消毒剂用于环境消毒 D.大气中NO2参与酸雨形成
解析 A项,谷物发酵酿造食醋过程中存在淀粉的水解和葡萄糖的氧化,
涉及氧化还原反应,错误;B项,小苏打用作食品膨松剂是利用了小苏打受热易
分解的性质,不涉及氧化还原反应,正确;C项,含氯消毒剂具有氧化性,利用其
消毒时发生氧化还原反应,错误;D项,NO2参与酸雨形成时转化为HNO3,氮元
素的化合价升高,发生了氧化还原反应,错误。
2.下列反应中,氧化剂与还原剂物质的量之比为1∶2的是 ( )A.3S+6NaOH 2Na2S+Na2SO3+3H2OB.2CH3COOH+Ca(ClO)2 2HClO+Ca(CH3COO)2C.I2+2NaClO3 2NaIO3+Cl2D.4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
解析 反应中,做氧化剂的硫生成Na2S,做还原剂的硫生成Na2SO3,则氧化
剂与还原剂物质的量之比为2∶1,A不符合题意;B项反应为非氧化还原反应,
B不符合题意;还原剂为I2,氧化剂为NaClO3,氧化剂与还原剂物质的量之比为
2∶1,C不符合题意;氧化剂为MnO2,还原剂为HCl,4 ml HCl有2 ml HCl被氧
化,所以氧化剂与还原剂物质的量之比为1∶2,D符合题意。
3.(2021全国百强名校领军考试)酸性条件下催化氧化黄铁矿(主要成分FeS2)
的物质转化关系如图所示。下列有关叙述中不正确的是 ( )A.该转化过程中FeS2做还原剂,NO起催化剂作用
解析 根据题图,FeS2与铁离子反应生成亚铁离子和硫酸根离子,亚铁离
子与一氧化氮反应生成Fe(NO)2+,Fe(NO)2+与氧气反应生成一氧化氮和铁离
子,由此构成循环,总反应为FeS2与氧气反应生成铁离子和硫酸根离子。该转
化过程中FeS2中的硫元素化合价升高,为还原剂,NO起催化剂作用,A正确;根
据题图可知,在酸性环境下,反应Ⅰ的离子方程式为14Fe3++FeS2+8H2O 15Fe2++2S +16H+,B正确;反应Ⅲ中还原剂为Fe(NO)2+,氧化剂为氧气,根据得失电子守恒可知,还原剂和氧化剂的物质的量之比为4∶1,C正确;总反应为4FeS2+15O2+2H2O 8S +4Fe3++4H+,D错误。
4.碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒
子之间有如图所示转化关系,下列推测不正确的是 ( ) A.可用淀粉-KI试纸和食醋检验加碘盐中是否含有碘元素B.足量Cl2能使湿润的淀粉-KI试纸变白的原因可能是5Cl2+I2+6H2O 2HIO3+10HClC.由图可知氧化性的强弱顺序为Cl2>I2>I
D.途径Ⅱ中若生成1 ml I2,反应中转移的电子数为10NA
相关课件
这是一份新教材高考化学总复习专题二化学物质及其变化微专题2高考中氧化还原反应方程式书写的解题策略课件,共22页。PPT课件主要包含了解答步骤等内容,欢迎下载使用。
这是一份新教材高考化学总复习专题二化学物质及其变化第2讲离子反应课件,共60页。
这是一份新教材高考化学总复习专题二化学物质及其变化第1讲物质的组成及分类课件,共45页。









