





高中化学鲁科版必修1第1章 认识化学科学第3节 化学中常用的物理量-物质的量备课课件ppt
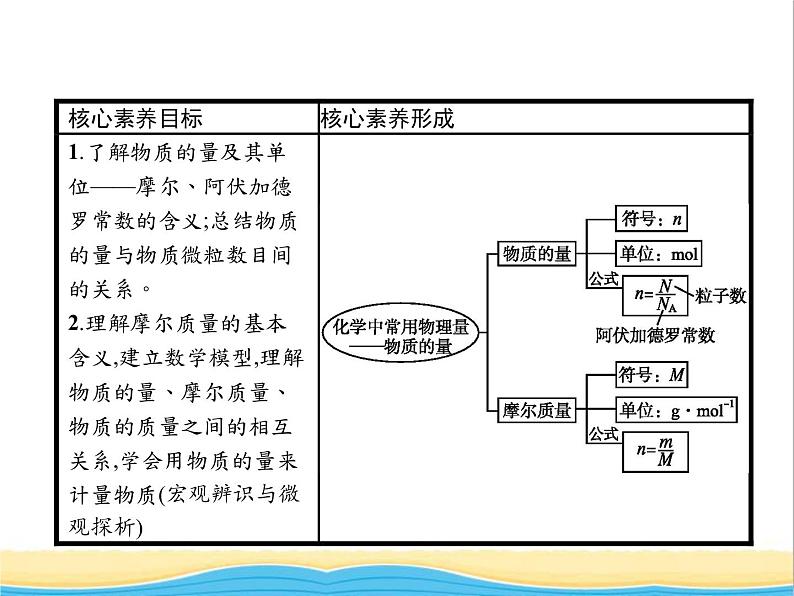
展开一、物质的量及其单位——摩尔 1.物质的量(1)含义:物质的量是一个基本物理量,通过它可以把物质的宏观量(如质量、体积)与原子、分子或离子等微观粒子的数量联系起来。(2)符号:n。(3)单位:摩尔,简称:摩,符号:ml。2.阿伏加德罗常数(1)国际上规定,1 ml任何微粒所含的微粒数与0.012 kg 12C所含碳原子数相等,0.012 kg 12C所含的碳原子数为6.02×1023,6.02×1023 ml-1称为阿伏加德罗常数。 (2)单位:ml-1,符号:NA。
3.物质的量、阿伏加德罗常数与微粒数目(N)之间的关系
二、摩尔质量1.定义单位物质的量的物质所具有的质量。2.符号M。3.单位g·ml-1或kg·ml-1。4.数值当以g·ml-1为单位时,在数值上与该粒子的相对原子质量或相对分子质量相等。5.物质的量、质量、摩尔质量三者之间的关系
1.下列对物质的量的说法正确的是( ) A.物质的量就是物质的质量B.物质的量是一种基本物理量C.物质的量就是物质所含微粒数目的多少D.物质的量是描述物质多少的单位解析:A项误认为物质的量就是物质的质量;C项中物质的量的计量对象不正确;D项误认为物质的量是一个单位;B项正确。答案:B
2.下列说法正确的是( )A.NaOH的摩尔质量为40 gB.1 ml H2的质量与氢原子的相对原子质量相等C.1 ml OH-的质量为17 g·ml-1D.氩气的摩尔质量(单位是g·ml-1)在数值上等于它的相对原子质量解析:摩尔质量的单位为g·ml-1,故A错误;1 ml H2的质量为2 g,氢原子的相对原子质量为1,二者不同,B错误;1 ml OH-的质量为17 g,C错误;氩为单原子分子,其摩尔质量以g·ml-1为单位时在数值上等于它的相对原子质量,D正确。答案:D
“物质的量”概念理解
在日常生活和工作中我们经常用到一些小物品,比如曲别针。在商店里曲别针不是按个出售的,而是按盒出售的,一盒100个。构成物质的原子、分子和离子非常微小,用数宏观物体的方式数微观粒子极其困难,也没有意义。因此科学家引入了“物质的量”这一基本物理量,来描述微观粒子集体数目的多少。(1)“物质的量”这一物理量表示的是微粒的质量还是微粒的数目?(2)物质的量的单位是什么?(3)是不是1 ml任何物质都含有阿伏加德罗常数个微粒?
探究提示(1)“物质的量”是一个专有名词,描述的是一定数目微观粒子集合体数目的多少,可反映微粒的多少。(2)物质的量的单位是“摩尔”。(3)1 ml任何物质含有的相应微粒是阿伏加德罗常数个。如1 ml氧气含有阿伏加德罗常数个氧气分子,氧原子的数目则是2×6.02×1023。
对物质的量的理解(1)物质的量是国际单位制中七个基本物理量之一,用来表示含有一定数目粒子集合体的物理量,摩尔是其单位。(2)用物质的量来描述物质的时候必须明确指出是何种微粒,如:氧气分子、氧原子,也可以用化学式表示微粒,但是不能描述为1 ml氧或1 ml氧元素。(3)物质的量只能表示微观粒子,不适用于描述宏观物质。
【例题1】下列说法正确的是 。 ①物质的量是物质的宏观量与微观粒子数量联系的桥梁。②物质的量是摩尔的单位。③1 ml氧所含的微粒个数约为6.02×1023。④摩尔是描述微观物质微粒多少的物理量。⑤3.01×1023个H2O分子的物质的量约为0.5 ml。⑥任何物质,如果它所含微粒数与12 g 12C所含的碳原子数相同,我们就说它的物质的量为1 ml。
解析:①正确,物质的量表示的是微观粒子的集合体,通过它可以把物质的宏观量(质量、体积)与微观量(分子、原子等的数量)联系起来。②错误,摩尔是物质的量的单位。③错误,“1 ml氧”没有指明具体微粒是什么。④错误,物质的量是描述微观物质微粒多少的
规律方法点拨物质的量应用的注意事项(1)“物质的量”是一个物理量,可反映微观粒子数目的多少;(2)“摩尔”是物质的量的单位,不是一个物理量,它不表示微观粒子数目的多少;(3)物质的量的考查还常与物质所含的原子数、质子数、电子数等联系,所以解答时要明确各微粒之间的关系。
跟踪训练1下列说法正确的是( )A.摩尔是国际科学界建议采用的一种物理量B.摩尔是物质的量的单位,简称摩,符号为mlC.含有6.02×1023个原子的物质中分子的物质的量为1摩尔D.1 ml氧含6.02×1023个O2解析:摩尔是物质的量这一物理量的单位,不是一种物理量;含6.02×1023个原子的物质中分子的物质的量不一定为1 ml,如含6.02×1023个O的氧气中氧分子的物质的量是0.5 ml;1 ml氧含义不明确,可以说1 ml O2含6.02×1023个O2。答案:B
物质的量、质量和微粒数目之间的关系
在科学研究和生产生活中,人们更多的用“质量”这一物理量对宏观物质的含量多少进行描述。通过“物质的量”这一桥梁,我们能够将物质的质量和所含微粒的数目联系在一起。(1)1 ml碳原子的质量是多少?1 ml氧原子的质量是多少?1 ml 铁原子的质量是多少?(2)摩尔质量的定义是“单位物质的量的物质所具有的质量”,根据上面的结论,物质的摩尔质量在以g·ml-1作为单位的时候数值是多少?(3)尝试用图示的方法将微观粒子的数目和质量建立联系。
探究提示(1)1 ml碳原子的质量是12 g,1 ml氧原子的质量是16 g,1 ml铁原子的质量是56 g。(2)摩尔质量在以g·ml-1作为单位的时候数值等于其相对原子质量或相对分子质量。
【例题2】设NA为阿伏加德罗常数的值。下列叙述中错误的是( )×1023个CH4分子的物质的量是1.5 ×1023个SO3分子所含氧原子的物质的量是4.5 mlC.3.2 g O2中含氧原子数为0.1NAD.5 ml 12C所含的质子数为1.806×1025
规律方法点拨(1)计算过程中重视各个物理量的单位:物质的量的单位是ml,摩尔质量的单位一般是g·ml-1(也有kg·ml-1),阿伏加德罗常数的单位是ml-1,微粒的数目的单位是“个”,一般省略。(2)计算中对相同的微粒才能进行计算,如计算氧气分子的物质的量,应用氧气的质量除以氧气的摩尔质量,得到氧气分子的物质的量,如直接计算氧原子的物质的量,则除以氧原子的摩尔质量。
跟踪训练2下列说法正确的是(NA为阿伏加德罗常数的值)( )A.28 g氮气含有的原子数为NAB.4 g金属钙变成钙离子时失去的电子数为0.1NAC.1 ml O2分子的质量等于1 ml氧原子的质量D.24 g O2和24 g O3所含的氧原子数目相等解析:28 g氮气含有N2分子的物质的量为1 ml,即含有2 ml氮原子,A项错误;4 g金属钙中钙原子的物质的量为0.1 ml,1个Ca到Ca2+失去2个电子,则4 g金属钙变成钙离子时失去的电子数为0.2NA,B项错误;1 ml O2的质量是32 g,1 ml氧原子的质量是16 g,C项错误。答案:D
1.下列叙述正确的是( )A.摩尔是物质量的单位,每摩尔物质含有6.02×1023个分子B.1 ml氧的质量为16 gC.0.5 ml氦约含有6.02×1023个电子D.2H既可表示2个氢原子又可表示2 ml氢原子解析:摩尔是物质的量的单位,物质的量是一个整体名词,不能把“物质的量”简写为“物质量”,A项不正确;B项中没有明确是氧原子还是氧分子,若为氧原子,1 ml的质量为16 g,B项不正确;因为1个氦原子含有2个电子,所以1 ml氦原子就有2 ml电子,0.5 ml氦原子约含电子数为0.5 ml×6.02×1023 ml-1×2=6.02×1023,C项正确;2H仅表示2个氢原子,不能表示2 ml 氢原子,D项不正确。答案:C
2.下列有关物质的量的说法中正确的是( )A.物质的量就是物质的质量B.摩尔是国际单位制的七个基本物理量之一C.H2O的摩尔质量为18 gD.阿伏加德罗常数的数值约为6.02×1023解析:物质的量是表示微观粒子集体,物质的质量表示物质的轻重,故A错误;摩尔是物质的量的单位,故B错误;H2O的摩尔质量为18 g·ml-1,故C错误;阿伏加德罗常数NA≈6.02×1023 ml-1,即阿伏加德罗常数的数值近似为6.02×1023,故D正确。答案:D
3.下列说法正确的是( )A.1 ml O2中含有6.02×1023个氧原子B.1 ml氧含有6.02×1023个氧原子C.1 ml CaCl2中含有3 ml离子D.1 ml H2O中含有6.02×1023个氢原子解析:1个氧分子由2个氧原子构成,1 ml O2中含有2×6.02×1023个氧原子,A项错误;使用物质的量要注意具体粒子,“1 ml 氧”指代不明确,B项错误;1个水分子中含有2个氢原子,1 ml H2O中含有2×6.02×1023个氢原子,D项错误。答案:C
2021学年第3节 化学中常用的物理量——物质的量示范课课件ppt: 这是一份2021学年第3节 化学中常用的物理量——物质的量示范课课件ppt,共29页。PPT课件主要包含了分点突破1,分点突破2等内容,欢迎下载使用。
必修 第一册第3节 化学中常用的物理量——物质的量教课课件ppt: 这是一份必修 第一册第3节 化学中常用的物理量——物质的量教课课件ppt,共9页。
高中化学鲁科版 (2019)必修 第一册第1章 认识化学科学第3节 化学中常用的物理量——物质的量教案配套课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第1章 认识化学科学第3节 化学中常用的物理量——物质的量教案配套课件ppt,共60页。PPT课件主要包含了概念认知·自主学习,宏观量,微观粒子,mol,物质的量,相对原子质量,相对分子质量,能力形成·合作探究,学情诊断·课堂测评等内容,欢迎下载使用。