

化学专题1 物质的分类及计量第二单元 物质的化学计量第2课时导学案及答案
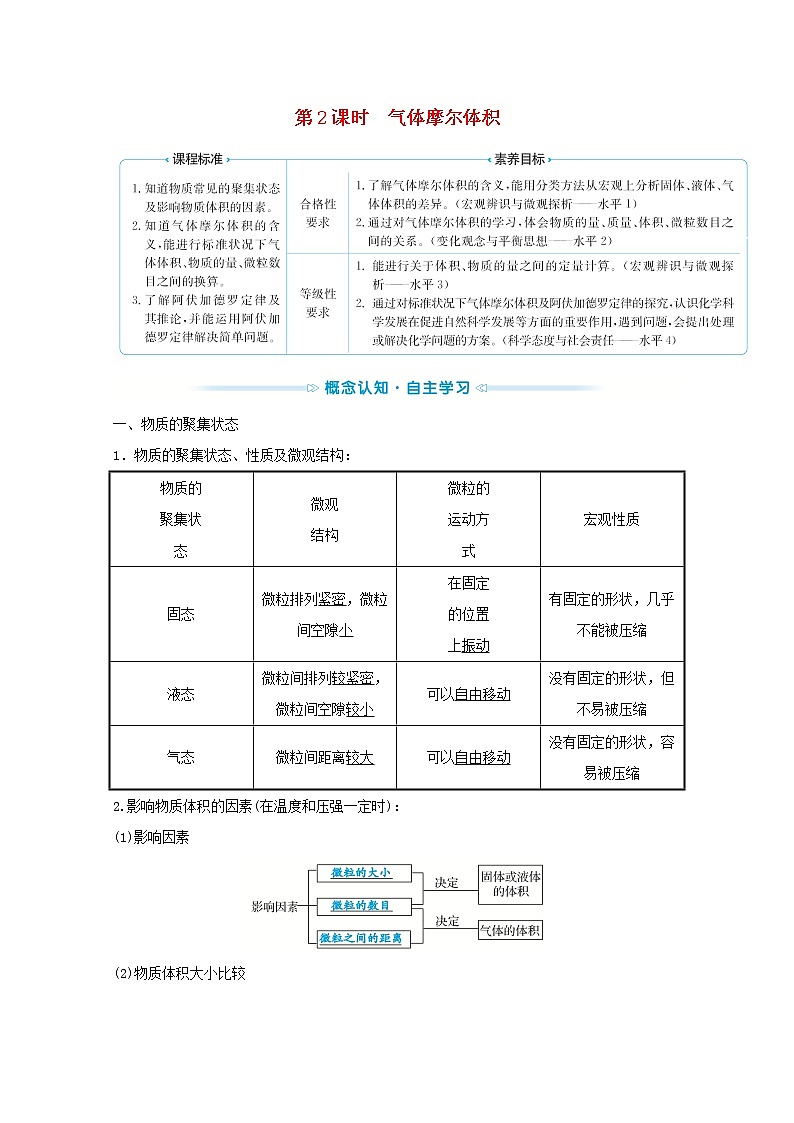
展开第2课时 气体摩尔体积
一、物质的聚集状态
1.物质的聚集状态、性质及微观结构:
物质的 聚集状 态 | 微观 结构 | 微粒的 运动方 式 | 宏观性质 |
固态 | 微粒排列紧密,微粒间空隙小 | 在固定 的位置 上振动 | 有固定的形状,几乎不能被压缩 |
液态 | 微粒间排列较紧密,微粒间空隙较小 | 可以自由移动 | 没有固定的形状,但不易被压缩 |
气态 | 微粒间距离较大 | 可以自由移动 | 没有固定的形状,容易被压缩 |
2.影响物质体积的因素(在温度和压强一定时):
(1)影响因素
(2)物质体积大小比较
(教材开发)结合教材“交流讨论”,对影响物质体积大小的因素进行分析,思考一定温度和压强下,为何1 mol 不同气体体积大致相同?
提示:
当温度、压强一定时,气体中微粒间的距离近似相等,故在温度、压强一定时,任何具有相同微粒数的气体都具有大致相同的体积。
二、气体摩尔体积
1.(知识关联)标准状况下,1 mol任何物质的体积都约是22.4 L吗?
提示:不是。物质的状态有气态、固态或液态,在标准状况下,1 mol气体的体积约为22.4 L,而1 mol固体或液体的体积均不是22.4 L。
2.气体摩尔体积适用范围是气体,是否必须为纯净气体?
提示:气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,但是以混合气体中气体之间不发生化学反应为前提。如标准状况下0.2 mol H2和0.8 mol O2的混合气体约为22.4 L。
3.(情境思考)CO2是植物光合作用的必需原料。某研究机构测定CO2含量如图所示。
则本次测定样品每立方米气体中CO2的体积是多少?
提示:44.8 L。从图示中可以得出测量是在标准状况下进行的,CO2的含量为88 g·m-3,因此含有的CO2的体积为×22.4 L·mol-1=44.8 L。
“Vm=22.4 L·mol-1”的使用条件及其应用
1.使用“Vm=22.4 L·mol-1”应注意的问题:
(1)忽视外界条件是标准状况,如常温、常压下,1 mol H2的体积不是22.4 L。
(2)忽视研究对象是气体,如标准状况下,H2O、酒精等不是气体。
(3)将1 mol气体的体积与气体摩尔体积的单位混淆,前者单位为L,后者单位为L·mol-1。
2.利用公式n===(标准状况)进行换算:
(1)气体物质的量与体积:n=。
(2)气体的摩尔质量:M=Vm·ρ=ρ标×22.4 L·mol-1。
(3)气体的分子数与体积:N=n·NA=·NA。
(4)气体质量与体积:m=n·M=·M=ρ标·V标。
(思维升华)当1 mol气体的体积为22.4 L时,能否说明该气体一定处于标准状况下?为什么?(证据推理与模型认知)
提示:不能。标准状况下,1 mol气体的体积均约为22.4 L,但1 mol气体的体积为22.4 L时,并不一定说明该气体处于标准状况下,比如适当升高温度(气体膨胀)、增大压强(压缩气体),也能使1 mol气体的体积变为22.4 L。
【合作探究】
(情境思考)足球被誉为“世界第一运动”,是全球体育界具有影响力的体育运动。足球起源于中国东周时期的齐国,当时把足球称为“蹴鞠”,汉代蹴鞠是训练士兵的手段,唐宋时期蹴鞠活动达到高潮,甚至出现了按照场上位置分工的踢法。
用打气筒给足球打气时,气体源源不断被打进去,而足球的体积却不发生很大变化。气体体积与什么因素有关?两种气体体积相同,含有的气体分子数一定相同吗?
提示:影响气体体积大小的主要因素是气体分子之间的距离,给足球打气时,足球的体积不发生很大变化是因为气体分子之间的距离在不断缩小。两种气体体积相同,含有的气体分子数不一定相同,因为气体的体积还受温度和压强的影响。
【典例】下列说法正确的是( )
A.22.4 L任何气体的物质的量均为1 mol
B.0.2 mol H2和0.8 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
C.标准状况下,1 mol任何物质的体积必定是22.4 L
D.22.4 L CO2和18 g H2O所含的分子数相等
【解题指南】解答本题需注意以下3点:
(1)使用Vm=22.4 L·mol-1计算时,必须是标准状况下。
(2)气体摩尔体积只适用于气体,不适用于固体与液体。
(3)气体摩尔体积的使用对象可以是单一气体,也可以是混合气体。
【解析】选B。没有指明标准状况,A项错误;气体摩尔体积既适用于单一气体,也可以是混合气体,只要符合物质的量为1 mol,且为标准状况下,体积就约为22.4 L,B项正确;标准状况下,1 mol任何气体的体积必定是22.4 L,C项错误;18 g H2O是1 mol H2O,但22.4 L CO2不一定是1 mol,因为其条件不确定,D项错误。
B项中,0.2 mol H2和0.8 mol CO2的体积比是多少?
提示:1∶4。相同条件下,气体的体积与物质的量成正比,V(H2)∶V( CO2)= n(H2)∶n( CO2)= 0.2 mol ∶0.8 mol =1∶4。
【规律方法】
1.使用“22.4 L·mol-1”要“三看”:
(1)看所处条件:必须为标准状况。非标准状况下,1 mol 气体的体积不一定是22.4 L。
(2)看物质状态:必须为气态。如标准状况下水、酒精、四氯化碳等为非气体物质。
(3)看数值单位:单位是L·mol-1,而不是L;数值“22.4”为近似值。
2.求气体的摩尔质量M的常用方法:
(1)根据标准状况下气体的密度ρ:M=ρ×22.4(g·mol-1)。
(2)根据气体的相对密度(D=ρ1/ρ2):M1/M2=D。
(3)根据物质的质量(m)和物质的量(n):M=m/n。
(4)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数(NA):M=NA·m/N。
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:=M1×a%+M2×b%+M3×c%……,a%、b%、c%指混合物中各成分的物质的量分数(或体积分数)。
随着人们生活水平的提高,家用轿车已成为每个家庭的常用交通工具。汽车尾气的排放会给环境带来一定的影响,汽车尾气的主要成分是CO、NO、NO2等有毒气体,因此汽车尾气是否达标是衡量汽车性能的重要指标之一。
(1)标准状况下,1 000 L汽车尾气的物质的量约为多少?
提示:n==≈44.6 mol。
(2)与4.6 g NO2中氧原子个数相等的CO气体在标准状况下的体积是多少?
提示:4.6 g NO2中氧原子的物质的量为×2=0.2 mol,因此CO的物质的量为0.2 mol,在标准状况下的体积为0.2 mol×22.4 L·mol-1=4.48 L。
阿伏加德罗定律及其推论
1.阿伏加德罗定律:
相同温度相同压强下,相同体积的任何气体都含有相同数目的粒子(分子)。
2.阿伏加德罗定律的基本推论:
推论 | 公式 |
同温同压下,气体的体积之比等于其物质的量之比 | = |
同温同体积时,气体的压强之比等于其物质的量之比 | = |
同温同压下,任何气体的密度之比等于其摩尔质量之比 | = |
1.(1)在同温、同压下1 L H2和1 L O2所含的分子数相同吗?
提示:相同。同温同压下,1 L H2和1 L O2的物质的量相同,则二者所含的分子数相同。
(2)同温同压下,相同质量的H2和O2所占的体积相同吗?其体积比是多少?
提示:不相同。其体积比为∶=16∶1。
(3)相同温度下,向相同容积的密闭容器中分别充入1 mol H2和2 mol O2,容器中H2和O2的压强比是多少?
提示:同温同容下,气体的压强比等于气体的物质的量之比,即容器中H2和O2的压强比为1∶2。
2.(思维升华)某同学在元旦晚会上表演的化学节目为猜气球——他先在实验室中用等质量的CH4、CO2、O2、SO2分别吹出四个气球,然后在晚会的现场让同学猜测气球是用哪种气体吹起的。
如果你在晚会现场,你会怎样猜出呢?
提示:等质量的CH4、CO2、O2、SO2的物质的量之比为∶∶∶,因此在相同的条件下它们的体积比为∶∶∶。因此A、B、C、D四个气球中的气体分别为SO2、CO2、O2、CH4。
【补偿训练】
(实验探究)气体体积与物质的量关系的实验探究
(1)实验观察
电解水的实验装置如图所示:
由图可知:A试管中收集到的气体是________,B试管中收集到的气体是____,二者的体积之比是________。
(2)计算推理
若有1.8 g水电解,产生氢气的质量为________g,物质的量为________mol;产生氧气的质量为________g,物质的量为________mol;二者物质的量之比为________。
(3)相关结论
①同温同压下,气体的物质的量之比等于________之比。
②同温同压下,1 mol的不同气体,其体积______。
(科学探究与创新意识)
提示:(1)氢气 氧气 2∶1 (2) 0.2 0.1 1.6
0.05 2∶1 (3)①体积 ②相同
【典例】在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
【解题指南】解答本题需要注意理解以下两个方面:
(1)正确运用阿伏加德罗定律,解题思路如下。
(2)注意两种气体的相同条件。
【解析】选D。相同体积相同密度时,两容器气体的质量相等,且都由氧元素组成,则氧原子的质量、个数以及物质的量相等,则氧原子个数相等时,气体的物质的量之比为n(O2)∶n(O3)=3∶2,由PV=nRT可知,两种气体的压强之比为3∶2,故A错误;相同体积相同密度时,两容器气体的质量相等,故B错误;氧原子个数相等时,气体的物质的量之比为n(O2)∶n(O3)=3∶2,故C错误;相同体积相同密度时,两容器气体的质量相等,且都由氧元素组成,则氧原子数目相等,故D正确。
【规律方法】使用阿伏加德罗定律的三个易错点
易错点一、适用范围:任何气体,可以是单一气体,也可以是混合气体。
易错点二、定律中的同温同压,不一定指在标准状况下;气体摩尔体积为22.4 L·mol-1只是一种特殊情况。
易错点三、定律中包含四同(同温、同压、同体积、同物质的量),只要其中有任意三个相同,则必有第四个相同,即“三同定一同”;若只有两个相同,则另外两个必定成比例,即“二同定比例”。
若将“温度与密度相等”改为“温度与压强相等”,判断B、C、D选项的正误?
提示:根据阿伏加德罗定律,O2、O3气体的分子数相等,即物质的量相等,故O3比O2质量大,所含有的氧原子数目不相等,B、C项正确,D项错误。
(2021·苏州高一检测)下列四幅图中(小白球代表的是氢原子,大黑球代表的是氦原子),最适合表示同温同压下等质量的氢气与氦气的混合气体的图示是( )
【解析】选C。氦气为单原子分子,化学式为He,排除B、D项。同温同压下,等质量的H2和He,物质的量之比为2∶1,C项正确。
三言两语话重点
(1)决定物质体积大小的因素:微粒的数目、微粒的大小及微粒间的距离。
(2)气体摩尔体积:用Vm表示,在0 ℃和101 kPa条件下,即标准状况下,Vm=22.4 L·mol-1。
(3)V、Vm、n之间的关系:V=n·Vm。
(4)阿伏加德罗定律:在温度、压强一定时,任何具有相同微粒数的气体都具有相同的体积。
1.(2021·盐城高一检测)同温同压下,两种气体的体积如果不同,请你推测主要原因是( )
A.气体分子的大小不同
B.气体分子的物质的量不同
C.气体分子的化学性质不同
D.气体分子间的距离不同
【解析】选B。气体的体积取决于粒子之间的距离和粒子数目。温度和压强一定,则气体粒子之间的距离就一定。如果粒子数目一定,则气体的体积就一定。
2.(2021·盐城高一检测)用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.32 g O2占有的体积约为22.4 L
B.常温常压下,22.4 L Cl2含有分子数为NA
C.标准状况下,22.4 L H2O所含有原子数为3NA
D.同温同压下,NA个N2分子所占的体积与0.5 NA个H2分子所占的体积比一定是2∶1
【解析】选D。 A项,32 g O2为1 mol,但未指明标准状况,故无法计算出体积,错误;B项,标准状况下22.4 L Cl2含有分子数为NA,常温常压下22.4 L Cl2所含有分子数小于NA,错误;C项,H2O在标准状况下为液态,错误;D项,同温同压下,气体的体积之比等于气体分子数之比,正确。
3.下列叙述正确的是( )
A.标准状况下任何气体的摩尔体积都是22.4 L
B.1 mol气体的体积若是22.4 L,它必定处于标准状况
C.两种气体的物质的量之比等于其原子个数比
D.标准状况下,1 mol H2和O2的混合气体的体积是22.4 L
【解析】选D。标准状况下任何气体的摩尔体积都约为22.4 L·mol-1,A错误;1 mol气体的体积在其他状况下也可以是22.4 L,B错误;两种气体的物质的量之比等于分子个数比,C错误。
【补偿训练】
(2021·南通高一检测)28g氮气和NA个一氧化碳气体相互比较可能不相同的是( )
A.原子数 B.物质的量
C.质子数 D.体积
【解析】选D。 28 g N2为1 mol,NA个CO也为1 mol,两者原子均为2 mol,N2和CO的质子数均为14个,所以等物质的量两者的质子数相等。气体的体积除了取决于物质的量外,还与外界的温度和压强有关,而题干没有指明两者各处的外界条件,故两者的体积不一定相同。
4.(2021·南通高一检测)同温同压下两个容积相等的贮气瓶,一个装有C2H4气体,另一个装有C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的( )
A.质量 B.原子总数
C.碳原子数 D.密度
【解析】选C。 同温同压同体积,则两容器中气体的物质的量分别相等,即C2H4的物质的量与C2H2和C2H6的总物质的量相等。由于C2H2和C2H6各自的物质的量未知,所以不能求出混合气体的质量,也不能求出混合气体中的总原子数目。质量未知,体积相等,则密度无法计算。C2H2和C2H6中碳原子数目均为2,所以1 mol C2H2和C2H6中碳原子数为2NA,1mol C2H4中碳原子数为2NA,C项正确。
【补偿训练】
在标准状况下,质量为m g的气体A与质量为n g的气体B的分子数相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量比为m∶n
B.同质量气体A与气体B的分子数比为n∶m
C.同温同压下,A气体与B气体的密度比为n∶m
D.相同状况下,同体积的A气体与B气体的质量比为m∶n
【解析】选C。A、B气体的分子数相同,则两者的物质的量相同。设A、B的摩尔质量分别为MA、MB。=,得=,A项正确;若质量相等,NA∶NB=n(A)∶n(B)=∶=n∶m,B项正确;密度之比等于质量之比,即为m∶n,C项错误;相同状况,体积相等时,物质的量相等,质量之比等于摩尔质量之比,为m∶n,D项正确。
5.提起能源,人们想到的往往是煤、石油、天然气等,不会是冷冷的冰块。但我国科技工作者已经可以将蕴藏在海底的“冰块”(可燃冰)点燃成熊熊燃烧的火焰。可燃冰学名为天然气水合物,是以甲烷为主的有机分子被水分子包裹而成,既含水又呈固体,看起来像冰,很容易被点燃。
CH4是21世纪的重要能源,NH3是重要的工业原料,请回答下列问题。
现工业生产中需要一定量的CH4和NH3:
(1)若有等物质的量的两种气体,试完成下表:
| 质量比 | 分子 个数比 | 原子 个数比 | 氢原子 个数比 |
CH4∶NH3 |
|
|
|
|
(2)若有等质量的两种气体,试完成下表:
| 物质的 量比 | 分子 个数比 | 原子 个数比 | 氢原子 个数比 |
CH4∶NH3 |
|
|
|
|
【解析】(1)因物质的量相同,故其质量之比等于摩尔质量之比,为16∶17;物质的量相同,故分子数相同,分子个数比为1∶1;1 mol CH4含有5 mol原子(1 mol C+4 mol H),1 mol NH3含有4 mol原子(1 mol N+3 mol H),原子个数比为5∶4,氢原子个数比为4∶3。(2)若质量均为m g,CH4和NH3的物质的量比为()∶()=17∶16;分子个数比为17∶16;原子个数比为(17×5)∶(16×4)=85∶64;氢原子个数比为(17×4)∶(16×3)=17∶12。
答案:(1)16∶17 1∶1 5∶4 4∶3
(2)17∶16 17∶16 85∶64 17∶12
高中化学苏教版 (2019)必修 第一册第二单元 物质的化学计量第2课时导学案: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 物质的化学计量第2课时导学案,共11页。学案主要包含了影响物质体积大小的因素,气体摩尔体积等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 物质的化学计量第二课时导学案及答案: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 物质的化学计量第二课时导学案及答案,共8页。
高中第二单元 物质的化学计量第1课时导学案及答案: 这是一份高中第二单元 物质的化学计量第1课时导学案及答案,共13页。学案主要包含了物质的量与阿伏加德罗常数等内容,欢迎下载使用。














