
2020-2021学年第1节 元素与物质分类第2课时学案
展开1.尝试利用同一类物质的一般性质预测陌生物质的性质,并设计实验验证,形成科学探究与创新意识的化学学科核心素养。
2.知道胶体是一种分散系,由于分散质颗粒大小与溶液、悬浊液不同,可以通过渗析分离溶液和胶体;知道胶体可以产生丁达尔现象,形成宏观辨识与微观探析的化学学科核心素养。
3.通过对胶体制备与性质的学习体现了科学探究与创新意识的化学学科核心素养。
eq \a\vs4\al(几种不同的分散系)
清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,这就是丁达尔现象。这是因为云、雾、烟是胶体,这些胶体的分散剂是空气,分散质是微小的尘埃或液滴。
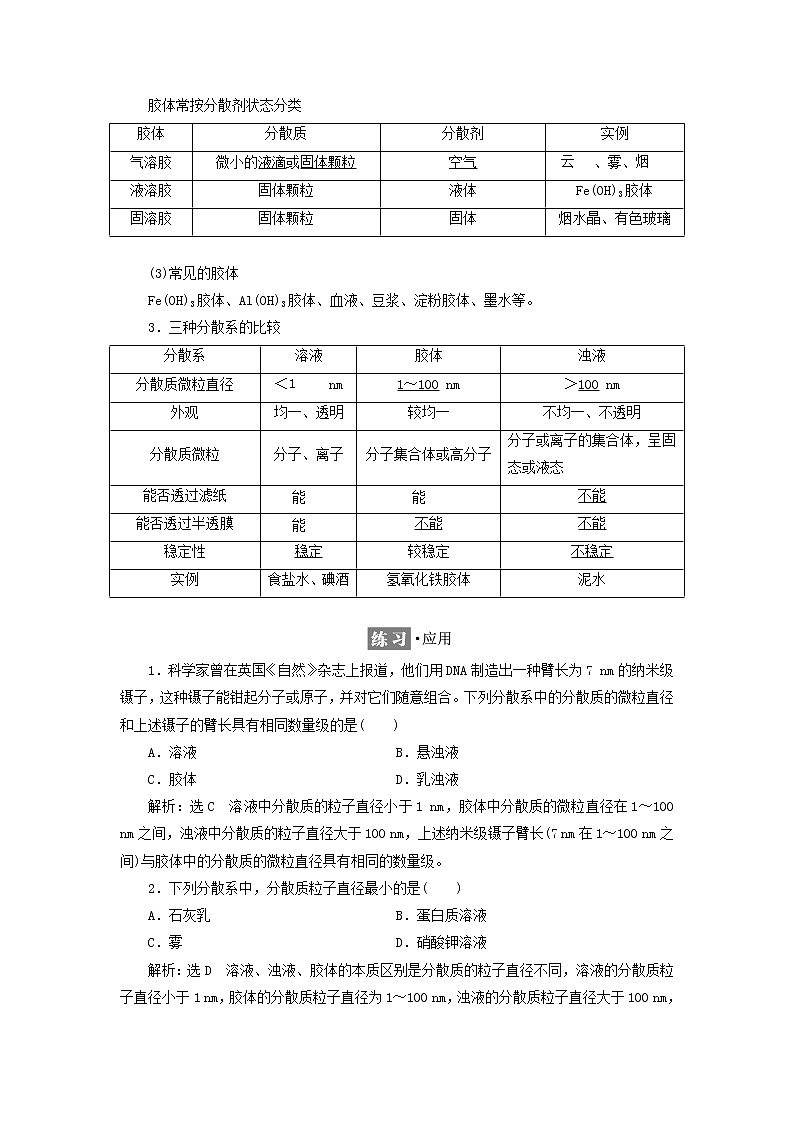
1.分散系
2.胶体概念及分类
(1)概念
分散质的微粒直径介于1~100 nm,这种分散系称为胶体。
(2)分类
胶体常按分散剂状态分类
(3)常见的胶体
Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉胶体、墨水等。
3.三种分散系的比较
1.科学家曾在英国《自然》杂志上报道,他们用DNA制造出一种臂长为7 nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中的分散质的微粒直径和上述镊子的臂长具有相同数量级的是( )
A.溶液B.悬浊液
C.胶体D.乳浊液
解析:选C 溶液中分散质的粒子直径小于1 nm,胶体中分散质的微粒直径在1~100 nm之间,浊液中分散质的粒子直径大于100 nm,上述纳米级镊子臂长(7 nm在1~100 nm之间)与胶体中的分散质的微粒直径具有相同的数量级。
2.下列分散系中,分散质粒子直径最小的是( )
A.石灰乳B.蛋白质溶液
C.雾D.硝酸钾溶液
解析:选D 溶液、浊液、胶体的本质区别是分散质的粒子直径不同,溶液的分散质粒子直径小于1 nm,胶体的分散质粒子直径为1~100 nm,浊液的分散质粒子直径大于100 nm,所以分散质的粒子直径最小的是溶液。石灰乳属于悬浊液,蛋白质溶液属于胶体,雾属于胶体,硝酸钾溶液属于溶液,故D正确。
3.现有如下各实验:①将1 g KCl加入99 g水中
②将1 g可溶性淀粉加入100 g水中,搅拌均匀后煮沸
③将1 g CaCO3粉末加入100 g水中,充分振荡
④将0.1 g植物油加入10 g水中,充分振荡混合均匀
⑤将96 mL酒精与5 mL水充分混合
(注:淀粉分子的直径在1~100 nm之间)
其中所得到的分散系,属于溶液的有________(填序号,下同),属于胶体的有________,属于浊液的有________。
解析:①分散质KCl溶于水后以离子形式存在,粒子直径小于1 nm,属于溶液;②淀粉分子的直径在1~100 nm之间,溶于水后形成的是胶体;③CaCO3不溶于水,振荡后所形成的是悬浊液;④植物油不溶于水,形成的是乳浊液;⑤酒精与水以任意比互溶,形成的是溶液。
答案:①⑤ ② ③④
eq \a\vs4\al(胶体的制备及应用)
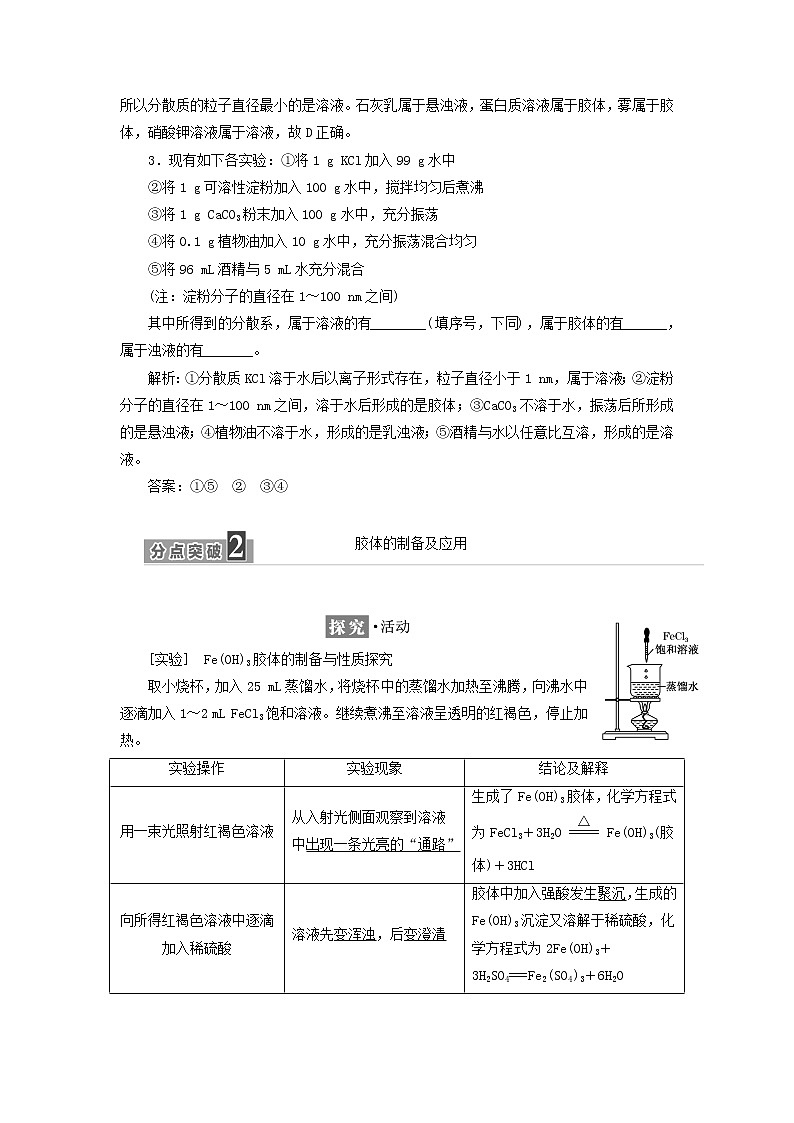
[实验] Fe(OH)3胶体的制备与性质探究
取小烧杯,加入25 mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液。继续煮沸至溶液呈透明的红褐色,停止加热。
[问题探讨]
(1)如何区分食盐水和淀粉胶体?
提示:能发生丁达尔效应的是淀粉胶体,NaCl溶液无此性质。
(2)Fe(OH)3胶体能产生丁达尔效应的原因是什么?
提示:Fe(OH)3胶体的粒子直径介于1~100 nm,对光有散射作用。
(3)胶体具有电泳性质,能否说明胶体带有电荷?
提示:不能。胶体呈电中性,某些胶体的分散质微粒带有电荷。
(4)能用自来水代替蒸馏水制备Fe(OH)3胶体吗?
提示:不能。因为自来水中的离子会使Fe(OH)3胶体颗粒聚成更大的颗粒,生成Fe(OH)3沉淀。
(5)制备氢氧化铁胶体过程中能用玻璃棒搅拌吗?
提示:不能,否则会发生聚沉,得到氢氧化铁沉淀。
(6)制备Fe(OH)3胶体时,为什么不用NaOH与FeCl3反应?
提示:FeCl3与NaOH溶液反应产生Fe(OH)3沉淀。
(7)请简述“黄河三角洲”的形成原理。
提示:三角洲一般在入海口处,即黄河水中的胶体成分遇到海水中的盐(NaCl、MgCl2)发生聚沉,胶体的长期聚沉形成三角洲。
1.胶体的制备方法
(1)机械法:用特殊的机械加工方法将固体物质加工成纳米级(1 nm=10-9 m)的超细粉末,该方法目前常用于纳米材料的生产。
(2)溶解法:如淀粉、蛋白质溶解于水中直接得到胶体。如淀粉胶体、蛋白质胶体。
(3)反应法:如Fe(OH)3胶体的制备。
反应的化学方程式为FeCl3+3H2Oeq \(=====,\s\up7(△))Fe(OH)3(胶体)+3HCl。
[名师点拨]
(1)书写制备Fe(OH)3胶体的化学方程式时,要注明“胶体”,不能用“↓”符号。
(2)Fe(OH)3胶体中的1个胶体微粒不是1个Fe(OH)3分子(微粒直径<1 nm),而是很多个Fe(OH)3分子聚集在一起形成的微粒直径在1~100 nm之间的集合体。
2.胶体的性质及应用
3.常见的丁达尔效应
如下图所示,①②③是气溶胶的丁达尔效应;④是液溶胶的丁达尔效应;⑤是固溶胶的丁达尔效应。
4.胶体的分离和提纯
(1)胶体与悬浊液的分离
胶体微粒可以透过滤纸而悬浊液中的分散质粒子不能透过滤纸,因此可用过滤的方法分离。
(2)胶体的净化
胶体微粒不能透过半透膜而小分子、离子能够透过半透膜,因此可用渗析的方法净化胶体。如除去Fe(OH)3胶体中的FeCl3:将混合物盛于半透膜制作的渗析袋中,置于流动(或频繁更换)的蒸馏水里一段时间即可。
[名师点拨]
(1)胶体区别于其他分散系的本质特征是胶体微粒的直径介于1~100 nm,而不是产生丁达尔现象。
(2)丁达尔现象是物理变化而不是化学变化。
(3)明矾做净水剂是利用明矾溶于水能形成Al(OH)3胶体,胶体具有吸附性;但胶体没有杀菌消毒的作用。
(4)胶体不带电荷,胶体微粒(分散质微粒)可能带电荷,例如淀粉胶体中的胶体微粒不带电荷。
1.新冠肺炎传播途径主要为直接传播、接触传播和气溶胶传播。气溶胶传播是指飞沫混合在空气中,形成气溶胶,吸入后导致感染,而气溶胶是胶体的一种。胶体区别于其他分散系的本质特征是( )
A.胶体是稳定的分散系
B.胶体是纯净物,其他分散系是混合物
C.产生丁达尔现象
D.分散质粒子直径在10-9~10-7m之间
解析:选D 胶体区别于其他分散系的本质特征是胶体粒子直径在1~100 nm(10-7~10-9m)之间,溶液的分散质粒子直径小于1 nm,浊液的分散质粒子直径大于100 nm。
2.晚自习的课间,同学们站在四楼上,可以看到操场上的空中有移动的光柱,这就是气溶胶发生的丁达尔效应,下列说法不正确的是( )
A.胶体和溶液都是混合物,它们属于不同的分散系
B.胶体分散质的粒子直径介于1~100 nm
C.利用丁达尔效应可鉴别胶体和溶液
D.胶体经短时间静置后会产生沉淀
解析:选D 胶体和溶液的分散质和分散剂不同,属于不同的分散系,均属于混合物,A正确;分散质粒子直径在1~100 nm 之间的分散系属于胶体,B正确;丁达尔效应是胶体独有的性质,溶液无此性质,利用丁达尔效应可以鉴别胶体和溶液,C正确;胶体是均一、稳定的分散系,具有介稳性,短时间静置后不会产生沉淀,D错误。
3.关于胶体和溶液的区别,下列叙述中正确的是( )
A.溶液呈电中性,胶体带电荷
B.一束光线分别通过CuSO4溶液和淀粉溶液时,仅前者会出现明显的光路
C.明矾可以净水与胶体的性质无关
D.溶液与胶体的本质区别在于分散质微粒直径的大小不同
解析:选D 溶液、胶体都是呈电中性的分散系,胶体微粒可能带电荷,A错误;一束光线分别通过CuSO4溶液和淀粉溶液时,前者不会出现明显的光路,淀粉溶液是胶体,有明显的光路,B错误;明矾可以净水与胶体的性质有关,铝离子水解产生氢氧化铝胶体,利用胶体的吸附性吸附沉淀难溶物,C错误;溶液与胶体的本质区别在于分散质微粒直径的大小不同,溶液的微粒直径较小,D正确。
4.下列关于胶体和溶液的说法中,不正确的是( )
A.溶液是均一、稳定的分散系,静置不易产生沉淀
B.胶体是均一、稳定的分散系,静置不易产生沉淀
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.可通过过滤从Fe(OH)3胶体中分离出Fe(OH)3胶粒
解析:选D 溶液是均一、稳定的分散系,静置不易产生沉淀,故A正确;胶体是介稳体系,比较稳定,静置不易产生沉淀,故B正确;丁达尔效应是胶体具有的性质,溶液没有,故C正确;胶体粒子可以透过滤纸,不能通过过滤从Fe(OH)3胶体中分离出Fe(OH)3胶粒,故D错误。
5.某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1~2 mL饱和____________溶液,继续煮沸,待____________时,停止加热;反应的化学方程式为__________________________________
__________________________。
(2)将制得的胶体放入半透膜制成的袋内,如图所示,放置2 min后,取少量半透膜外的液体置于试管中,置于暗处,用一束强光从侧面照射,观察到________(填“有”或“无”)丁达尔现象;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为________________。
(3)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解质溶液以保护胶体,接通直流电后,观察到的现象是____________(填“阳”或“阴”)极附近颜色逐渐变深,其原因是__________________________________________________________
________________________________________________________________________。
解析:(1)实验室制备Fe(OH)3胶体的操作要点:将蒸馏水先煮沸,然后加入饱和FeCl3溶液,再继续煮沸至溶液呈透明的红褐色,停止加热。
(2)胶体粒子不能透过半透膜,因此半透膜外的液体为溶液,所以无丁达尔现象;因溶液中含有Cl-,所以加入用稀硝酸酸化的硝酸银溶液会出现白色沉淀。
(3)Fe(OH)3胶体粒子带正电荷,在电场作用下发生电泳现象。带正电荷的胶粒向阴极(负极)移动,故阴极(负极)附近颜色逐渐加深。
答案:(1)氯化铁(或FeCl3) 液体呈红褐色 FeCl3+3H2Oeq \(=====,\s\up7(△))Fe(OH)3(胶体)+3HCl (2)无 有白色沉淀生成 (3)阴 Fe(OH)3胶体粒子带正电荷,在电场作用下向阴极(负极)移动
[分级训练·课课过关]
1.下列选项中的两种物质,可以用丁达尔效应区分的是( )
A.Na2CO3溶液和NaOH溶液
B.FeCl3溶液和Fe(OH)3溶胶
C.CuSO4溶液和CuCl2溶液
D.碳酸钙固体和硫酸钡固体
解析:选B Na2CO3溶液和NaOH溶液均为溶液,均没有丁达尔效应,故A错误;FeCl3溶液和Fe(OH)3溶胶可利用丁达尔效应鉴别,其中Fe(OH)3溶胶有丁达尔效应,故B正确;CuSO4溶液和CuCl2溶液均为溶液,均没有丁达尔效应,故C错误;碳酸钙固体和硫酸钡固体均为固体,为纯物质,均没有丁达尔效应,故D错误。
2.下列关于胶体的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质粒子直径为10-9~10-7 m
B.胶体是一种均一、稳定的纯净物
C.用平行光照射CuSO4溶液和Fe(OH)3胶体时,产生的现象不相同
D.向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色,制得Fe(OH)3胶体
解析:选B A项,胶体中分散质粒子直径为10-9~10-7 m,正确;B项,胶体是混合物,错误;C项,胶体能产生丁达尔效应,所以用平行光照射CuSO4溶液和Fe(OH)3胶体时现象不同,正确;D项,Fe(OH)3胶体的制备方法:向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色,正确。
3.胶体最本质的特征是( )
A.丁达尔效应
B.可以通过滤纸
C.布朗运动
D.分散质粒子的直径在1~100 nm之间
解析:选D 胶体的最本质的特征是分散质微粒的直径在1~100 nm之间,溶液和浊液本质区别:分散质微粒直径<1 nm的是溶液,分散质微粒直径>100 nm的是浊液,故选D。
4.下列有关FeCl3溶液和Fe(OH)3胶体的叙述正确的是( )
A.将饱和FeCl3溶液滴加到1.0 ml·L-1NaOH溶液中可制得Fe(OH)3胶体
B.Fe(OH)3胶体带正电,FeCl3溶液呈电中性
C.两种分散系的分散质具有相同的粒子直径
D.利用丁达尔效应可将两种液体区分
解析:选D NaOH溶液与饱和FeCl3溶液发生复分解反应生成Fe(OH)3沉淀,制备Fe(OH)3胶体时,应向沸水中滴饱和氯化铁溶液,故A错误;溶液、胶体都是呈电中性的分散系,Fe(OH)3胶体微粒吸附带正电荷离子才能带正电,故B错误;当分散剂是水或其他液体时,根据分散质粒子直径大小来分类,把分散系划分为溶液(小于1 nm)、胶体(1~100 nm)、浊液(大于100 nm),故两种分散系中分散质的粒子直径不相同,故C错误。
5.不能用胶体的知识解释的现象是( )
A.豆浆中加入石膏做豆腐
B.一支钢笔使用两种不同牌号的墨水,易出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.在海水与河水交界处,易形成三角洲
解析:选C 豆浆是胶体,遇电解质发生聚沉,故A错误;带相反电荷的胶体混合发生聚沉,故B错误;FeCl3溶液中加入NaOH溶液发生反应生成氢氧化铁沉淀,与胶体无关,故C正确;江河入海口三角洲的形成是胶体聚沉的结果,故D错误。
6.下列叙述正确的是( )
A.直径介于1~100 nm的微粒称为胶体
B.Fe(OH)3难溶于水,因此不可能均匀地分散在水里形成稳定的红褐色胶体
C.根据丁达尔效应,利用一束强光可以鉴别淀粉胶体和食盐溶液
D.胶体粒子是很多分子的集合体,因此不能通过滤纸,但可以透过半透膜
解析:选C 分散质粒子直径介于1~100 nm的分散系,称为胶体,故A错误;Fe(OH)3难溶于水,许多粒子聚集在一起,直径介于1~100 nm时,可能均匀地分散在水里形成稳定的红褐色胶体,故B错误;胶体能发生丁达尔效应,溶液不能产生丁达尔效应,利用一束强光可以鉴别淀粉胶体和食盐溶液,故C正确;胶体粒子是很多分子的集合体,但能通过滤纸,不可以透过半透膜,故D错误。
胶体
分散质
分散剂
实例
气溶胶
微小的液滴或固体颗粒
空气
eq \a\vs4\al(云)、雾、eq \a\vs4\al(烟)
液溶胶
固体颗粒
液体
Fe(OH)3胶体
固溶胶
固体颗粒
固体
烟水晶、有色玻璃
分散系
溶液
胶体
浊液
分散质微粒直径
<eq \a\vs4\al(1) nm
1~100 nm
>100 nm
外观
均一、透明
较均一
不均一、不透明
分散质微粒
分子、离子
分子集合体或高分子
分子或离子的集合体,呈固态或液态
能否透过滤纸
eq \a\vs4\al(能)
eq \a\vs4\al(能)
不能
能否透过半透膜
eq \a\vs4\al(能)
不能
不能
稳定性
稳定
较稳定
不稳定
实例
食盐水、碘酒
氢氧化铁胶体
泥水
实验操作
实验现象
结论及解释
用一束光照射红褐色溶液
从入射光侧面观察到溶液中出现一条光亮的“通路”
生成了Fe(OH)3胶体,化学方程式为FeCl3+3H2Oeq \(=====,\s\up7(△))Fe(OH)3(胶体)+3HCl
向所得红褐色溶液中逐滴加入稀硫酸
溶液先变浑浊,后变澄清
胶体中加入强酸发生聚沉,生成的Fe(OH)3沉淀又溶解于稀硫酸,化学方程式为2Fe(OH)3+3H2SO4===Fe2(SO4)3+6H2O
通电前,U形管内红褐色液面相平;通电后,U形管内红褐色液面左高右低
Fe(OH)3胶粒带正电荷,向与直流电源eq \a\vs4\al(负)极相连的一极移动
鲁科版 (2019)必修 第一册第1节 元素与物质分类第2课时导学案: 这是一份鲁科版 (2019)必修 第一册第1节 元素与物质分类第2课时导学案,共13页。学案主要包含了选择题,非选择题等内容,欢迎下载使用。
高中化学第2节 研究物质性质的方法和程序学案及答案: 这是一份高中化学第2节 研究物质性质的方法和程序学案及答案,共10页。学案主要包含了分散系,胶体的性质和应用等内容,欢迎下载使用。
化学必修 第一册第1章 认识化学科学第2节 研究物质性质的方法和程序第2课时导学案: 这是一份化学必修 第一册第1章 认识化学科学第2节 研究物质性质的方法和程序第2课时导学案,共9页。













