





2022中考一轮单元复习 10.第十单元 酸和碱课件PPT
展开常见酸和碱的特性(10年6考)
1. (2017河南9题1分)下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是( )A. 石灰水 B. 浓硫酸C. 浓盐酸 D. 烧碱溶液2. [2013河南18(1)题1分]浓硫酸有吸水性,在实验中常用它做_____剂。
3. [2016河南23(3)题1分]浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?
答:因为浓硫酸具有吸水性,溶剂会增多;浓盐酸具有挥发性,溶质会减少。
常见酸和碱的化学性质及用途(10年10考)
4. [2020河南25(1)题1分]酸具有相似的性质,因为不同的酸在水溶液中都能解离出_____(填字母)。a. H2O b. H2 c. H+ d. OH-5. [2012河南18(3)题1分]用化学方程式表示含Mg(OH)2的药物治疗胃酸过多症的原理。
答:Mg(OH)2+2HCl=== MgCl2+2H2O
6. [2014河南备用卷23(1)(2)题4分]酸和碱的知识是九年级化学学习的重要知识。请回答下列有关问题:(1)下列说法中不正确的是________(填字母代号)。a. 酸和碱都含有氢元素 b. 生成盐和水的反应一定是中和反应c. 多数酸和碱有腐蚀性 d. 酸和碱能与所有的盐发生复分解反应
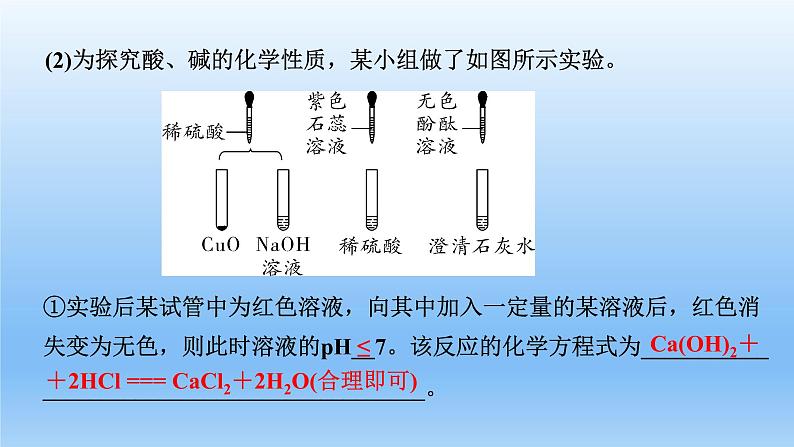
(2)为探究酸、碱的化学性质,某小组做了如图所示实验。
①实验后某试管中为红色溶液,向其中加入一定量的某溶液后,红色消失变为无色,则此时溶液的pH__7。该反应的化学方程式为____________________________________________。
+2HCl === CaCl2+2H2O(合理即可)
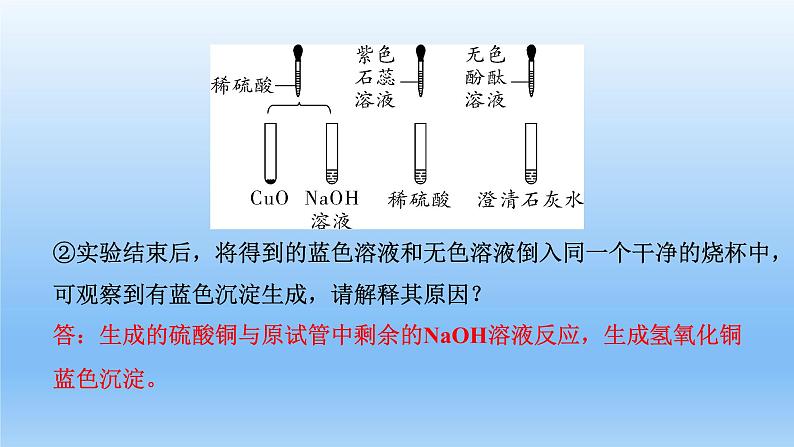
②实验结束后,将得到的蓝色溶液和无色溶液倒入同一个干净的烧杯中,可观察到有蓝色沉淀生成,请解释其原因?
答:生成的硫酸铜与原试管中剩余的NaOH溶液反应,生成氢氧化铜蓝色沉淀。
7. (2014河南17题2分)在充满CO2的铝制易拉罐中加入过量NaOH溶液后封口,易拉罐立即变瘪,原因是____________________________________________________,一会儿易拉罐又鼓起,因Al与NaOH溶液反应生成H2和NaAlO2,该化学方程式为______________________________________。
与碱的性质有关的兴趣实验(10年5考)
CO2能与NaOH溶液反应而被吸收,使易拉罐内气压减小
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
8. [2015河南22(2)②题1分]氨气极易溶于水,氨水显碱性。则如图实验可观察到什么现象?
答:试管内液面上升,溶液由无色变为红色。
9. [2013河南18(2)(3)题2分]物质的性质和用途是化学的重要研究内容。(1)用石灰浆粉刷墙壁,干燥后墙面就变硬了,用化学原理解释该现象(2)如图中,用滤纸做成的小花喷洒某溶液后放在烧杯上方,片刻后变成红色。请推测喷洒液和烧杯中溶液可能是什么?(写出一组即可)
答:石灰浆中含有Ca(OH)2,干燥过程中与空气中的CO2反应生成难溶于水(或坚硬)的CaCO3。
答:酚酞溶液和浓氨水(或紫色石蕊溶液和浓盐酸)。
10. (2016河南20题3分)以下是有关氨气(NH3)性质的趣味实验。
(1)如图圆底烧瓶充满氨气,当挤压胶头滴管并打开弹簧夹时,烧杯中的水进入烧瓶,形成“红色喷泉”。推测氨气具有哪些性质?
答:氨气极易溶于水;氨气与水反应生成碱性物质。
(2)氨气与酸反应可生成铵盐。将分别蘸有浓氨水和浓盐酸的玻璃棒接近(不接触),就有大量白烟产生。请解释白烟产生的原因。
答:浓氨水和浓盐酸都有挥发性,挥发出的氨气与氯化氢气体反应,在空气中生成了白色固体氯化铵(NH4Cl)。
中和反应(10年10考)
11. (2019河南备用卷12题1分)向硫酸中加入Ba(OH)2溶液,沉淀质量变化如图所示,下列说法不正确的是( )
A. a点处溶液的pH<7B. b点处溶液中只有一种溶质C. c点处溶液中含较多Ba2+、OH-D. d点处溶液中滴加酚酞溶液,溶液变红色
12. [2016河南23(2)题1分] 盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是( )
A. m点所示溶液为碱性B. n点所示溶液中加紫色石蕊溶液显红色C. p点所示溶液中的溶质为NaCl和NaOHD. 该图所对应操作是将盐酸滴入氢氧化钠溶液中
13. [2018河南25(2)题2分]如图是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
(1)根据图示判断,该实验是将_______(填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。(2)滴入溶液体积为V2 mL时,溶液中的溶质为__________________。
Na2SO4、H2SO4
14. (2021河南17题3分)氢氧化钠溶液与盐酸反应的化学方程式为_________________________。如图是该反应的微观示意图,则该反应前后没有发生变化的离子有___________________________;从微观角度看,该化学反应的实质是_________________________________________________。
HCl=== NaCl+H2O
钠离子、氯离子(或Na+、Cl-)
氢离子和氢氧根离子结合成水分子(或H++OH-=== H2O)
(2020河南备用卷16题3分)如图为某中和反应的示意图。图中的阴离子符号为____________;写出一个符合如图反应的化学方程式____________________________;若将酸滴入加有酚酞的碱溶液中,至恰好中和时溶液由红色变为_____。
15. [2013河南21(2)题3分]某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干,得到白色固体。以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
用玻璃棒蘸取反应后的溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡对照
Ca(OH)2、CaCl2
16. (2017河南21题2分)向盛有氢氧化钠溶液(滴有酚酞溶液)的烧杯中滴加盐酸时,观察到烧杯中的溶液由红色变为无色。(1)请写出有关反应的化学方程式。(2)烧杯中无色溶液的溶质可能只有NaCl,也可能还有HCl。要确定该溶质的成分,请写出一种可选用的试剂。
答:NaOH+HCl=== NaCl+H2O
答:紫色石蕊溶液(或锌等合理即可)。
17. (2018河南备用卷23题3分)向硫酸中滴加氢氧化钠溶液并不断搅拌,如图为反应时溶液pH变化的示意图。
(1)请写出该反应的化学方程式。(2)加入NaOH溶液a mL时,溶液中含有哪些溶质?
答:2NaOH+H2SO4=== Na2SO4+2H2O
答:Na2SO4、H2SO4
(3)若将b mL该氢氧化钠溶液滴入到与硫酸相同质量、相同质量分数的盐酸中,请判断反应后溶液的酸碱性。
18. [传统文化](2019重庆B卷)假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )A. 硫酸亚铁溶液 B. 稀盐酸C. 浓硝酸和浓盐酸的混合物 D. 稀硫酸
19. [微型实验](2020安徽)某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
常见的酸(10年4考)
定义:在水中解离出的阳离子全部是_____________的化合物,如HCl、H2SO4等
性质:无色、有刺激性气味的液体;浓盐酸易______,打开试剂 瓶, 瓶口会出现白雾,因此要密封保存用途:用于金属表面除锈、制造药物等;人体胃液中含有盐酸, 可帮助消化
色态:无色、无味、黏稠油状液体吸水性(物理性质):常用来作________腐蚀性(化学性质):如果不慎将浓硫酸沾到皮肤上,应立即____ _____________________________________ 稀释:应将______沿器壁缓慢注入___中,并用_______不断搅拌
冲洗,然后涂上3%~5%的碳酸氢钠溶液
用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油 和金属除锈等浓硫酸在实验室中常用作干燥剂
化学性质(10年10考)
与指示剂作用:能使紫色石蕊溶液变___色;不能使无色酚酞溶液变色
规律:酸+活泼金属→___________
2Al+6HCl=== _____________,现象:___________ ________________Fe+H2SO4=== ___________,现象:_____________ __________________________________
2AlCl3+3H2↑
有气泡产生,溶液由无色变为浅绿色
规律:酸+金属氧化物→ __________
Fe2O3+6HCl=== _____________,该反应常用于______现象:_______________________________________CuO+H2SO4===____________,现象:_____________ __________________________
2FeCl3+3H2O
红棕色固体逐渐溶解,溶液由无色变为黄色
溶解,溶液由无色变为蓝色
酸具有通性的原因是_________________
规律:酸+碱→ ________
NaOH+HCl===____________Ca(OH)2+H2SO4=== ________________
【特别提醒】不同酸具有“个性”的原因:__________________ 例如:Ba(NO3)2+H2SO4=== _________________现象:________________ AgNO3+HCl===_________________现象:___________________
规律:酸+盐→_____________________
CaCO3+2HCl===___________________,现象:____________________Na2CO3+H2SO4===____________________现象_____________
CaCl2+H2O+CO2↑
Na2SO4+H2O+CO2↑
BaSO4↓+2HNO3
酸具有通性的原因是_______________
溶液中都含有H+
定义:在水中解离出的阴离子全部是____________________的化合物,如NaOH、 Ca(OH)2等
常见的碱(10年3考)
俗称______、______、_______物理性质:白色固体,有强烈的____性,易溶于水,并放出 大量的热;易吸收水分而_____(物理性质), 氢氧化钠、硫 酸等腐蚀性药品包装上应贴的标志如图所示
氢氧根离子(或OH-)
工业制取原理:Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH用途:用作某些气体的_____剂;用于制取肥 皂,以及石油、造纸、纺织和印染等工业; 生活中用于去除油污
俗称______、______物理性质:白色粉末状固体,微溶于水;溶解度随温度的升 高而____
【特别提醒】a.氢氧化钠固体不能用来干燥HCl、CO2、SO2等酸性气体b.有颜色且不溶于水的碱,如Cu(OH)2为____色沉淀,Fe(OH)3______色 沉淀
制取:氢氧化钙可由氧化钙(CaO)与水反应得到,发生反应 的化学方程式为________________________
作建筑材料改良酸性土壤配制农药波尔多液保护树木,防止冻伤,并防止害虫生卵
CaO+H2O=== Ca(OH)2
与指示剂作用:能使紫色石蕊溶液变 色;无色酚酞溶液变___色【特别提醒】难溶性的碱不能使指示剂变色,如Cu(OH)2
与某些非金属氧化物反应
规律:碱+非金属氧化物→ _______
2NaOH+CO2=== _______________(实验室吸收CO2)Ca(OH)2+CO2===________________,现象:_______________(实验室检验CO2)
氢氧化钠变质的探究(详见微专题17)
规律:酸+碱→_______
Fe(OH)3+3HCl=== ________________现象:___________________________________Mg(OH)2+2HCl=== _______________Cu(OH)2+H2SO4===_______________现象:__________________________________
红褐色沉淀消失,溶液由无色变为黄色
蓝色沉淀消失,溶液由无色变为蓝色
碱具有通性的原因是___________________
规律:碱+盐→____________________
3NaOH+FeCl3===__________________现象:_________________
Fe(OH)3↓+3NaCl
Ca(OH)2+CuSO4=== ___________________ (配制农药波尔多液)现象:_______________
Cu(OH)2↓+CaSO4
【特别提醒】不同的碱具有“个性”的原因是____________________
三、中和反应(10年10考)
定义:___与____作用生成____和____的反应表达式:酸+碱―→ 盐+水实质:H++OH-=== ______(详见实验突破栏目)
农业:改变土壤的酸碱性,如用熟石灰改良酸性土壤工业:处理工业废水,如用熟石灰处理酸性废水医疗:用含氢氧化镁[Mg(OH)2]的药物治疗胃酸过多症日常生活:蚊虫叮咬后涂抹肥皂水、牙膏等
四、溶液的酸碱性与pH
溶液酸碱度的表示法——pH
定义:溶液的酸碱度常用pH来表示,pH的范围通常在_______之间,测定溶液的pH(详见第一单元考点四)
pH与溶液酸碱性的关系
pH<7,溶液呈___性pH=7,溶液呈___性pH>7,溶液呈___性
了解土壤的酸碱性,提供土壤改良的依据测定雨水的pH(pH<5.6的雨水称为酸雨),判断空气的污染情况医院通过测定人体内或排出的液体的pH来判断人体健康状况
下列说法正确的是____。①打开浓盐酸、浓硫酸的试剂瓶,瓶口都有白雾产生②酸中一定含有氢元素,则含有氢元素的化合物一定是酸③敞口放置的浓硫酸和浓盐酸的溶质质量分数变小的原因相同④氢氧化钠和氢氧化钙都能用于改良酸性土壤⑤中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应
⑥中和反应属于复分解反应,中和反应是基本反应类型的一种⑦用湿润的pH试纸测某溶液的pH,测定结果一定会有偏差⑧能使紫色石蕊溶液变红的一定是酸溶液⑨酸雨显酸性,则pH<7的雨水一定是酸雨⑩无色酚酞溶液不能鉴别NaOH和Na2CO3
一、常见酸(HCl、H2SO4)的化学性质(“酸五条”)
1. 请写出下列物质的化学式:A.__________;B.__________。
2. 请写出图中涉及的化学方程式①____________________________、___________________________、____________________________、______________________________;②____________________________、______________________________、_______________________________、________________________________;
Zn+2HCl=== ZnCl2+H2↑ Fe+2HCl=== FeCl2+H2↑ Zn+H2SO4=== ZnSO4+H2↑ Fe+H2SO4=== FeSO4+H2↑ NaOH+HCl=== NaCl+H2O Ca(OH)2+2HCl=== CaCl2+2H2O2NaOH+H2SO4=== Na2SO4+2H2O Ca(OH)2+H2SO4=== CaSO4+2H2O
③____________________________________、 ______________________________________;④____________________________、______________________________、 _________________________________、__________________________;⑤________________________________;⑥______________________________。
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑Na2CO3+H2SO4=== Na2SO4+H2O+CO2↑ Fe2O3+6HCl=== 2FeCl3+3H2O CuO+2HCl=== CuCl2+H2OFe2O3+3H2SO4=== Fe2(SO4)3+3H2O CuO+H2SO4=== CuSO4+H2O BaCl2+H2SO4=== BaSO4↓+2HCl AgNO3+HCl=== AgCl↓+HNO3
3. 金属除锈的化学方程式为_________________________________,生活中常用含Mg(OH)2的药物以及NaHCO3治疗胃酸过多症,反应的化学方程式分别为________________________________、_____________________________________。
Fe2O3+6HCl=== 2FeCl3+3H2O
Mg(OH)2+2HCl=== MgCl2+2H2O
NaHCO3+HCl===
NaCl+H2O+CO2↑
二、常见碱[NaOH、Ca(OH)2]的化学性质(“碱四条”)
1. 请写出下列物质的化学式:A. _________;B. ____________。
2. 请写出图中涉及的化学方程式①_________________________、_________________________________、 ______________________________、_______________________________;
HCl+NaOH=== NaCl+H2O H2SO4+2NaOH=== Na2SO4+2H2O2HCl+Ca(OH)2=== CaCl2+2H2O H2SO4+Ca(OH)2=== CaSO4+2H2O
②____________________________________、______________________________________、______________________________________、______________________________________;
MgCl2+2NaOH=== Mg(OH)2↓+2NaClCuSO4+2NaOH=== Cu(OH)2↓+Na2SO4MgCl2+Ca(OH)2=== Mg(OH)2↓+CaCl2CuSO4+Ca(OH)2=== Cu(OH)2↓+CaSO4
③_____________________________、______________________________; ________________________________、 ________________________________;④_____________________________________(工业制烧碱的原理)。
CO2+2NaOH=== Na2CO3+H2O SO2+2NaOH=== Na2SO3+H2OCO2+Ca(OH)2=== CaCO3↓+H2O SO2+Ca(OH)2=== CaSO3↓+H2ONa2CO3+Ca(OH)2=== CaCO3↓+2NaOH
1. 实验药品氢氧化钠溶液、稀盐酸、无色酚酞溶液。2. 实验原理中和反应过程中往往没有明显现象,无法确定是否发生反应或反应是否完全,因此可以借助酸碱指示剂来判断反应的发生。
4. 实验现象和结论(1)在碱溶液中加入无色酚酞溶液时,出现的现象为__________________。(2)向含有酚酞的碱溶液中滴加酸,当出现__________________________的现象时,酸碱恰好完全中和。
溶液恰好由红色变为无色
5. 实验拓展(1)中和反应的实质(10年2考)酸中的_____________与碱中的_____________________结合生成_______________,即H++OH- === H2O。其示意图如下:
(2)中和反应的pH坐标曲线图(10年3考)
①曲线类型判断图解:图1中,A点pH______7,可判断出反应前溶液呈____性(填“酸”或“碱”);B点pH____7,表示_________________;C点的pH____7;可判断出该反应是将______________(填“碱加入酸中”或“酸加入碱中”,下同)。同理可判断出图2是将___________。
②曲线中各点对应溶液中的溶质判断(以NaOH溶液和稀盐酸反应为例)
(3)反应后溶液中溶质成分的判断和检验(10年3考)以NaOH和HCl的反应为例,且已加入无色酚酞溶液,其反应的化学方程式为________________________________。
NaOH+HCl=== NaCl+H2O
③碳酸盐(或活泼金属或金属氧化物或难溶性碱)
6. 判断酸碱中和反应是否发生所用实验药品的改进分别选用一种酸和碱使其通过反应现象可直接证明酸碱中和反应的发生,请写出所选的酸和碱。(写出一组即可)
答:稀盐酸和氢氧化铜。(合理即可)
7. (1)借助传感器等测定溶液pH变化①碱入酸时,当出现pH由____(填“>”“<”或“=”,后同)7变为____7再到____7时,证明发生了中和反应。②酸入碱时,当出现pH由____7变为____7再到____7时,证明发生了中和反应。
(2)借助传感器测定溶液的温度变化将稀盐酸加入到一定量的NaOH溶液中进行酸碱中和反应,溶液温度变化情况如图:
②从能量变化的角度看,该反应属于______填“放热”或“吸热”)反应。③当实验进行到20 s时,溶液中含有的溶质是______________(填化学式,下同),当实验进行到60 s时,溶液中含有的溶质是____________。
①当实验进行到_____s时,酸与碱恰好完全反应。
例 如图是向盛有氢氧化钠溶液的烧杯中滴加稀盐酸的实验操作。请回答下列问题:
(1)滴加稀盐酸时,用玻璃棒不断搅拌的目的是________________。
(2)滴加稀盐酸至恰好完全反应,发生反应的化学方程式为__________________________,该反应属于___________(填基本反应类型)。(3)实验结束后,溶液呈无色,所得溶液中的溶质除酚酞外一定含有________,可能含有_______。
HCl === NaCl+H2O
(4)如图是室温下稀盐酸与氢氧化钠溶液反应过程中pH变化的曲线图,下列说法错误的是________(填序号)。
①图中X是氢氧化钠溶液②a点溶液中含有两种溶质③向a点时的溶液中滴加无色酚酞溶液,酚酞溶液不变色④b点表示两溶液恰好完全反应⑤b点表示HCl与NaOH等质量反应⑥由c点到d点的变化过程中没有发生化学反应
(5)(2021杭州改编)取图1稀盐酸与氢氧化钠反应后的溶液进行实验。下列能说明稀盐酸、氢氧化钠恰好完全反应的是____(填字母)。
A. 观察到溶液显红色B. 加硝酸银溶液,有白色沉淀生成C. 加氢氧化镁固体,固体全部溶解D. 测定溶液的pH,刚好显中性
(6)[数字化实验](2020海南)如图3是利用数字化传感器测得的盐酸与氢氧化钠溶液反应过程中溶液的pH变化图像。
①当溶液呈中性时,所消耗氢氧化钠溶液的体积为_____mL;
②请在虚线框内将b点时溶液中的微粒补充完整。
10.第十单元 酸和碱课件PPT: 这是一份10.第十单元 酸和碱课件PPT,共60页。PPT课件主要包含了Na2CO3+H2O,CaCO3↓+H2O,氢氧化钙,氯化钙,产生白色沉淀,酚酞溶液变红,酚酞溶液不变色,白色沉淀,pH试纸,7或<7等内容,欢迎下载使用。
中考总复习化学(河南地区)10.第十单元 酸和碱课件: 这是一份中考总复习化学(河南地区)10.第十单元 酸和碱课件,共60页。PPT课件主要包含了实验酸碱中和反应,溶液的酸碱性与pH,考点一,pH试纸,白瓷板或玻璃片,玻璃棒,即时小练,规律总结,顺口溜,常见酸的性质和用途等内容,欢迎下载使用。
2022中考一轮单元复习 10.第十单元 酸和碱课件PPT: 这是一份2022中考一轮单元复习 10.第十单元 酸和碱课件PPT,共34页。PPT课件主要包含了人教课本下册P50,人教课本下册P51,人教课本下册P52,人教课本下册P53,人教课本下册P54,人教课本下册P56,人教课本下册P57,人教课本下册P58,填空题,练习与应用等内容,欢迎下载使用。












