

高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性第2课时课后作业题
展开
这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性第2课时课后作业题,共6页。试卷主要包含了计算依据,计算方法,两强碱混合后pH的计算,在科学实验和工业生产方面,已知室温下,求下列溶液的pH等内容,欢迎下载使用。
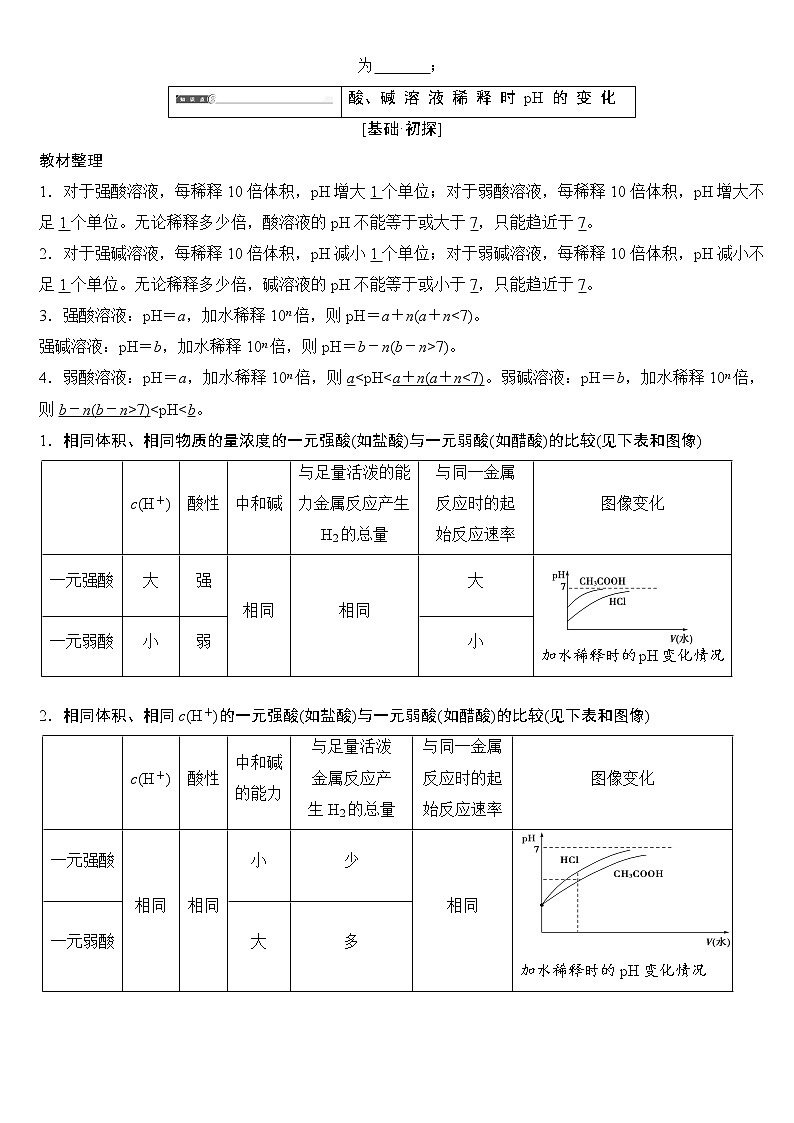
第2课时 pH的计算及应用 pH 的 计 算 及 应 用教材整理1 溶液pH的计算1.计算依据据pH=-lg_c(H+),求pH的关键是求溶液中的c(H+)。2.计算方法[认知升华]1.单一溶液pH的计算(1)强酸溶液,如HnA溶液,设溶质的物质的量浓度为c mol·L-1,c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg nc。(2)强碱溶液,如B(OH)n溶液,设溶质的物质的量浓度为c mol·L-1,c(H+)= mol·L-1,pH=-lg c(H+)=14+lg nc。2.两强酸混合后pH的计算由c(H+)混=先求出混合后的c(H+)混,再根据公式pH=-lg c(H+)求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。3.两强碱混合后pH的计算由c(OH-)混=先求出混合后的c(OH-)混,再通过KW求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后,pH=10.7。4.强酸、强碱混合后溶液pH的计算方法(1)若强酸、强碱混合恰好完全反应,则混合后溶液中的pH=7(25 ℃)。(2)若酸过量,直接求反应后溶液中的c混(H+),c混(H+)=。(3)若碱过量,应先求混合后溶液中的c混(OH-),再求c混(H+),c混(OH-)=,c混(H+)=。教材整理2 pH的应用1.人体健康调节如洗发时人们用的护发素主要功能是调节头发的pH使之达到适宜的酸碱度。2.环保治理污水酸性废水可投加碱性物质使之中和,碱性废水可投加酸性物质或利用烟道气中和。3.农业生产调节控制土壤的pH使之适宜作物生长,提高作物的质量和产量。4.在医疗上可以通过测试和调节pH来进行诊断和治疗疾病。5.在科学实验和工业生产方面溶液pH的控制常常是影响实验结果或产品质量、产量的关键因素。 [题组·冲关]1.根据常温下,水的离子积KW=c(H+)·c(OH-),回答下列问题:(1)c(H+)为1.0×10-2mol·L-1的某溶液中,c(OH-)为________,其pH为________。(2)pH=3的某盐酸溶液中,c(H+)为________,由水电离产生的c(H+)为________。(3)c(H+)为1.0×10-12 mol·L-1的溶液呈________性,你判断的依据是________。(4)将0.4 g NaOH固体溶于水,得到1 L溶液,c(OH-)=________,c(H+)=________,pH=________。2.常温下,pH=2的盐酸与pH=4的盐酸,若按1∶10的体积比混合后,溶液的c(H+)为________,pH为________。3.常温下,将200 mL 5×10-3 mol·L-1 NaOH溶液与100 mL 2×10-2 mol·L-1 NaOH溶液混合后,溶液的c(OH-)为________,c(H+)为________,pH为________。4.常温下,pH=12的NaOH溶液与pH=2的硫酸,若等体积混合后,溶液的pH为________;若按9∶11的体积比混合后,溶液的pH为________;若按11∶9的体积比混合后,溶液的pH为________。5.(1)25 ℃时,0.005 mol·L-1的H2SO4溶液的pH是 ;1×10-5 mol·L-1的NaOH溶液的pH是 ;(2)25 ℃某溶液由水电离出的c(H+)=1×10-12 mol·L-1,请探究该溶液的pH可能为 ;(3)pH=1的盐酸加入等体积的pH=4的盐酸,pH为 ; (4)25 ℃时,pH=13的NaOH溶液与pH=11的Ba(OH)2溶液等体积混合,混合溶液的pH为 ;酸、碱 溶 液 稀 释 时 pH 的 变 化[基础·初探]教材整理 1.对于强酸溶液,每稀释10倍体积,pH增大1个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足1个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。2.对于强碱溶液,每稀释10倍体积,pH减小1个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足1个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。3.强酸溶液:pH=a,加水稀释10n倍,则pH=a+n(a+n<7)。强碱溶液:pH=b,加水稀释10n倍,则pH=b-n(b-n>7)。 4.弱酸溶液:pH=a,加水稀释10n倍,则a<pH<a+n(a+n<7)。弱碱溶液:pH=b,加水稀释10n倍,则b-n(b-n>7)<pH<b。1.相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较(见下表和图像) c(H+)酸性中和碱与足量活泼的能力金属反应产生H2的总量与同一金属反应时的起始反应速率图像变化一元强酸大强相同相同大加水稀释时的pH变化情况一元弱酸小弱小 2.相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较(见下表和图像) c(H+)酸性中和碱的能力与足量活泼金属反应产生H2的总量与同一金属反应时的起始反应速率图像变化一元强酸相同相同小少相同加水稀释时的pH变化情况一元弱酸大多
题组1 酸、碱溶液稀释后pH变化规律1.pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释到原溶液的m倍和n倍,稀释后两溶液的pH仍相同,则m和n的关系量是( )A.m=n B.m>n C.m<n D.无法判断2.常温下,关于溶液的稀释,下列说法正确的是( )A.pH=3的醋酸溶液稀释100倍,pH=5B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1C.将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13D.pH=8的NaOH溶液稀释100倍,其pH=63.向10 mL pH为2的稀硫酸中加入一定浓度的BaCl2溶液,恰好反应时溶液体积为100 mL,则反应后溶液的pH为( )A.2 B.3 C.4 D.5题组2 一元强酸(碱)与一元弱酸(碱)的比较4.某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是( )A.Ⅱ为盐酸稀释时pH变化曲线B.b点溶液的导电性比c点溶液的导电性强C.a点KW的数值比c点KW的数值大D.b点酸溶液的总浓度大于a点酸溶液的总浓度5.现有体积相同、pH均为2的盐酸和醋酸,下列叙述错误的是 ( )A.盐酸溶液中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多C.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)D.它们分别与足量CaCO3反应时,放出的CO2一样多6.浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示。下列叙述错误的是( )A.MOH的碱性强于ROH的碱性B.ROH的电离程度:b点大于a点C.若两溶液无限稀释,则它们的c(OH-)相等D.当lg=2时,若两溶液同时升高温度,则增大学业分层测评[学业达标]1.下列说法正确的是( )A.pH=2的H2SO4与pH=1的硝酸溶液中c(H+)之比为1∶10B.0.2 mol·L-1与0.1 mol·L-1醋酸中c(H+)之比为2∶1C.100 ℃时,纯水的pH=6,显酸性D.100 mL pH=3的盐酸和醋酸溶液,分别与足量锌反应后,所得H2的质量相等2.将pH=8和pH=10的两种NaOH溶液等体积混合后,溶液中c(H+)最接近于( )A.(10-8+10-10) mol/L B.(10-8+10-10) mol/L C.(1×10-4+5×10-10) mol/L D.2×10-10 mol/L3.常温下,将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH是( )A.1.7 B.12.3 C.12 D.24.室温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比混合,所得溶液pH=12,则原溶液的浓度为( )A.0.01 mol·L-1 B.0.017 mol·L-1 C.0.05 mol·L-1 D.0.50 mol·L-15.在25 ℃的条件下,将体积都为10 mL,pH都等于3的醋酸和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积为( )A.a=b=10 mL B.a=b>10 mL C.a<b D.a>b6.25 ℃时,将某强酸和某强碱溶液按1∶10的体积比混合后,溶液恰好呈中性,则混合前此强酸和强碱的pH和为( )A.12 B.13 C.14 D.157.常温下,下列各混合或稀释后溶液中,pH最大的是( )A.pH=11的烧碱溶液稀释1 000倍 B.pH=11的氨水稀释1 000倍C.pH=4的醋酸和pH=10的烧碱溶液等体积混合 D.pH=5的盐酸稀释1 000倍8.pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是( )A.A、B两酸溶液的物质的量浓度一定相等B.稀释后,A酸溶液的酸性比B酸溶液强C.a=5时,A是强酸,B是弱酸D.一定有关系:5>a>2
9.t ℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13。(1)该温度下的离子积常数KW=________。(2)该温度下(t ℃),将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________________。10.已知室温下,求下列溶液的pH:(1)某H2SO4溶液的浓度是0.005 mol·L-1,①此溶液的pH为________。②用水稀释到原来体积的100倍,pH为________。③再继续稀释104倍,pH为________。(2)pH=3的盐酸与pH=5的硫酸等体积混合,pH为________。(3)pH=10和pH=12的两种NaOH溶液等体积混合,pH为________。(4)pH=12的NaOH溶液和pH=4的HCl溶液等体积混合,pH为________。11.室温时,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( ) A.1∶9 B.1∶1 C.1∶2 D.1∶412.室温时,下列混合溶液的pH一定小于7的是( )A.pH=3的盐酸和pH=11的氨水等体积混合B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合D.pH=3的硫酸和pH=11的氨水等体积混合13.室温下,有一pH为12的NaOH溶液100 mL,如果将其pH降为11,则:(1)若用蒸馏水应加入________mL;(2)若用pH=10的NaOH溶液,应加入______mL;(3)若用pH=2的盐酸,应加入________mL;(4)若用0.01 mol·L-1硫酸,应加入________mL。
相关试卷
这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性第3课时复习练习题,共10页。试卷主要包含了概念,原理,仪器及试剂,实验操作,实验数据的处理,滴定操作注意事项,下列实验操作不会引起误差的是,氧化还原滴定实验同中和滴定类似等内容,欢迎下载使用。
这是一份人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡第2课时随堂练习题,共8页。
这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 盐类的水解第2课时复习练习题,共8页。









