


十年高考真题分类汇编(2010-2019)化学 专题04 氧化还原反应
展开专题四 氧化还原反应
考点一:氧化还原反应的概念……………………………………………………………………1
考点二:氧化还原反应的规律……………………………………………………………………3
考点三:氧化还原反应的方程式的书写、配平及相关计算……………………………………4
考点一:氧化还原反应的概念
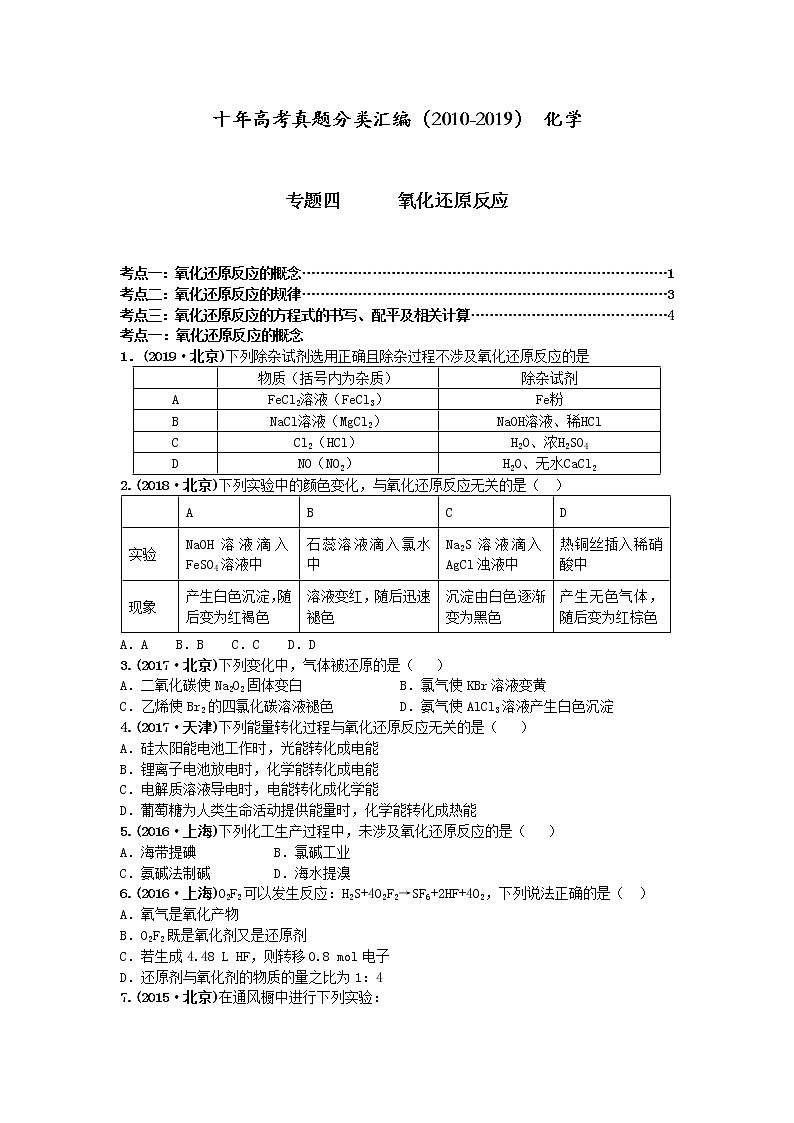
1.(2019·北京)下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
2.(2018·北京)下列实验中的颜色变化,与氧化还原反应无关的是( )
A.A B.B C.C D.D
3.(2017·北京)下列变化中,气体被还原的是( )
A.二氧化碳使Na2O2固体变白B.氯气使KBr溶液变黄
C.乙烯使Br2的四氯化碳溶液褪色D.氨气使AlCl3溶液产生白色沉淀
4.(2017·天津)下列能量转化过程与氧化还原反应无关的是( )
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
5.(2016·上海)下列化工生产过程中,未涉及氧化还原反应的是( )
A.海带提碘 B.氯碱工业
C.氨碱法制碱 D.海水提溴
6.(2016·上海)O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 ml电子
D.还原剂与氧化剂的物质的量之比为1:4
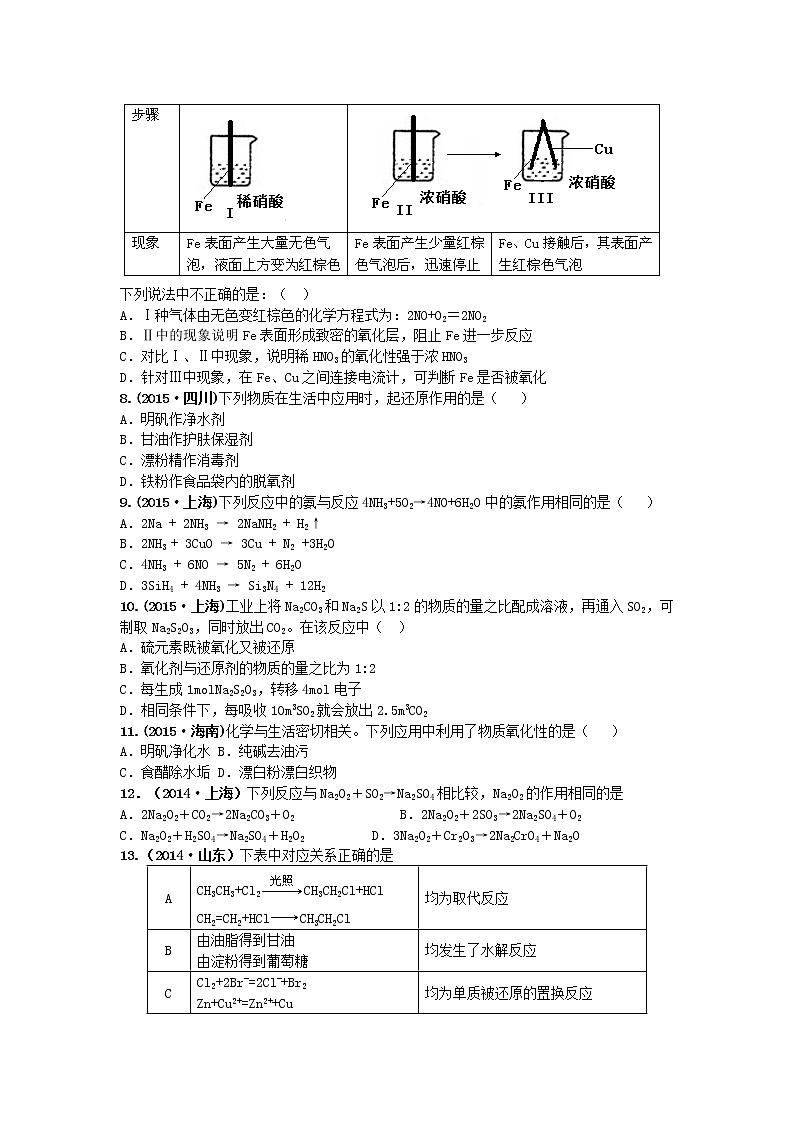
7.(2015·北京)在通风橱中进行下列实验:
下列说法中不正确的是:( )
A.Ⅰ种气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
8.(2015·四川)下列物质在生活中应用时,起还原作用的是( )
A.明矾作净水剂
B.甘油作护肤保湿剂
C.漂粉精作消毒剂
D.铁粉作食品袋内的脱氧剂
9.(2015·上海)下列反应中的氨与反应4NH3+5O2→4NO+6H2O中的氨作用相同的是( )
A.2Na + 2NH3 → 2NaNH2 + H2↑
B.2NH3 + 3CuO → 3Cu + N2 +3H2O
C.4NH3 + 6NO → 5N2 + 6H2O
D.3SiH4 + 4NH3 → Si3N4 + 12H2
10.(2015·上海)工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中( )
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1mlNa2S2O3,转移4ml电子
D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2
11.(2015·海南)化学与生活密切相关。下列应用中利用了物质氧化性的是( )
A.明矾净化水 B.纯碱去油污
C.食醋除水垢 D.漂白粉漂白织物
12.(2014·上海)下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+CO2→2Na2CO3+O2 B.2Na2O2+2SO3→2Na2SO4+O2
C.Na2O2+H2SO4→Na2SO4+H2O2 D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
13.(2014·山东)下表中对应关系正确的是
14.(2013·天津)运用有关概念判断下列叙述正确的是( )
A.1 ml H2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C.和互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
15.(2012·山东)下列与化学概念有关的说法正确的是( )
A.化合反应均为氧化还原反应
B.金属氧化物均为碱性氧化物
C.催化剂能改变可逆反应达到平衡的时间
D.石油是混合物,其分馏产品汽油为纯净物
16.(2012·广东)下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
17.(2012·安徽)科学家最近研究出一种环保、完全的储氢方法,其原理可表示为:
NaHCO3+H2储氢HCOONa+H2O
下列有关说法正确的是( )
A.储氢、释氢过程均无能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被氧化
D.释氢过程中,每消耗0.1 ml H2O放出2.24 L的H2
18. (2012·广东)下列应用不涉及氧化还原反应的是
A Na2O2用作呼吸面具的供氧剂 B 工业上电解熔融状态Al2O3制备Al
C 工业上利用合成氨实现人工固氮 D 实验室用NH4Cl 和Ca(OH)2制备NH3
19.(2011·上海)氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2F2+2H2O=4HF+O2 D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
20.(2010·安徽)亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是
A. Li2NH中N的化合价是-1B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等D.此法储氢和钢瓶储氢的原理相同
考点二:氧化还原反应的规律
21.(2016·北京)K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
结合实验,下列说法不正确的是 ( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
22.(2012·浙江)化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2C(OH)3 + 6HCl = 2CCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:
4NaClO 3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3 > C(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.酸性(水溶液):HSCN > H2CO3 > HCN
考点三:氧化还原反应的方程式的书写、配平及相关计算
23.(2019·浙江)反应8NH3+3Cl2N2+6NH4Cl,被氧化的NH3与被还原的Cl2的物质的量之比为
A.2∶3B.8∶3C.6∶3D.3∶2
24.(2017·全国I)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为_______。
25.(2017·全国III)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。
26.(2017·江苏)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O Ag(NH3) 2++ Cl− +2H2O
③常温时N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+:
4Ag(NH3) 2++N2H4·H2O4Ag↓+N2↑+4NH4++4NH3↑+H2O
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是____________________。
27.(2016·全国I)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
28.(2016·全国I)元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72−还原成Cr3+,该反应的离子方程式为_ _____。
29.(2016·全国II)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是______。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是___________。
30.(2016·全国III)以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(2)“氧化”中欲使3 ml的VO2+变为VO2+,则需要氧化剂KClO3至少为______ml。
31.(2016·全国III)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3ml·L−1。反应一段时间后溶液中离子浓度的分析结果如下表。
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。
33.(2016·北京)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42−=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
34.(2016·上海)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为
A.0.80 B.0.85 C.0.90 D.0.93
35.(2016·江苏)(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I−完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 ml·L−1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L−1表示),写出计算过程。
36.(2016·上海)NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为___________(选填“酸性”、“碱性”或“中性”);原因是____________。
(2)写出第二次氧化时发生反应的离子方程式。___________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_______、__________和H2O。
37.(2016·天津)下表为元素周期表的一部分。
回答下列问题
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2ml/LNaOH溶液和1mlO2,则两种气体的分子式及物质的量分别为___,生成硫酸铜物质的量为__________。
38.(2015·全国I)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
39.(2015·全国II)(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(3)用下图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 ml·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫
代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。
(4)用ClO2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
40.(2015·安徽)(2)请配平第①步反应的化学方程式:□NaBO2+□SiO2+□Na+□H2==□NaBH4+□Na2SiO3
41.(2015·浙江)(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________
Ⅱ.(12分) 化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 。
42.(2015·重庆)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
43.(2015·天津)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
②完成NaClO3 氧化FeCl2 的离子方程式:
44.(2015·上海)(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
45.(2015·山东)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(2)利用钴渣[含C(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
C(OH)3溶解还原反应的离子方程式为_______________,铁渣中铁元素的化合价为___________,在空气中煅烧CC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
46.(2015·江苏)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化_____L(标准状况)SO2。
(4)准确称取0.1710gMnSO4·H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500ml·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL。计算MnSO4·H2O样品的纯度(请给出计算过程)
47.(2015·江苏)(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
48.(2014·全国I )已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且的值与温度高低有关。当n(KOH)=aml时,下列有关说法错误的是
A.若某温度下,反应后=11,则溶液中=
B.参加反应的氯气的物质的量等于aml
C.改变温度,反应中转移电子的物质的量ne的范围:aml≤ne≤aml
D.改变温度,产物中KC1O3的最大理论产量为aml
49.(2014·全国I)(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。 ①H3PO2中,P元素的化合价为__________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为______(填化学式)。
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显_______(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式___________。
50.(2014·北京)碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O21________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:__________________。
51.(2014·天津)(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_________。
52.(2014·天津)(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:______。
53.(2014·天津)(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO,常用作脱氯剂,该反应的离子方程式为____________________________________________。
54.(2014·上海)硫在自然界中以游离态和多种化合态形式出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
28.硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。____________________
55.(2014·重庆)(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO3,且反应前后B的化合价不变,该反应的化学方程式为 ,反应消耗1mlNaBH4时转移的电子数目为 。
56.(2014·江苏)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。 (2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 ml H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
57.(2014·海南)(4)MnO2可与KOH和KClO4在高温条件下反应,生成K2MnO4,反应的化学方程式为_________,K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为______。
58.(2014·山东) (2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 ml电子时,所得还原产物的物质的量为________ml。
59.(2014·安徽)(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取。写出该反应的离子方程式,并标出电子转移的方向和数目 。
60.(2013·海南)(1)海水提溴过程中,向浓缩的海水中通入______,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO,其离子方程式为_______。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中,________显正电性。BrCl与水发生反应的化学方程式为_______________。
61.(2013·福建)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。XXK]
②该法工艺原理示意图如下。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。工艺中可以利用的单质有 (填化学式),发生器中生成ClO2的化学方程式为 。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式: +24NaClO3+12H2SO4ClO2↑+CO2↑+18H2O+
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的 倍。
62.(2012·四川)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 ml/L的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6 ml/L
C.产生的NO在标准状况下的体积为4.48 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 ml
63.(2012·海南)将0.195g锌粉加入到200mL的0.100 ml·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A. M B. M2+ C.M3+ D. MO2+
64.(2011全国II)某含铬Cr2O72- 废水用硫亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n mlFeO·FeyCrxO3 。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质量为n(2-x)ml
B.处理废水中Cr2O72- 的物质量为ml[.Cm]
C.反应中发生转移的电子数为3nx ml D.在FeO·FeyCrxO3中3x=y
65.(2010·上海)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若庄Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
66.(2011·上海)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2ml H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。&k.Cm]
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。科。网Z。X。X。K]
a.小于0.5 ml b.等于0.5 ml c.大于0.5ml d.无法确定
67.(2011·福建)(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10,10C+P4O10===P4+10CO
每生成1 ml P4时,就有________ml电子发生转移。物质(括号内为杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
NaCl溶液(MgCl2)
NaOH溶液、稀HCl
C
Cl2(HCl)
H2O、浓H2SO4
D
NO(NO2)
H2O、无水CaCl2
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
A
CH3CH3+Cl2CH3CH2Cl+HCl
CH2=CH2+HClCH3CH2Cl
均为取代反应
B
由油脂得到甘油
由淀粉得到葡萄糖
均发生了水解反应
C
Cl2+2Br‾=2Cl‾+Br2
Zn+Cu2+=Zn2++Cu
均为单质被还原的置换反应
D
2Na2O2+2H2O+4NaOH+O2↑
Cl2+H2O=HCl+HClO
均为水作还原剂的氧化还原反应
物质
V2O5
V2O4
K2SO4
SiO2
Fe2O3
Al2O3
质量分数/%
2.2~2.9
2.8~3.1
22~28
60~65
1~2
<1
离子
SO42−
SO32−
NO3−
NO2−
Cl−
c/(ml·L−1)
8.35×10−4
6.87×10−6
1.5×10−4
1.2×10−5
3.4×10−3
碳
氮
Y
X
硫
Z
十年高考真题分类汇编(2010-2019)化学 专题20 物质的结构与性质: 这是一份十年高考真题分类汇编(2010-2019)化学 专题20 物质的结构与性质,文件包含十年高考真题分类汇编2010-2019化学专题20物质的结构与性质docx、十年高考真题分类汇编2010-2019化学专题20物质的结构与性质Word版无答案原卷版docx等2份试卷配套教学资源,其中试卷共78页, 欢迎下载使用。
十年高考真题分类汇编(2010-2019)化学 专题19 有机化学基础: 这是一份十年高考真题分类汇编(2010-2019)化学 专题19 有机化学基础,文件包含十年高考真题分类汇编2010-2019化学专题19有机化学基础docx、十年高考真题分类汇编2010-2019化学专题19有机化学基础Word版无答案原卷版docx等2份试卷配套教学资源,其中试卷共231页, 欢迎下载使用。
十年高考真题分类汇编(2010-2019)化学 专题17 几种常见的烃: 这是一份十年高考真题分类汇编(2010-2019)化学 专题17 几种常见的烃,文件包含十年高考真题分类汇编2010-2019化学专题17几种常见的烃docx、十年高考真题分类汇编2010-2019化学专题17几种常见的烃Word版无答案原卷版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。