


十年高考真题分类汇编(2010-2019)化学 专题12 弱电解质的电离平衡
展开十年高考真题分类汇编(2010-2019) 化学
专题12弱电解质的电离平衡
题型一:弱电解质的电离平衡....................................................1
题型二:电离常数的应用.......................................................8
题型一:弱电解质的电离平衡
1.(2019·天津·5)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
2.(2018·天津·3)下列叙述正确的是( )
A.某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小
B.铁管镀锌层局部破损后,铁管仍不易生锈
C.反应活化能越高,该反应越易进行
D.不能用红外光谱区分C2H5OH和CH3OCH3
3.(2017·全国II·12)改变0.1二元弱酸溶液的pH,溶液中的、、的物质的量分数随pH的变化如图所示[已知]。
下列叙述错误的是( )
A.pH=1.2时,
B.
C.pH=2.7时,
D.pH=4.2时,
4.(2016·全国III·13)下列有关电解质溶液的说法正确的是( )
A.向0.1molCH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
5.(2016·江苏·10)下列图示与对应的叙述不相符合的是( )
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
6.(2016·上海·6)
能证明乙酸是弱酸的实验事实是( )
A.CH3COOH溶液与Zn反应放出H2
B.0.1mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与NaCO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
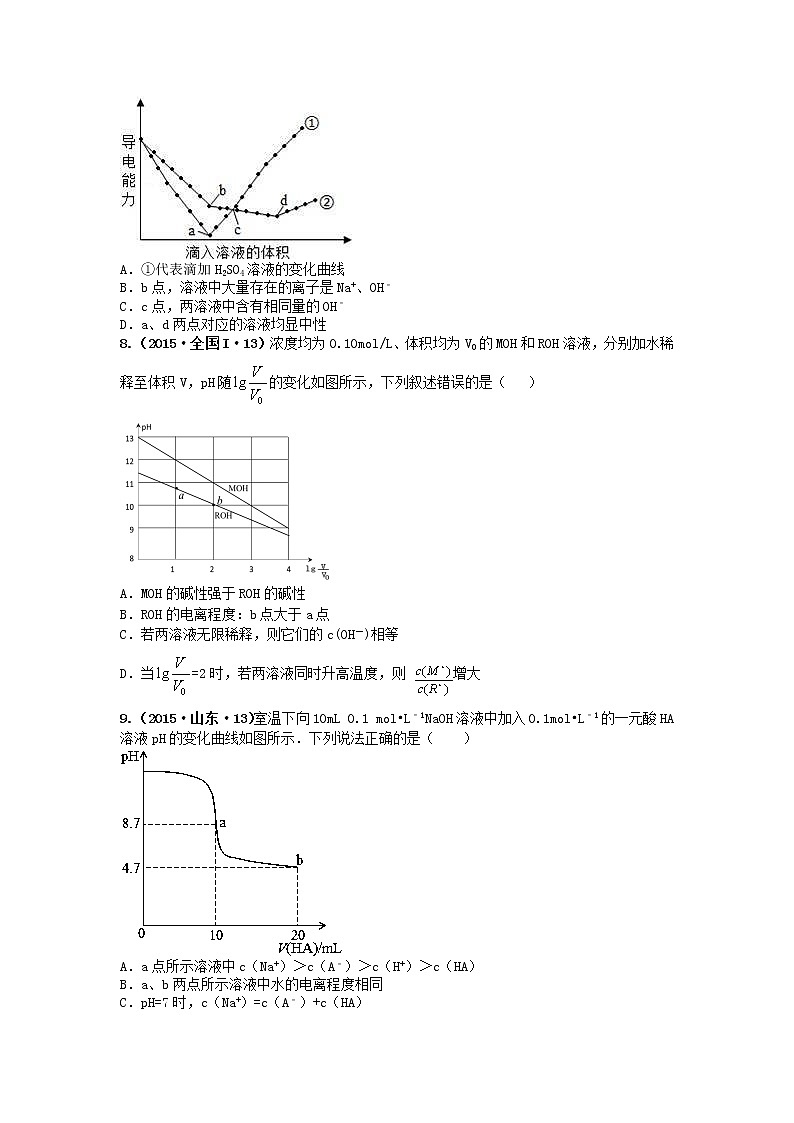
7.(2016·北京·11)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH﹣
C.c点,两溶液中含有相同量的OH﹣
D.a、d两点对应的溶液均显中性
8.(2015·全国I·13)浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当=2时,若两溶液同时升高温度,则 增大
9.(2015·山东·13)室温下向10mL 0.1 mol•L﹣1NaOH溶液中加入0.1mol•L﹣1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A﹣)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A﹣)+c(HA)
D.b点所示溶液中c(A﹣)>c(HA)
10.(2015·重庆·3)下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
11.(2015·江苏·11)下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H22NH3达到平衡时,3v正(H2)=2v逆(NH3)
12.(2015·海南·8)10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3
13.(2014·山东·13)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH)=c(CH3COO-)
14.(2014·全国II·11)一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
15.(2014·海南·8)0.1 mol/L HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
A.c(H+)>c(F-) B.c(H+)>c(HF)C.c(OH-)>c(HF) D.c(HF)>c(F-)
16.(2014·安徽·13)室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
17.(2013·福建·8)室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH—=Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)c(OH—)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
18.(2013·全国I·12)右图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
19.(2013·江苏·11)下列有关说法正确的是
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中 的值减小
D.Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小
20.(2013·海南·8)0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
A.c(H+)> c(F-) B.c(H+)> c(HF)
C.c(OH-)> c(HF) D.c(HF) > c(F-)
21.(2013·重庆·2)下列说法正确的是
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH
C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.AgCl易转化为AgI沉淀且K(AgX)=c(Ag+)∙ c(X—),故K(AgI)<K(AgCl)
22.(2013·四川·5)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) = mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
23.(2013·上海·5)374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水
A.显中性,pH等于7 B.表现出非极性溶剂的特性
C.显酸性,pH小于7 D.表现出极性溶剂的特性
24.(2013·上海·11)H2S水溶液中存在电离平衡H2SH++HS-和HS-H++S2-。若向H2S溶液中
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
25.(2013·天津·5)下列有关电解质溶液的说法正确的是
A、在蒸馏水中滴加浓H2SO4,KW不变
B、CaCO3难溶于稀硫酸,也难溶于醋酸
C、在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
26.(2013·安徽·13)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3- + H2OH2SO3 + OH- ①
HSO3-H+ + SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量Na2SO3固体,则c(H+) + c(Na+)=c(HSO3-) + c(OH-) +c(SO32-)
C.加入少量NaOH溶液,、的值均增大
D.加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-)
27.(2012·海南·11)25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a=b B.a>b C.c (A-)= c(Na+) D.c (A-)< c(Na+)
28.(2012·安徽·12)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25°C时:
① ·
②
在20ml.0.1mol氢氟酸的电离方程式及热效应可表示为:
A.
B.当V=20时,溶液中:
C.当V=20时,溶液中:·
D.当V>0时,溶液中一定存在)
29.(2012·重庆·10)下列叙述正确的是
- 盐酸中滴加氨水至中性,溶液中溶质为氯化铵
- 稀醋酸加水稀释,醋酸电力程度增大,溶液的pH减小
- 饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变
- 沸水中滴加适量饱和Fe溶液,形成带电的胶体,导电能力增强
30.(2012·广东·23)对于常温下pH为2的盐酸,叙述正确的是
A.c(H+)=c(Cl-)+c(OH-)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10-12mol·L-1
D.与等体积0.01 mol·L-1乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-)
31.(2011·山东·14)室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mlpH=11的NaOH溶液,混合液pH=7
32.(2011·全国I·10)
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A. c(H+) B. C. D.
33.(2011·全国II·6)等浓度的系列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的PH由小到大排列的正确是
A.④②③① B.③①②④ C.①②③④ D.①③②④
34.(2011·上海·19)
常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
A.b不可能显碱性 B. a可能显酸性或碱性
C.a不可能显酸性 D.b可能显碱性或酸性
35.(2010·全国卷1·3)下列叙述正确的是
A.在醋酸溶液的,将此溶液稀释1倍后,溶液的,则
B.在滴有酚酞溶液的氨水里,加入至溶液恰好无色,则此时溶液的
C.盐酸的,盐酸的
D.若1mL的盐酸与100mL溶液混合后,溶液的则溶液的
36.(2010·天津·4)下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH< 7,则该物质一定是酸或强酸弱碱盐
B.pH = 4.5的番茄汁中c(H+)是pH = 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH = 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
题型二:电离常数的应用
37.(2017·江苏·14)常温下,Ka(HCOOH)=1.77×10−4,Ka(CH3COOH)=1.75×10−5,Kb(NH3·H2O) =1.76×10−5,下列说法正确的是( )
A.浓度均为0.1 mol·L−1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol·L−1 HCOOH与0.1 mol·L−1 NaOH 等体积混合后的溶液中:c(HCOO−) + c(OH−) = c(HCOOH) + c(H+)
D.0.2 mol·L−1 CH3COONa 与 0.1 mol·L−1盐酸等体积混合后的溶液中(pH<7):c(CH3COO−) > c(Cl−) >c(CH3COOH) >c(H+):
38.(2017·江苏·20)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措 施之一.
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有CO32-,其原因是___.
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示.
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加.该过程中主要反应的离子方程式为___.
②H3AsO4第一步电离方程式H3AsO4⇌H2AsO4-+H+的电离常数为Ka1,则pKa1=___(p Ka1=-lg Ka1 ).
(3)溶液的pH对吸附剂X表面所带电荷有影响.pH=7.1时,吸附剂X表面不带电荷; pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多.pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图-3所示.
①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是___.
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___. 提高吸附剂X对三价砷去除效果可采取的措施是___.
39.(2016·天津·6)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后: c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
40.(2016·浙江·12)苯甲酸钠(,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A–)不变
C.当pH为5.0时,饮料中=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH–)–c(HA)
41.(2015·海南·11)下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( )
42.(2014·山东·29)(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO)、c(NO)和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水b.向溶液A中加适量NaOH
c.向溶液B中加适量水d.向溶液B中加适量NaOH
43.(2013·上海·19)部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
44.(2013·山东·29) (4)25℃时,H2SO3HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=mol/L。若向NaHSO3溶液中加入少量的I2,则溶液中将(填“增大”“减小”或“不变”)。
45.(2010·浙江·26)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=②25℃时,mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
请根据以下信息回答下旬问题: 图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是,反应结束后所得两溶液中,c(CH3COO-)c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka,列式并说明得出该常数的理由。
(3) mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
十年高考真题分类汇编(2010-2019)化学 专题20 物质的结构与性质: 这是一份十年高考真题分类汇编(2010-2019)化学 专题20 物质的结构与性质,文件包含十年高考真题分类汇编2010-2019化学专题20物质的结构与性质docx、十年高考真题分类汇编2010-2019化学专题20物质的结构与性质Word版无答案原卷版docx等2份试卷配套教学资源,其中试卷共78页, 欢迎下载使用。
十年高考真题分类汇编(2010-2019)化学 专题19 有机化学基础: 这是一份十年高考真题分类汇编(2010-2019)化学 专题19 有机化学基础,文件包含十年高考真题分类汇编2010-2019化学专题19有机化学基础docx、十年高考真题分类汇编2010-2019化学专题19有机化学基础Word版无答案原卷版docx等2份试卷配套教学资源,其中试卷共231页, 欢迎下载使用。
十年高考真题分类汇编(2010-2019)化学 专题17 几种常见的烃: 这是一份十年高考真题分类汇编(2010-2019)化学 专题17 几种常见的烃,文件包含十年高考真题分类汇编2010-2019化学专题17几种常见的烃docx、十年高考真题分类汇编2010-2019化学专题17几种常见的烃Word版无答案原卷版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。