












初中化学人教版九年级下册课题1 常见的酸和碱课文课件ppt
展开1.知道浓硫酸和浓盐酸的物理性质。2.知道浓硫酸的特性。3.学会稀释浓硫酸。4.了解酸具有相似的化学性质;5.初步学会运用观察、实验等方法获取信息。
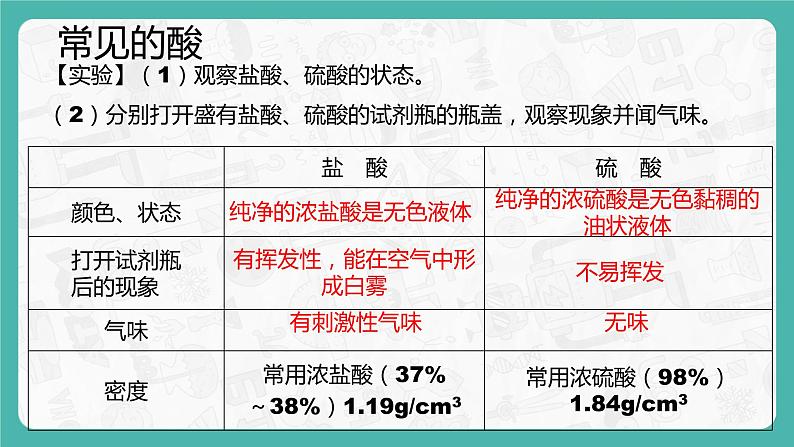
【实验】(1)观察盐酸、硫酸的状态。(2)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。
纯净的浓盐酸是无色液体
纯净的浓硫酸是无色黏稠的油状液体
有挥发性,能在空气中形成白雾
闻气体时应该小心,用手轻轻在瓶口扇动,使极少量的气体飘进鼻孔。
为什么打开盛有盐酸试剂瓶的瓶盖,会有白雾出现?
浓盐酸具有挥发性,打开瓶盖,挥发出的氯化氢气体在瓶口与空气中的水蒸气结合,形成盐酸小液滴,在瓶口形成“白雾”,因此敞口久置后质量会减轻。
此处是视频资源《浓硫酸的吸水性》
浓硫酸具有吸水性,但无挥发性,敞口久置于空气中,会吸收空气中的水分而导致质量增加,因此实验中常用浓硫酸作干燥剂。
汽车用铅蓄电池中含有硫酸
将纸、小木棍、布放在玻璃片上做下列实验。
滴有硫酸的部位变黑甚至烧成洞
浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的水分 ( 氢、氧元素 ), 生成黑色的炭和水。
浓硫酸具有腐蚀性,腐蚀性即脱水性,发生的是化学变化。
【特别提醒】 浓硫酸: 1.腐蚀性(脱水性),发生化学变化。 2.吸水性:发生物理变化。
1.浓盐酸具有挥发性。
2.浓硫酸具有吸水性。
浓硫酸有很强的腐蚀性,那么如何将浓硫酸稀释呢?
水的密度比浓硫酸小,浮在浓硫酸上面,溶解时放出大量的热会使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的.
将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅动,并用手接触烧杯外壁。
简记:酸入水中, 不断搅拌!
立即用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液。
当稀硫酸沾到皮肤或衣服上,也必须及时这样处理,因为稀硫酸长期露置在空气中,随着水分的蒸发,将转变为浓硫酸,会对皮肤或衣服造成强烈的腐蚀。
思考:如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理?
思考:如果不慎将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?为什么?
酸为什么能使酸碱指示剂变色呢?酸还有哪些化学性质呢?
这些酸中的什么成分使紫色石蕊溶液变红?
2、酸能与活泼金属反应
Fe2O3 + 6HCl =2FeCl3 + 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(1)铁锈与盐酸反应
现象:
铁锈逐渐溶解,溶液由无色变成黄色 。
红色粉末
(2)铁锈与稀硫酸反应
现象:
铁锈逐渐溶解,溶液由无色变成黄色。
化学方程式:
【思考】利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中,为什么?
不能,如果将金属制品长时间浸在酸中,铁锈被除去后,铁钉表面就会冒出气泡,这是因为铁与酸发生反应。
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
氧化铜与稀硫酸的反应
CuO+H2SO4=CuSO4+H2O
现象:黑色粉末逐渐溶解,溶液由无色变成蓝色
氧化铜与盐酸反应
CuO+2HCl=CuCl2+H2O
上述反应的生成物之一都是水,另一生成物是金属离子与酸根离子构成的化合物(盐)
结论:酸+金属氧化物 → 盐+水
AgNO3 + HCl = AgCl ↓+ HNO3
BaCl2 + H2SO4 = BaSO4↓+ 2HCl
回忆:石灰石的主要成分是什么?请写出稀盐酸与石灰石的主要成分反应的化学方程式。
CaCO3 + 2HCl == CaCl2+ CO2↑+ H2O
酸能和某些盐反应生成新的盐和新的酸
1、下列关于浓硫酸的说法正确的是( )A.易挥发 B.有腐蚀性 C.无吸水性 D.密度比水小2、下列物质不能与稀硫酸发生反应的是( )A.CuO B.Ag C.BaCl2 D.Mg(OH)2
3、下列对盐酸的叙述正确的是( )A.盐酸是氯化氢气体的水溶液 B.纯净的盐酸往往带有黄色C.浓盐酸在空气中会冒白烟 D.盐酸具有强烈的吸水性4、用玻璃棒蘸取浓硫酸在白纸上写字,如图。(1)现象:放置一会儿发现用 (填“浓”或“稀”)硫酸在白纸上写的字变黑。(2)结论:同种酸由于 不同,它们的性质不完全相同。
初中化学人教版九年级下册课题1 常见的酸和碱图文ppt课件: 这是一份初中化学人教版九年级下册课题1 常见的酸和碱图文ppt课件,文件包含1012常见的酸和碱第2课时-pptx、01浓盐酸和浓硫酸物理性质比较mp4、02浓硫酸吸水性mp4、03浓硫酸的腐蚀性实验mp4、04浓硫酸的稀释mp4等5份课件配套教学资源,其中PPT共14页, 欢迎下载使用。
化学九年级下册8.2 常见的酸和碱教课课件ppt: 这是一份化学九年级下册8.2 常见的酸和碱教课课件ppt,文件包含82常见的酸和碱第2课时课件pptx、82常见的酸和碱第2课时练习docx、82常见的酸和碱第2课时教案doc、82常见的酸和碱第2课时学案doc、盐酸除铁锈wmv、酸碱的化学性质素材硝酸银与盐酸wmv等6份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
初中化学科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱课文内容课件ppt: 这是一份初中化学科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱课文内容课件ppt,文件包含82常见的酸和碱第1课时练习docx、82常见的酸和碱第1课时课件pptx、82常见的酸和碱第1课时教案wps、82常见的酸和碱第1课时学案doc等4份课件配套教学资源,其中PPT共19页, 欢迎下载使用。













