










沪教版九年级下册第3节 物质的溶解性课前预习课件ppt
展开
这是一份沪教版九年级下册第3节 物质的溶解性课前预习课件ppt,文件包含63物质的溶解性第二课时课件pptx、63物质的溶解性第二课时教案docx、63物质的溶解性第二课时练习doc、63物质的溶解性第二课时学案doc、硝酸钾溶解度曲线swf、硝酸钾溶解度曲线的绘制swf、硝酸钾的溶解度与温度的关系flv等7份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
1、定义:在 下, 该物质在 (通常为100g水)里达到 状态时所溶解的质量。2、单位: 。
判断题:(1)100g水中溶解30g氯化钠正好达到饱和, 所以氯化钠溶解度为30g。(2)20℃时, 100g水中能溶解30g氯化钠, 所以氯化钠溶解度为30g。(3) 20℃时, 50g水中溶解18g氯化钠正好达到饱和, 所以氯化钠溶解度为18g。
如:食盐在20℃时的溶解度是36g。
100g水中溶解36g食盐,
氢氧化钙在20℃时的溶解度是0.165g就是指
100g水中溶解0.165g氢氧化钙,
硝酸钾在60℃时的溶解度是110g,就是指
60℃时,100g水中溶解110g硝酸钾正好达到饱和.
20℃时, 100g水中最多能溶解36g食盐.
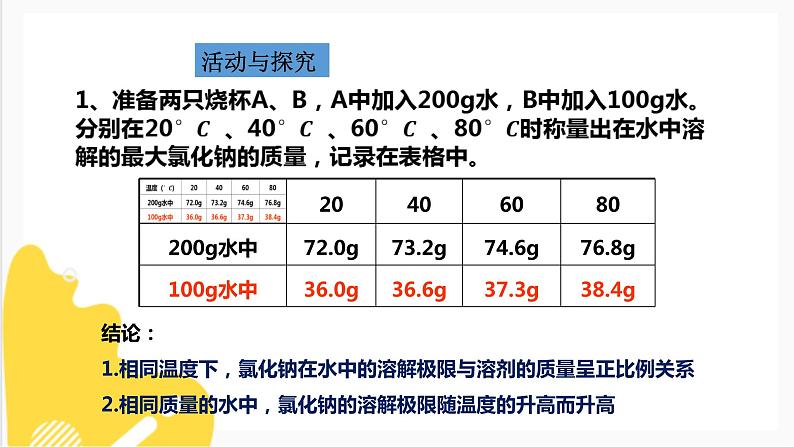
结论:1.相同温度下,氯化钠在水中的溶解极限与溶剂的质量呈正比例关系2.相同质量的水中,氯化钠的溶解极限随温度的升高而升高
在一定温度下,该物质在100g溶剂里达到饱和状态时所溶解的质量。定量的表示物质的溶解性的物理量。
例: NaCl在50 ℃时的溶解度是37.0g
在50 ℃时,100 g水中最多可溶解37.0g NaCl。
在50 ℃时,100 g水中溶解37.0gNaCl,溶液达到饱和。
例: 硝酸钾在60 ℃时的溶解度是110.0g
在60 ℃时,100 g水中最多可溶解110.0硝酸钾。
在60 ℃时,100 g水中溶解110.0g硝酸钾,溶液达到饱和。
(1)条件:(2)标准:(3)状态:(4)单位:
100g溶剂(一般指水)
缺少任何一个要素,溶解度都无意义!
思考与讨论: 20℃时,食盐的溶解度为36克,请问这句话所表示的意思是什么 ?
在20 ℃时,100 g水中溶解36.0gNaCl,溶液达到饱和。
根据不同物质的溶解度不同,将溶解性划分
说明:所谓的易溶、可溶、微溶、难溶时相对的。自然界没有绝对不溶的物质。习惯上称作“不溶”的物质,只是溶解度很小,一般忽略不计而已。
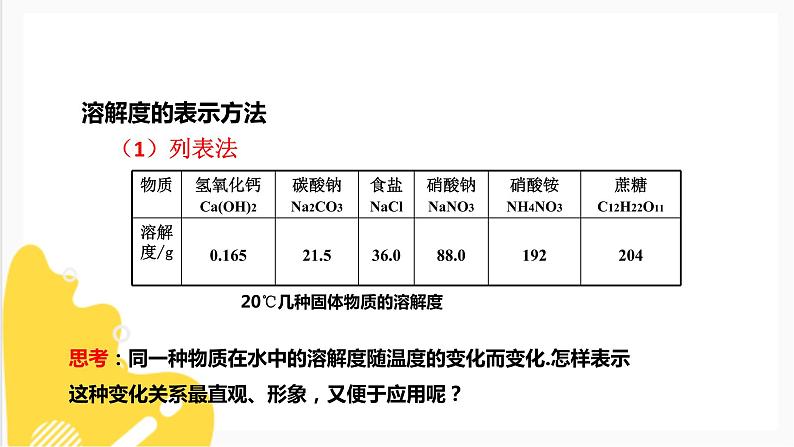
思考:同一种物质在水中的溶解度随温度的变化而变化.怎样表示这种变化关系最直观、形象,又便于应用呢?
硝酸钾得溶解度与温度的关系
根据表格数据,绘制硝酸钾溶解度曲线
讨论:两种溶解度的表示方法有什么不同?
1、点:曲线上的点均表示某物质在该温度下的溶解度。
2、交点:曲线的交点表示这两种物质在该温度下的溶解度相同。
3、曲线:曲线越陡,该物质的溶解度受温度影响越大。
4、一般固体物质的溶解度随温度的升高而增大。
从溶解度曲线中,你能得到哪些信息?
1、固体溶解度曲线可以表示如下几种关系:(1)曲线的横向变化表示同一物质在不同温度时的溶解度的数值。(2)曲线的纵向变化可以表示物质在同一温度时的溶解度数值。(3)每条曲线代表一种物质的溶解度受温度变化影响的趋势及大小。(4)溶解度曲线上的每一点都表示该物质在某温度下的溶解度, 其对应的溶液必为饱和溶液。(5)两条曲线的交叉点表示两种溶质在同一温度下具有相同的溶解度。(6)在溶解度曲线下方的点(或区域),表示对应的溶液是不饱和溶液。(7)溶解度曲线上方近曲线的点(或区域)表示过饱和溶液。
根据固体物质的溶解度曲线,完成下列问题
多数固体物质溶解度随温度升高而升高
硼酸 硝酸钾 氯化钾 氯化钾 氯化钠 硝酸钠 硝酸铵
2、利用溶解度曲线主要可以帮助解决以下问题:(1)可以查阅某种物质在某温度下的溶解度或确定某物质溶解度对应的温度。(2)可以比较某一温度下各种物质溶解度的大小(3)可以确定温度对物质溶解度的影响情况,一次确定分离混合物的方法:一般而言,溶解度受温度影响较大的物质可以用降温结晶法(冷却热饱和溶液法)分离,二溶解度受温度影响较小的物质可以用蒸发溶剂的方法到晶体。(4)可以确定怎样制得某温度下某物质的饱和溶液。
比较两幅溶解度曲线图,从溶解度曲线中,你能得到哪些信息?
1、多数固体物质的溶解度随着温度的升高而增大;(陡升型,代表物质:硝酸钾)2、少数固体物质的溶解度受温度变化的影响小;(缓升型,代表物质:氯化钠)3、极少数固体物质的溶解度随着温度的升高而减小。(下降型,代表物质:氢氧化钙)
气体溶解度定义:气体在压强为101kPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。
气体溶解度:是一个比值
1标准大气压下,20℃时部分气体的溶解度
思考:气体的溶解度与什么有关系呢?
(1)打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
打开汽水瓶盖,瓶内压强变小,二氧化碳的溶解度减小,所以汽水会自动喷出来。
气体的溶解度受温度的影响,温度升高,气体的溶解度变小。
影响气体物质溶解度的因素
*压强的增大,气体的溶解度增大 *温度的升高,气体的溶解度减小
(1)气体的性质(2)温度(3)压强
1、夏天鱼常浮头,而冬天则少见,说明了什么?
2、雷阵雨前鱼常浮头,说明了什么?
夏天温度高,氧气在水中的溶解度降低,水中缺氧
雷雨前,大气压强减少,氧气在水中的溶解度降低,水中缺氧
现在你能解释为什么生活在青海湖附近的人们习惯“夏天晒盐,冬天捞碱”了吗?。
原因:“夏天晒盐”是因为食盐的溶解度受温度变化的影响不大,夏天气温高,水分蒸发快,食盐易析出;“冬天捞碱”,是因为纯碱的溶解度受温度变化的影响较大,冬天气温降低,纯碱易析出。
定义:像晒盐那样,把溶液中析出晶体的过程称为结晶。
[实验1] 取10毫升农的氯化钠溶液,用酒精灯加热,用玻璃棒搅拌,观察实验现象。
结论:蒸发溶剂,可以从溶液中析出晶体
补充:蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。例如:当NaCl和KNO3的混合物中NaCl多而KNO3少时,即可采用此法,先分离出NaCl,再分离出KNO3。
实验器材:蒸发皿;铁架台;铁圈;玻璃棒;酒精灯;坩埚钳注意事项:1、蒸发皿中液体的量不得超过容积的2/3。2、蒸发过程中必须用玻璃棒不断搅拌,以防止局部温度过高而使液体飞溅。3、当加热至(大量)固体出现时,应停止加热利用余热蒸干。4、坩埚钳用于夹持蒸发皿。5、不能把热的蒸发皿直接放在实验台上,应垫上石棉网。
[实验2]在一只盛有30mL沸水的烧杯中不断加入硝酸钾,配成硝酸钾饱和溶液,将烧杯放在冷水中降温,观察实验现象
结论:通过冷却热饱和溶液的方法,可以从溶液中析出晶体
补充:先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出,叫降温结晶。
降温的方法得到硼酸晶体
(1)蒸发溶剂结晶:适用于溶解度受温度影响较小的的固体溶质。如蒸发海水获得食盐。
蒸发溶剂使溶质结晶析出
(2)冷却热饱和溶液结晶:或称降温结晶法。适用于溶解度受温度影响较大的固体溶质。如冷却热的硝酸钾饱和溶液来获取硝酸钾晶体;
冷却热的饱和溶液使晶体析出
从溶解度曲线分析结晶情况
1、降温结晶(又叫冷却热饱和溶液法)
适用于溶解度受温度影响不大的物质如:NaCl
适用于溶解度随温度升高明显增大的固体物质如:KNO3
(A)陡升型:冷却热饱和溶液法(B)缓升型:蒸发溶剂(C)下降型:升高温度(D)陡升型的物质中混有少量缓升型的物质时:先冷却热饱和溶液法将陡升型的物质析出
溶解度与结晶方法有什么关系呢?
结晶在生产生活中的应用
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
滤液中:大部分NaCl 少量KNO3
步骤:1、配得热饱和溶液 2、冷却结晶 3、过滤
我国有许多盐碱湖,湖水中溶有大量的食盐和纯碱,那里的农民冬天捞碱,夏天晒盐。试用你学过的知识,并结合右图所示曲线,说明其中的道理。
纯碱的溶解度随温度变化较大,冬天气温下降,纯碱晶体易析出;食盐溶解度随温度变化不大,夏天气温较高,水分易蒸发,食盐晶体易析出。
海水晒盐的得到的是精盐还是粗盐呢?
海水晒盐得到的是含有大量杂质的粗盐。
粗盐、蒸馏水托盘天平、纸片、钥匙、烧杯、量筒、胶头滴管、玻璃棒、铁架台(带铁圈)、滤纸、酒精灯、蒸发皿、坩埚钳、石棉网、火柴、剪刀
1、溶解
玻璃棒:搅拌,加速溶解
玻璃棒:引流,防止液体飞溅
玻璃棒:搅拌,防止局部温度过高而造成液滴飞溅
(4)注意事项:1、过滤操作中要注意一贴二低三靠。 (1)一贴:滤纸紧贴漏斗内壁; (2)二低:滤纸边缘低于漏斗边缘;漏斗中的液面低于滤纸边缘; (3)三靠:漏斗颈尖端紧靠盛接滤液的烧杯的内壁;引流的玻璃棒下端轻靠三层滤 纸处;烧杯的尖嘴处靠在玻璃棒的中下部。2、蒸发结晶过程中,加热到有大量晶体析出,停止加热。3、如果第一次过滤不干净,再过滤第二次。
相关课件
这是一份初中第3节 物质的溶解性评优课ppt课件,文件包含上海教育版中学化学九年级下第6章第3节第3课时教学课件pptx、63物质的溶解性docx、上海教育版化学九年级下册第6章第3节练练基础题docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
这是一份初中化学沪教版九年级下册第3节 物质的溶解性试讲课ppt课件,文件包含上海教育版中学化学九年级下第6章第3节第2课时教学课件pptx、63物质的溶解性docx、同步练习docx等3份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
这是一份初中沪教版第3节 物质的溶解性精品ppt课件,文件包含上海教育版中学化学九年级下第6章第3节第1课时教学课件pptx、63物质的溶解性docx、同步练习docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。









