




专题17 溶液、乳化、溶液配制(重点、难点)-备战2022年中考化学一轮复习考点微专题
展开
这是一份专题17 溶液、乳化、溶液配制(重点、难点)-备战2022年中考化学一轮复习考点微专题,文件包含专题17溶液乳化溶液配制重点难点-备战2022年中考化学一轮复习考点微专题教师版含解析doc、专题17溶液乳化溶液配制重点难点-备战2022年中考化学一轮复习考点微专题学生版doc等2份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。
例1.(2021·湖南长沙市·中考真题)为探究不同物质在水中的溶解情况,小明将少量下列物质分别放入足量水中,充分搅拌,其中可以得到溶液的是( )
A.食盐B.面粉
C.植物油D.白砂糖
【答案】AD
【解析】A、食盐溶于水,能形成均一、稳定的混合物盐水,正确;B、面粉不溶于水,和水形成悬浊液,错误;C、植物油不溶于水,和水形成乳浊液,错误;D、白砂糖溶于水,能形成均一、稳定的混合物糖水,正确。故选AD。
例2.(2021·陕西中考真题)如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH4NO3固体后,甲中未观察到明显现象。下列说法正确的是( )
A.乙中溶液一定变浑浊B.甲中溶液一定变成饱和溶液
C.乙中溶液溶质的质量分数一定变小D.甲、乙中溶液质量一定相等
【答案】D
【解析】A、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,氢氧化钙的溶解度增加,变为不饱和溶液,溶液不变浑浊,不符合题意;B、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,硝酸钾的溶解度减小,甲中无明显现象,硝酸钾可能恰好饱和,也可能是不饱和溶液,不符合题意;C、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,氢氧化钙的溶解度增加,变为不饱和溶液,乙中溶液溶质质量分数不变,不符合题意;D、由以上分析可知,甲、乙中溶液均无溶质析出,溶液质量不变,故溶液质量一定相等,符合题意。
故选D。
例3.(2021·湖南邵阳)下列有关溶液的说法错误的是( )
A.溶液是均一、稳定的混合物
B.溶液中的溶质可以是固体、液体或气体
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用
【答案】C
【解析】A、溶液是均一、稳定的混合物,说法正确。B、溶液中溶质可以是固体、液体或气体,如食盐水中的溶质氯化钠是固体,白酒中的溶质酒精是液体,盐酸中的溶质氯化氢是气体,说法正确。C、溶液是否饱和与溶液的浓稀没有必然联系,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,说法错误。D、洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用,洗涤剂可以使油污以细小的液滴均匀分散在水中,形成乳浊液,说法正确。故选C。
例4.(2021·安徽省卷)某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是( )
A.用托盘天平称葡萄糖时,砝码放在左盘B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面D.配好溶液装入试剂瓶时,有少量洒出
【答案】C
【解析】A、配制100g质量分数为11%的葡萄糖溶液,所需葡萄糖为:100g×11%=11g,需要用到游码,用托盘天平称量葡萄糖时,砝码放在左盘,左盘质量=右盘质量+游码质量,故葡萄糖质量=砝码质量-游码质量,会导致溶质质量偏小,配制溶液的浓度偏低,不符合题意;B、转移葡萄糖时,纸上有少量残留,会导致溶质质量偏小,溶液浓度偏低,不符合题意;C、用量筒量取水时,俯视液面,读取数字大于实际数值,会使量取水的体积偏小,溶液质量偏小,溶液浓度偏大,符合题意;D、配好溶液装入试剂瓶时,有少量洒出,溶液具有均一性,不影响溶液的浓度,不符合题意。故选C。
例5.(2021·湖北黄石市·中考真题)溶液在生产、生活中起着十分重要的作用。请回答(1)-(2)题。
(1)如图,在木块上滴几滴水,将装有某种固体的大烧杯放置于木块上,向大烧杯中加水进搅拌,结果木块上的水结冰了,则大烧杯内的固体可能是_______。
A .氯化钠 B. 硝酸铵
C. 氢氧化钠 D .蔗糖
(2)用汽油或加了洗涤剂的水都能除去衣服上的油污,两者去油污的原理分别是_______。
A. 乳化、乳化 B. 乳化、溶解
C. 溶解、乳化 D. 溶解、溶解
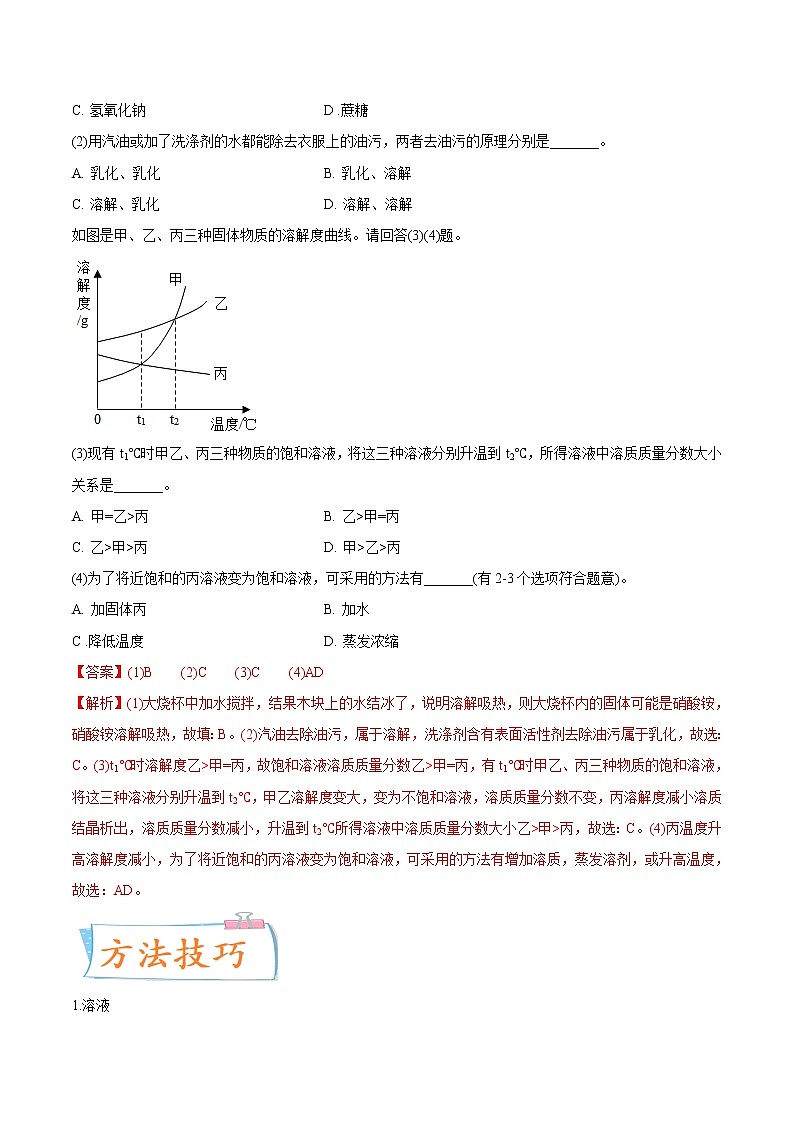
如图是甲、乙、丙三种固体物质的溶解度曲线。请回答(3)(4)题。
(3)现有t1℃时甲乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是_______。
A. 甲=乙>丙 B. 乙>甲=丙
C. 乙>甲>丙 D. 甲>乙>丙
(4)为了将近饱和的丙溶液变为饱和溶液,可采用的方法有_______(有2-3个选项符合题意)。
A. 加固体丙 B. 加水
C .降低温度 D. 蒸发浓缩
【答案】(1)B (2)C (3)C (4)AD
【解析】(1)大烧杯中加水搅拌,结果木块上的水结冰了,说明溶解吸热,则大烧杯内的固体可能是硝酸铵,硝酸铵溶解吸热,故填:B。(2)汽油去除油污,属于溶解,洗涤剂含有表面活性剂去除油污属于乳化,故选:C。(3)t1℃时溶解度乙>甲=丙,故饱和溶液溶质质量分数乙>甲=丙,有t1℃时甲乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,甲乙溶解度变大,变为不饱和溶液,溶质质量分数不变,丙溶解度减小溶质结晶析出,溶质质量分数减小,升温到t2℃所得溶液中溶质质量分数大小乙>甲>丙,故选:C。(4)丙温度升高溶解度减小,为了将近饱和的丙溶液变为饱和溶液,可采用的方法有增加溶质,蒸发溶剂,或升高温度,故选:AD。
1.溶液
定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
2.基本特征
均一性——指溶液中各部分的浓度和性质都相同。
稳定性——外界条件不变(温度、压强不改变,溶剂不蒸发)时,溶质、溶剂不分层,也不会析出固体。
溶液具有均一性、稳定性的原因:溶质以分子或离子的形式分散到水分子中。
溶液由两部分组成——溶剂和溶质。
3.(1)溶剂的定义:能溶解其他物质的物质叫做溶剂。
(2)溶质的定义:被溶解的物质叫做溶质。
(3)常见的溶剂有水、酒精、汽油。
(4)溶质可以有一种或多种,但溶剂只能有一种。
(5)溶质和溶剂在被分散前可以是固体、液体或气体。
(6)溶液、溶质、溶剂的质量关系:溶液的质量=溶质的质量+溶剂的质量
(溶液的体积≠溶质的体积+溶剂的体积)
(7)区分溶剂和溶质
(8)固体(或气体)与液体混合——固体(或气体)是溶质,液体是溶剂。
液体和液体混合——质量小的为溶质,质量大的为溶剂。如果其中一种液体是水,那么水是溶剂。
当两种物质完全反应后,新生成的物质是溶质,而析出的沉淀或产生的气体不是溶质,溶剂仍是水。
例如锌溶于稀硫酸后,所得到的溶液中的溶质是硫酸锌。
4.溶液的命名:“[溶质]的[溶剂]溶液”。如果没有指明溶剂,我们就认为水是溶剂。
水和酒精能以任意体积互溶,水为溶剂。
探究水与乙醇能否互溶时,要先滴入红墨水(目的:为了显色,利于观察)。
5.悬浊液、乳浊液与乳化作用
(1)悬浊液:由固体小颗粒分散到液体里形成的混合物叫做悬浊液。例如钡餐(硫酸钡的悬浊液)、粉刷墙壁用的涂料、黄河水都是悬浊液。
(2)乳浊液:由小液滴分散到液体里形成的混合物叫做乳浊液。
例如在农业上,一般把不溶于水的液体农药配制成乳浊液。
(3)悬浊液和乳浊液都不是溶液,不具备均一、稳定的特征。
洗涤剂具有乳化作用。用洗涤剂洗衣服时,油污没有溶解在水中,没有形成均一、稳定的溶液。
6.用洗涤剂和汽油洗衣服的区别:
汽油——用汽油洗衣服时,油污能溶解在汽油里,形成溶液,随着汽油挥发油污就能被带走。
洗涤剂——洗涤剂具有乳化作用,它能使油污分散成无数细小的液滴,随水流去。
7.溶解时的吸热或放热现象
扩散过程——溶质的分子(或离子)向水中扩散——吸收热量。
水合过程——溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子)——放出热量。
如果扩散过程吸收的热量小于水合过程放出的热量,溶液的温度就会升高。(例如氢氧化钠固体、浓硫酸)
如果扩散过程吸收的热量大于水合过程放出的热量,溶液的温度就会降低。(例如硝酸钾)
氯化钠等溶于水时,不会有明显的吸热、放热现象。
氧化钙与水反应放出大量的热。有的实验为了节省能源,可以采用氧化钙和水反应来提高温度。
9.饱和溶液与不饱和溶液
(1)定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液;还能继续溶解的溶液,叫做不饱和溶液。
(2)判断溶液是否饱和的方法:继续加入该种溶质,如果该物质的质量减少,那么溶液是不饱和溶液;如果该物质的质量不变,那么溶液是饱和溶液。
(3)由于水可以和酒精以任意比例互溶,所以水和酒精不可以形成饱和溶液。
(4)不饱和溶液与饱和溶液的转化
不饱和溶液
降温、恒温蒸发溶剂、加溶质
升温、加溶剂
饱和溶液
① 氢氧化钙和气体的溶解度随着温度升高而降低。所以若把氢氧化钙和气体的不饱和溶液变成饱和溶液,在改变温度时要升高温度。
② 最可靠的方法是蒸发溶剂、加溶质、加溶剂。
③ 若想把氢氧化钙的饱和溶液变成不饱和溶液,可以通入适量的二氧化碳并过滤。
④ 若想把氢氧化钙的不饱和溶液变成饱和溶液,也可以加入CaO并冷却。
⑤ 氢氧化钙不是晶体,从氢氧化钙溶液也不会析出晶体,所以只能称作“澄清的石灰水变浑浊”。
(5)浓、稀溶液与饱和、不饱和溶液之间的关系:
① 饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
② 在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓。
10.牢记下面的公式:
使用该公式时的注意事项:
溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不应考虑。(计算溶质质量时要考虑溶解度)
溶液的质量包括溶液中所有溶质的质量。
上下的单位要统一。
氯化钠溶液的质量分数为16%,“16%”的意义:每100份质量的氯化钠溶液中含16份质量的氯化钠。
11.配制一定溶质质量分数的溶液
用固体配制溶液
仪器:天平、药匙、量筒、胶头滴管、烧杯、玻璃棒。
步骤:计算、称量、溶解、装瓶贴标签。
12.用浓溶液稀释
仪器:量筒、胶头滴管、烧杯、玻璃棒。
步骤:计算、量取、稀释、装瓶贴标签。
标签一般包括药品的名称(化学式)和浓度。
13.溶液的稀释计算
稀释的方法:加入溶剂或加入低浓度溶液。
依据:稀释前后溶液中的溶质的质量不变。
14.关系式
① 加水稀释:浓溶液液质量×浓溶液溶质质量分数%=稀释后溶液质量×稀释后溶液质量分数%
浓溶液质量×浓溶液溶质质量分数%=(溶液质量+加入水的质量)×稀释后溶液质量分数%
② 加入低浓度溶液稀释:浓溶液质量×浓溶液溶质质量分数%+稀溶液质量×稀溶液溶质质量分数%=(浓溶液质量+稀溶液质量)×混合后所得溶液溶质的质量分数
溶液的混合计算
依据:混合前各溶液溶质的质量之和,等于混合后溶液中溶质的总质量。
已知的问题
① 如果用固体配制溶液时,固体带有结晶水(例如硫酸铜晶体),那么所得溶液的溶质质量分数会偏小。
② 量取液体时,如果仰视读数,量取的液体会偏少;如果俯视读数,量取的液体会偏多。
③ 用固体配制溶液时,天平未配平、物码颠倒等情况会影响溶液的溶质质量分数。
1.(2021·江苏苏州市·中考真题)下列有关溶液的说法正确的是( )
A.均一、稳定的液体都是溶液B.少量泥土与水混合能形成溶液
C.氢氧化钠溶液的导电性比水强D.浓硫酸与水混合会吸收大量热
【答案】C
【解析】A、均一、稳定的液体不一定是溶液,如水,水是均一、稳定的液体,但不是溶液,所以选项错误;B、泥土是难溶于水的物质,与水混合不能形成溶液,形成的是悬浊液,所以选项错误;C、水导电是因为水中有自由移动的氢离子和氢氧根离子,而氢氧化钠溶液中有自由移动的钠离子、氢氧根离子和氢离子,氢氧化钠溶液中自由移动离子多于水中的离子,所以导电性增加,所以选项正确;D、浓硫酸与水混合会释放出大量的热,所以选项错误;故选:C。
2.(2021·上海中考真题)对于t℃时的30%KNO3溶液,下列说法正确的是( )
A.均一、稳定、透明B.每100g水中溶解30gKNO3
C.某种条件下,可转化为悬浊液D.若再加30g硝酸钾,则变为60%KNO3溶液
【答案】AC
【解析】A、溶液的特性均一、稳定、透明澄清,故选项正确;B、100g水溶解30gKNO3,浓度为,故选项错误;C、通过降温或蒸发析出晶体,就是悬浊液,故选项正确;D、再溶解30g硝酸钾也得不到60%。故选:AC。
3.下列叙述正确的是( )
A.海水一经降温,就会有大量食盐晶体析出
B.加热蒸发硝酸钾溶液,开始时就会有大量硝酸钾晶体析出
C.硝酸钾的饱和溶液在改变外界条件时,不能溶解硝酸钾
D.将析出硝酸钾晶体后的溶液再冷却,仍然有硝酸钾晶体析出
【答案】D
【解析】A、氯化钠的溶解度受温度影响不大,所以降温不会有大量食盐晶体析出,错误;B、蒸发结晶不是一开始就析出晶体,要蒸发大量的水分后才能结晶析出晶体,错误;C、温度升高,硝酸钾的溶解度增大,升温后硝酸钾的饱和溶液能再继续溶解硝酸钾,错误;D、析出硝酸钾晶体后的溶液为硝酸钾的饱和溶液再冷却硝酸钾的溶解度减小还会析出硝酸钾晶体,正确。故选D。
4.下列有关叙述中,正确的是( )
A.20℃时,100g水中能溶解36gNaCl,所以20℃时NaCl的溶解度是36g
B.NaCl饱和溶液中加入大量水后,溶液中溶质的质量减少了
C.饱和溶液降温后,都有溶质结晶析出
D.溶液中各部分的密度相同
【答案】D
【解析】A.溶解度是在一定温度下,100克溶剂中达到饱和状态时所溶解的这种物质的质量,A中没说饱和,故错误;B.NaCl饱和溶液中加入大量水后,溶液中溶质的质量不变,溶剂、溶液质量增多,说法错误;C.饱和溶液降温后不一定都有溶质结晶析出,对于溶解度随温度升高而减小的物质来说就没有晶体析出,如氢氧化钙,说法错误;D.溶液是均一、稳定的混合物,溶液中各部分的密度相同,说法正确;故选D。
5.为了研究物质的溶解现象,设计并进行了如下实验,下列说法不正确的是 ( )
A.实验①中的固体溶解,形成紫红色溶液;实验②中的固体几乎不溶解
B.设计实验②、③的目的是比较高锰酸钾和碘在汽油中溶解情况
C.对比实验①、②可得出的结论是高锰酸钾在水中的溶解性比汽油中的好
D.实验说明不同物质在同一溶剂中溶解性是相同的,同一种物质在不同溶剂中溶解性也是相同的
【答案】D
【解析】做对比实验必须控制变量,当只有一个条件不同时,才可对比出该条件对实验是否有影响。A. 高锰酸钾易溶于水,不溶于汽油,故实验①中的固体溶解,形成紫红色溶液;实验②中的固体几乎不溶解,正确;B. 设计实验②、③的目的是比较高锰酸钾和碘在汽油中溶解情况,正确;C. 对比实验①、②可得出的结论是高锰酸钾在水中的溶解性比汽油中的好,正确;D. 实验说明不同物质在同一溶剂中溶解性是不相同的,同一种物质在不同溶剂中溶解性也是不相同的,错误。故选D。
6.将60℃的硫酸铜饱和溶液100克,冷却到20℃,下列说法正确的是( )
A.溶液质量不变B.溶剂质量发生变化
C.溶液为饱和溶液,浓度不变D.有晶体析出,溶剂质量不变
【答案】B
【解析】A、硫酸铜溶解度随温度的升高而增大,降温时溶液中会有晶体析出,溶质质量减小,选项A错误;B、温度降低时,硫酸铜溶解度减小,有晶体析出,析出晶体是CuSO4·5H2O,溶剂的质量减小,选项B正确;C、降温时溶液中会有晶体析出,溶质质量减小,溶剂的质量减小,浓度减小,选项C错误;D、降温时溶液中会有晶体析出,溶质质量减小,溶剂的质量也减小,选项D错误。故选B。
7.在一定温度下,将固体M加入到一定质量的液体N中,充分溶解,此过程中加入固体的质量与溶液质量的关系能用如图表示的是( )
A.只有①B.只有②③
C.只有③④D.只有②③④
【答案】C
【解析】①液体N不可能是蒸馏水,因为若是蒸馏水,溶液的质量开始时是0,不符合题意。②向饱和NaCl溶液中加入氯化钠,不能继续溶解,溶液的质量不变,不符合题意。③向不饱和NaCl溶液中加入氯化钠,能继续溶解,溶液的质量逐渐增加,至达到饱和状态,不再发生改变,符合题意。④向饱和KNO3溶液加入氯化钠,能继续溶解,溶液的质量逐渐增加,至氯化钠达到饱和状态,不再发生改变,符合题意。故③④符合图示变化。故选C。
1.(2021·辽宁中考真题)生活中的下列物质放入水中,能形成溶液的是( )
A.豆油B.面粉
C.蔗糖D.泥沙
【答案】C
【解析】A、豆油不溶于水,形成的是乳浊液,故A不符合题意;B、面粉不溶于水,形成的是悬浊液,故B不符合题意;C、蔗糖溶于水,可以形成溶液,故C符合题意;D、泥沙不溶于水,形成悬浊液,故D不符合题意;故选C。
2.(2021·宁夏中考真题)下列有关溶液的说法中,不正确的是( )
A.物质溶解过程中通常会伴随着热量的变化
B.在氯化钾溶液稀释的过程中,氯化钾的质量不变
C.在压强不变时,升高温度可以增大CO2在水中的溶解度
D.熟石灰的饱和溶液通过降低温度或者增加溶剂转化为不饱和溶液
【答案】C
【解析】A、物质溶解过程中通常会伴随着热量的变化,正确;B、在氯化钾溶液稀释的过程中,只是溶剂水的质量增加,氯化钾的质量不变,正确;C、气体的溶解度随温度的升高而减小,压强不变时,升高温度可以减小CO2在水中的溶解度,错误;D、熟石灰的溶解度随温度的增大而减小,故熟石灰的饱和溶液通过降低温度或者增加溶剂转化为不饱和溶液,正确;故选C。
3.(2021·吉林长春市·中考真题)把少量下列物质分别放入足量水中,充分搅拌,不能形成溶液的是( )
A.豆油B.食盐
C.白糖D.酒精
【答案】A
【解析】A、豆油不溶于水,只能以小液滴的形式悬浮于液体里,形成乳浊液,符合题意;B、食盐能溶于水,形成均一、稳定的溶液,不符合题意;C、白糖能溶于水,形成均一、稳定的溶液,不符合题意;D、酒精能与水以任意比例互溶,形成均一、稳定的溶液,不符合题意。故选A。
4.(2021·吉林长春市·中考真题)某实验小组用质量分数为6%的氯化钠溶液(密度约为1.04g/cm3)和水(密度约为1g/cm3)配制50g质量分数为3%的氯化钠溶液,下列说法错误的是( )
A.实验的主要步骤有计算、量取、混匀、装瓶贴标签
B.计算需要6%的氯化钠溶液的质量是25g(约24.0mL),水的质量是25g
C.实验中用到的玻璃仪器有量筒、试剂瓶、烧杯、玻璃棒、胶头滴管
D.配置好的溶液装入试剂瓶时有液体溅出,溶质的质量分数变小
【答案】D
【解析】A、用浓溶液配制稀溶液,实验步骤为:计算、量取、混匀、装瓶贴标签,不符合题意;B、需要6%的氯化钠溶液的质量是:50g×3%÷6%=25g,需要水的质量为:50g-25g=25g,不符合题意;
C、实验过程中需要用到的玻璃仪器有:量筒、胶头滴管、烧杯、玻璃棒、试剂瓶,不符合题意;D、配置好的溶液装入试剂瓶时有液体溅出,溶液具有均一性,溶质的质量分数不变,符合题意。故选D。
5.(2021·广东中考真题)实验室配制质量分数为6%的NaC1溶液,除托盘天平、玻璃棒、药匙、量筒、胶头滴管外,还需要的仪器是( )
A.烧杯B.酒精灯
C.铁架台D.蒸发皿
【答案】A
【解析】实验室配制质量分数为6%的NaC1溶液,步骤为计算、称量、溶解、装瓶存放,用到仪器除托盘天平、玻璃棒、药匙、量筒、胶头滴管外,还需要的仪器是烧杯,配置溶液,需要在烧杯中溶解,故选:A。
6.(2021·内蒙古通辽市·中考真题)水和溶液在生产生活中用途广泛,请回答下列问题。
(1)自来水厂在净化水的过程中加入明矾的作用是______(填“杀菌”或“使悬浮物沉淀”);水能灭火的主要原因是______。
(2)生活中的下列物质属于溶液的是______(填字母序号,下同)。
A.白酒B.豆浆C.糖水D.泥浆
(3)在2021年全国两会上,“蓝天、碧水净土保卫战”成为聚焦重点,下列符合这一目标的是______。
A.生活污水任意排放
B.工业废水坚持达标排放
C.大量使用农药和化肥,增加农作物产量
D.农业上改漫灌为滴灌
(4)t2℃时,向盛有10mL水的Ⅰ、Ⅱ两支试管中分别加入等质量的甲、乙两种固体,充分溶解后,观察到如图1所示的现象。图2是甲、乙两种固体的溶解度曲线。请回答:
①图2中表示甲物质溶解度曲线的是______(填“a”或“b”)。
②根据图2分析,下列说法正确的是:______。
A.乙中混有少量甲,可用降温结晶法提纯乙
B.等质量甲、乙饱和溶液由t2℃降温至t1℃,所得溶液溶质质量分数相等
C.升温可使甲的饱和溶液变为不饱和溶液
D.t1℃时,将20g甲物质加入50g水中充分溶解,得到70g溶液
【答案】(1)使悬浮物沉淀 降低温度至可燃物的着火点以下 (2)AC (3)BD (4)b A
【解析】(1)明矾溶于水形成的胶状物具有吸附性,可以吸附水中悬浮的杂质,使其沉降,故加入明矾的作用是:使悬浮物沉淀;水能灭火的原因是:降低温度至可燃物的着火点以下,达到灭火的目的;(2)A、白酒是均一、稳定的混合物,属于溶液,符合题意;B、豆浆属于乳浊液,不是溶液,不符合题意;C、糖水是均一、稳定的混合物,属于溶液,符合题意;D、泥浆属于悬浊液,不是溶液,不符合题意。故选AC;
(3)A、生活污水任意排放,会污染水源,不符合题意;B、工业废水坚持达标排放,可以减少污染物, 保护水源,符合题意;C、大量使用农药和化肥,增加农作物产量,会污染水源和土壤,应合理施用,不符合题意;D、农业上改漫灌为滴灌,可以节约用水,保护水资源,符合题意。故选BD;(4)①t2℃时,向盛有10mL水的Ⅰ、Ⅱ两支试管中分别加入等质量的甲、乙两种固体,乙能全部溶解,甲有部分溶质未溶解,说明t2℃时,溶解度:甲<乙,故图2中表示甲物质溶解度曲线的是b;②A、由图可知,乙的溶解度随温度的升高而增加,且溶解度受温度影响较大,甲的溶解度随温度的升高而减小,故乙中混有少量甲,可用降温结晶法提纯乙,符合题意;B、等质量甲、乙饱和溶液由t2℃降温至t1℃,降温后,乙的溶解度减小,还是饱和溶液,甲的溶解度增加,变为不饱和溶液,降温后,甲的溶质质量分数不变,t1℃时,乙的溶解度大于t2℃时,甲的溶解度,故t1℃时,乙的饱和溶液的溶质质量分数大于t2℃时,甲的饱和溶液的溶质质量分数,故降温后,所得溶液溶质质量分数:乙>甲,不符合题意;C、甲的溶解度随温度的升高而减小,降温可使甲的饱和溶液变为不饱和溶液,不符合题意;D、t1℃时,甲的溶解度为32g,该温度下,将20g甲物质加入50g水中充分溶解,只能溶解16g,得到50g+16g=66g溶液,不符合题意。
故选A。
1.某硝酸钾溶解实验过程如图所示,不考虑水分蒸发,判断错误的是( )
A.n中溶液是饱和溶液
B.n、p中溶液的溶质质量分数一定不同
C.p中溶液一定是不饱和溶液
D.p中溶液的溶质质量大于n中溶液的溶质质量
【答案】C
【解析】A、n中有部分固体未溶解,溶液是饱和溶液,此选项正确;B、n中溶质的质量少于p中溶质质量,则n中溶质质量分数小于p中溶质质量分数,此选项正确;C、p中溶液可能恰好是饱和溶液,此选项错误;
D、p中溶液的溶质质量大于n中溶液的溶质质量,此选项正确。故选C。
2.下列有关溶液的说法正确的是( )
A.溶液都是无色的B.溶液中只能含一种溶质
C.植物油加入水中可得到溶液D.溶液都是均一、稳定的混合物
【答案】D
【解析】A、溶液不都是无色的,如硫酸铜溶液是蓝色的。错误。B、溶液中可含多种溶质,如雪碧中就含有多种溶质。错误。C、植物油不溶于水,不能得到溶液。错误。D、溶液都是均一、稳定的混合物。正确。
故选D。
3.小明设计了趣味实验装置(见图),其气密性良好。若要使B中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是( )
A.氯化钠和水B.硝酸铵和水
C.铜和稀硫酸D.氧化钙和水
【答案】D
【解析】A、食盐和水接触,温度基本不变,也没有气体产生,不会有喷泉现象,选项说法错误,故不符合题意;B、硝酸铵溶于水,温度降低,A中气压减小,不会有喷泉现象,选项说法错误,故不符合题意;C、铜和稀硫酸不反应,没有喷泉现象,选项说法错误,故不符合题意;D、氧化钙和水反应,放出大量热,A中气压增大,有喷泉现象,选项说法正确,故符合题意,故选D。
4. 某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如图所示,下列分析正确的是( )
A.配制过程中出现了两处操作错误
B.实验操作步骤为计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏大
D.配制时应称量氯化钠固体质量为15g
【答案】A
【解析】A、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品的位置放反了;读取量筒内液体体积时,视线要与量筒内液体凹液面的最低处保持水平,图中是仰视读数,故配制过程中出现了两处操作错误,正确;B、配制50g质量分数为15%的氯化钠溶液,首先要计算所需氯化钠和水的质量,再称量氯化钠的质量和量取水的体积,最后进行溶解即可,错误;C、若所有操作都正确,完全溶解后有液滴溅出,溶质质量分数是不会发生变化的,错误;D溶质质量=溶液质量×溶质质量分数,则配制50g质量分数为15%的氯化钠溶液需要称量氯化钠的质量为50g×15%=7.5g,错误;故选A。
5.(2021·福建鼓楼·九年级一模)如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,下列溶液质量分数与蒸发过程描述正确的是( )
A.B.
C.D.
【答案】A
【解析】在①→②过程中,溶质质量不变,②中溶剂质量小,故②溶质质量分数大;②与③都是同温度下的饱和溶液,所以溶质质量分数应该相等,③→④升温蒸发水分,此时溶解度变大,溶质的质量分数④>③,A说法正确;故选A。
6.实验室要配制500 g 20%的稀硫酸,需98%的浓硫酸和水各( )
A.浓硫酸100 g、 水 400 gB.浓硫酸102 g、水398 g
C.浓硫酸100 mL 、水400 mLD.浓硫酸102 mL、水398 g
【答案】B
【解析】设:实验室要配制500g 20%的稀硫酸,需98%的浓硫酸的质量为x,根据溶液稀释前后,溶质的质量不变,则500g×20%=x×98%,解得x≈102g,需要水的质量为500g-102g=398g。故选B。
1.(2021·四川成都)将10g质量分数为98%的浓硫酸配制成10%的稀硫酸。有关步骤的说法正确的是
A.计算需水98gB.量取水时,仰视读数
C.将水注入浓硫酸中,并不断搅拌D.配制好后,装瓶贴标签
【答案】D
【解析】A、溶质质量=(10×98%)g=9.8g,10%=溶质质量÷溶液质量,溶液质量=(9.8÷10% )=98g,溶剂质量=(98-9.8)g=88.2g,不符合题意;B、量取水时,视线要与液体凹液面平齐,不符合题意;C、稀释浓硫酸时,应该浓硫酸加入水中,不符合题意;D、配制好后,装瓶贴标签,符合题意。故选D。
2.(2021·山东泰安)将20g溶质质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法错误的是( )
A.实验步骤:计算、量取、稀释、装瓶存放
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.溶液稀释:稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.事故处理:浓硫酸不慎沾到皮肤上,立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
【答案】C
【解析】A、将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸,步骤包括计算、量取、混匀、装瓶贴标签,故A正确;B、量取液体需要量筒、胶头滴管,混匀需要烧杯玻璃棒,装瓶存放在细口瓶需要细口瓶,故B正确;C、在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌。切不可将水倒进浓硫酸中。如果水倒进浓硫酸中,由于水的密度小,浮在硫酸的上面,硫酸溶解时放出的热量不易散失,使水暴沸,带着酸向四处飞溅,有可能发生意外,故C错误;D、浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液,故D正确。故选:C。
3.(2021·江苏连云港)向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.甲、丙烧杯中的溶液一定属于不饱和溶液
C.乙、丙烧杯中溶质的质量分数相等
D.蔗糖的溶解度随温度的升高而减小
【答案】A
【解析】A、对比乙丙图可知,升温固体溶解,可采用升温的方法使乙烧杯中剩余的固体溶解,A正确。B、溶液中没有固体不溶解,可能刚好饱和,也可能不饱和,B错误。C、乙、丙烧杯中溶剂质量相等,乙部分溶解,丙全部溶解,溶质的质量分数不相等,C错误。D、对比乙丙图可知,升温固体溶解,蔗糖的溶解度随温度的升高而增大,D错误。故选A。
4.(2021·云南中考真题)把少量下列物质分别放入水中,充分搅拌,可得到溶液的是( )
A.牛奶 B.面粉
C.花生油 D.葡萄糖
【答案】D
【解析】A、牛奶不能和水形成均一、稳定的混合物,牛奶和水形成的是乳浊液,错误;B、面粉不溶于水,不能和水形成均一、稳定的混合物,错误;C、花生油不溶于水即不能够形成溶液,错误;D、葡萄糖易溶于水,形成均一、稳定的混合物,属于溶液,正确。故选D。
5.(2021·湖北宜昌市·中考真题)下列物质加入水中搅拌,温度明显降低的是( )
A.硝酸铵B.生石灰
C.浓硫酸D.氢氧化钠
【答案】A
【解析】A、硝酸铵溶于水吸热,温度降低,符合题意;B、生石灰能与水反应生成氢氧化钙,放出大量的热,不符合题意;C、浓硫酸溶于水,放出大量的热,不符合题意;D、氢氧化钠溶于水,放出大量的热,不符合题意。故选A。
6.(2021·湖南株洲市·中考真题)下列关于溶液的说法中正确的是( )
A.溶液一定是混合物
B.溶液一定是无色透明的
C.溶液中只能含有一种溶质
D.常温下蔗糖的水溶液密封放置一段时间后会析出固体
【答案】A
【解析】A、一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。因此溶液一定是混合物,选项A正确;B、溶液不一定是无色透明的,如硫酸铜溶液呈蓝色,选项B不正确;C、溶液中的溶质可以是一种,也可以是两种或两种以上,如医院里的生理盐水中只含有氯化钠一种溶质,但葡萄糖氯化钠注射液中就含有葡萄糖和氯化钠两种溶质,选项C不正确;D、溶液是稳定的,只要条件不改变,溶液的组成就不会发生变化,因此常温下蔗糖的水溶液密封放置一段时间后不会析出固体,选项D不正确。故选A。
7.(2021·江西省卷)用氯化钠固体配制50g 质量分数为6%的溶液,不需要用到的仪器是( )
A.B.
C.D.
【答案】C
【解析】用氯化钠固体配制50g 质量分数为6%的溶液,操作步骤分别是:计算、称量、量取、溶解,称量固体用天平,量取水用量筒,溶解时需要玻璃杯、玻璃棒;不需要用到试管。故选C。
8.(2021·山东泰安)下列洗涤方法主要利用了物质化学性质的是( )
A.无水酒精擦洗手机屏幕B.食醋洗去水壶内的水垢
C.清水洗涤衣服上的泥土D.汽油清洗工具上的油污
【答案】B
【解析】A、无水酒精擦洗手机屏幕,是因为酒精能溶解油污,溶解性属于物理性质,不符合题意;B、食醋洗去水壶内的水垢,是因为醋酸能与氢氧化镁、碳酸钙发生反应,利用的是化学性质,符合题意;C、清水洗涤衣服上的泥土,不需要通过化学变化表现出来,利用的是物理性质,不符合题意;D、汽油清洗工具上的油污,是因为汽油能溶解油污,溶解性属于物理性质,不符合题意。故选B。
9.(2021·湖南岳阳市·中考真题)实验室配制50g质量分数为3%的NaCl溶液,操作示意图如下、请回答:
(1)图中使用到的玻璃仪器有______、量筒、玻璃棒、广口瓶四种。
(2)图示中正确的操作顺序为______(填序号)。
(3)溶解时用玻璃棒搅拌的目的是______。
(4)取10g配制好的质量分数为3%的NaCl溶液,稀释成质量分数为1%的NaCl溶液,需加水______g。
【答案】烧杯 ②①⑤③④ 加速溶解 20
【解析】(1)图中使用到的玻璃仪器有烧杯、量筒、玻璃棒、广口瓶四种。(2)实验室配制50g质量分数为3%的NaCl溶液步骤为计算、称量、溶解,图示中正确的操作顺序为②①⑤③④。(3)溶解时用玻璃棒搅拌的目的是加速溶解。(4)溶液加水稀释前后溶质质量不变,10g质量分数为3%的NaCl溶液,稀释成质量分数为1%的NaCl溶液质量为,10g×3%÷1%=30g,故需加水30g-10g=20g。
10.(2021·重庆市)将一定量的下列固体放入适量水中,能形成溶液且温度明显升高的是( )
A.CaCO3B.NaOH
C.NaClD.NH4NO3
【答案】B
【解析】A、碳酸钙不溶于水,不能形成溶液,故选项错误;B、氢氧化钠溶于水放出大量的热,溶液温度升高,故选项正确;C、氯化钠溶于水温度变化不大,故选项错误;D、硝酸铵溶于水时吸收热量,溶液温度降低,故选项错误。故选:B。
11.(2021·湖南永州市·中考真题)氯化钠是生产、生活中的一种重要化合物,应用很广泛。
Ⅰ.下面图甲和图乙分别是钠原子和氯原子的原子结构示意图。
(1)图甲中的x=_______。
(2)金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的1个电子,从而形成最外层有_______个电子的相对稳定的氯离子,氯离子用化学符号表示为_______。
Ⅱ.下表是氯化钠在不同温度下的溶解度数据。
(1)30℃时,将10g氯化钠加入到50g水中,充分搅拌后,所得到的氯化钠溶液属于_______(填“饱和”或“不饱和”)溶液。
(2)医用盐水(溶质为NaC1)的溶质质量分数为0.9%,现有200mL该盐水(假定该溶液的密度为1g/mL),其中含NaCl的质量为_______g。
(3)学生化学实验活动之一:配制50g质量分数为6%的氯化钠溶液,该实验需要的仪器有药匙、托盘天平、玻璃棒、胶头滴管、_______(从下列图中选择写出名称)。
Ⅲ.工业上常用电解饱和食盐水的方法来制取氢氧化钠、氯气和氢气,其化学反应方程式可表示为:,若w=v=1,那么x=y=z=_______(填数字)。
【答案】1 8 Cl- 不饱和 1.8 烧杯、量筒 2
【解析】Ⅰ.(1)原子中,质子数=核外电子数,故11=2+8+x,x=1;(2)氯原子的最外层电子数为7,大于4,在化学反应中,容易得到钠失去的1个电子,从而形成最外层有8个电子的相对稳定结构氯离子;
离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故氯离子表示为:Cl-;Ⅱ.(1)30℃时,氯化钠的溶解度为36.3g,该温度下,将10g氯化钠加入到50g水中,充分搅拌后,能全部溶解,得到的是不饱和溶液;(2)含氯化钠的质量为:200mL×1g/mL×0.9%=1.8g;(3)用固体配制一定溶质质量分数的溶液,实验步骤及所需仪器有:计算、称量(托盘天平、药匙)、量取(量筒、胶头滴管)、溶解(烧杯、玻璃棒)、装瓶贴标签,故还需要量筒、烧杯;Ⅲ.若w=v=1,根据质量守恒定律,化学反应前后,原子的种类和数目不变,生成物中含2个Cl,故氯化钠的系数为2,从而得出氢氧化钠的系数为2,生成物中含4个H,故水的系数为2,故x=y=z=2。
12.(2021·湖北武汉市·中考真题)下表是氯化钠和硝酸钾在不同温度下的溶解度。
请回答下列问题:
(1)30℃时,硝酸钾的溶解度为_______。
(2)使硝酸钾饱和溶液变为不饱和溶液,可采用的一种方法是_______。
(3)50℃时,将80.0g一定质量分数的氯化钠溶液恒温蒸发,溶液的质量随蒸发水的质量变化关系如下图所示,则a点溶液中溶质的质量为_______。
(4)下列有关说法正确的是_______(填标号)。
A 与氯化钠相比,硝酸钾的溶解度受温度影响较大
B 除去硝酸钾中混有的氯化钠,可采用降温结晶的方法
C 20℃时,向40.0g质量分数为25%的氯化钠溶液中加入10.0g氯化钠,可得到40%的氢化钠溶液
D 40℃时,分别向氯化钠和硝酸钾的饱和溶液中加入等量的水,所得溶液的质量分数可能相等
【答案】45.8g 加溶剂/水(或“升温”“加KNO3的不饱和溶液”等) 18.5g ABD
【解析】(1)由表可知,30℃时,硝酸钾的溶解度为45.8g;(2)硝酸钾的溶解度随温度的升高而增加,故使硝酸钾饱和溶液变为不饱和溶液,可采用的一种方法是:升高温度或增加溶剂;(3)由图可知,a点以后,继续蒸发溶剂,溶液的质量减少幅度变大,说明a点以后,有溶质析出,a点恰好达到饱和,a点时,溶液质量为:80.0g-11.5g=68.5g,50℃时,氯化钠的溶解度为37.0g,该温度下,68.5g饱和溶液中溶质的质量分数为:;(4)A、由表中数据可知,与氯化钠相比,硝酸钾的溶解度受温度影响较大,符合题意;B、硝酸钾、氯化钠的溶解度都随温度的升高而增加,硝酸钾的溶解度受温度影响较大,氯化钠额溶解度受温度影响较小,故除去硝酸钾中混有的氯化钠,可采用降温结晶的方法,符合题意;C、 20℃时,氯化钠的溶解度为36.0g,40.0g质量分数为25%的氯化钠溶液中溶质质量为:40.0g×25%=10g,溶剂质量为30g,该温度下,30g水中最多能溶解10.8g氯化钠,故加入10.0g氯化钠,只能继续溶解0.8g,得到的是饱和溶液,得到饱和溶液的溶质质量分数为:,不符合题意;D、 40℃时,分别向氯化钠和硝酸钾的饱和溶液中加入等量的水,由于溶液的质量不确定,可能会出现溶液的质量分数相等的情况,符合题意。故选ABD。
编号
固体M
液体N
①
NaCl
蒸馏水
②
NaCl
饱和NaCl溶液
③
NaCl
不饱和NaCl溶液
④
NaCl
饱和KNO3溶液
温度/℃
0
10
20
30
40
50
60
70
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
温度/℃
0
10
20
30
40
50
溶解度/g
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
相关试卷
这是一份初中化学中考复习 考点32 溶液的浓度和溶液的配制-备战2022年中考化学一轮复习考点帮(原卷版),共17页。试卷主要包含了 有关溶液中溶质质量分数的计算, 配置一定溶质质量分数的溶液,5)、B等内容,欢迎下载使用。
这是一份初中化学中考复习 考点32 溶液的浓度和溶液的配制-备战2022年中考化学一轮复习考点帮(解析版),共27页。试卷主要包含了 有关溶液中溶质质量分数的计算, 配置一定溶质质量分数的溶液,5)、B,5g,故D错误,6%,5g,D错误等内容,欢迎下载使用。
这是一份备战2023年新中考二轮化学专题导练 考点32 溶液的浓度和溶液的配制,文件包含备战2023年新中考二轮化学专题导练考点32溶液的浓度和溶液的配制解析版doc、备战2023年新中考二轮化学专题导练考点32溶液的浓度和溶液的配制原卷版doc等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。








