

科粤版九年级下册第九章 现代生活与化学9.2 化学合成材料精练
展开
这是一份科粤版九年级下册第九章 现代生活与化学9.2 化学合成材料精练,共14页。试卷主要包含了单选题,综合应用题等内容,欢迎下载使用。
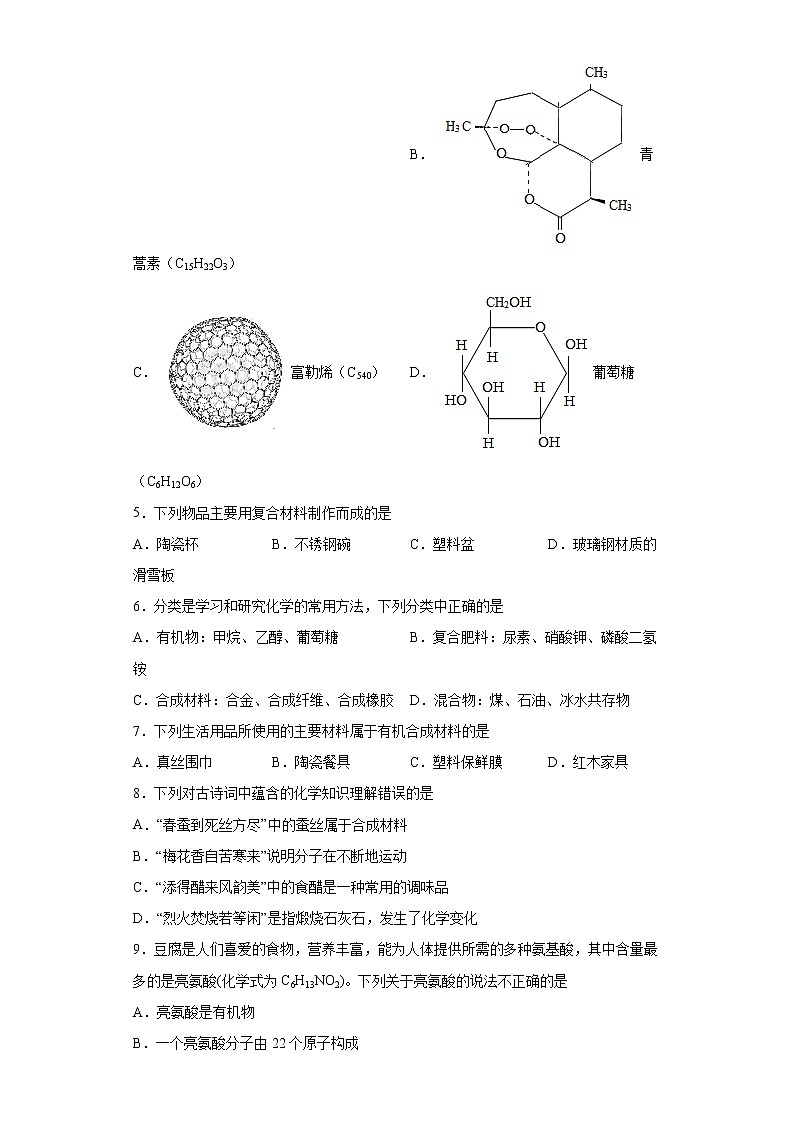
科粤版九年级化学下册 9.2 化学合成材料 同步练习一、单选题1.某牛仔裤标签如图所示。下列说法不正确的是A.棉纤维透气性较好B.聚酯纤维是合成纤维C.合成纤维耐磨性较差D.用灼烧的方法可区分棉纤维与聚酯纤维2.下列生活用品中属于有机合成材料的是A.纯棉毛巾B.塑料袋C.蚕丝被D.不锈钢餐具3.下列实验方案不能达到目的是A.用Na2SO4除去NaCl中的BaCl2B.用点燃的方法鉴别涤纶和羊毛绒C.用点燃的方法除去CO2中的COD.用水鉴别NH4NO3和NaOH固体4.下列物质不属于有机化合物的是A.乙醇(C2H6O) B. 青蒿素(C15H22O3)C. 富勒烯(C540) D. 葡萄糖(C6H12O6)5.下列物品主要用复合材料制作而成的是A.陶瓷杯 B.不锈钢碗 C.塑料盆 D.玻璃钢材质的滑雪板6.分类是学习和研究化学的常用方法,下列分类中正确的是A.有机物:甲烷、乙醇、葡萄糖 B.复合肥料:尿素、硝酸钾、磷酸二氢铵C.合成材料:合金、合成纤维、合成橡胶 D.混合物:煤、石油、冰水共存物7.下列生活用品所使用的主要材料属于有机合成材料的是A.真丝围巾 B.陶瓷餐具 C.塑料保鲜膜 D.红木家具8.下列对古诗词中蕴含的化学知识理解错误的是A.“春蚕到死丝方尽”中的蚕丝属于合成材料B.“梅花香自苦寒来”说明分子在不断地运动C.“添得醋来风韵美”中的食醋是一种常用的调味品D.“烈火焚烧若等闲”是指煅烧石灰石,发生了化学变化9.豆腐是人们喜爱的食物,营养丰富,能为人体提供所需的多种氨基酸,其中含量最多的是亮氨酸(化学式为C6H13NO2)。下列关于亮氨酸的说法不正确的是A.亮氨酸是有机物B.一个亮氨酸分子由22个原子构成C.亮氨酸中碳元素的质量分数为27.3%D.亮氨酸中氢、氮两种元素的质量比为13:1410.在①酸雨;②水体富营养化;③温室效应;④白色污染等环境问题中,其中由化石燃料燃烧造成的是( )A.①③ B.②④ C.①③④ D.①②③④11.下列物质分类正确的是A.碱:碱式碳酸铜、碳酸 B.营养物质:水、无机盐C.盐:碳酸氢钠、氢氧化钠 D.有机合成材料:塑料、碳纤维12.下列物品主要用有机合成材料制成的是A.塑料水杯B.纯棉衬衫C.羊毛围巾D.不锈钢盆13.东汉时期的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品。其制作材料属于A.合成材料B.天然材料C.金属材料D.复合材料14.下列物品主要是由合金制成的是( )A.塑料水杯 B.青铜铸像 C.汽车轮胎 D.羊毛大衣15.下列鉴别物质所用试剂或方法不正确的是A.稀硫酸与稀盐酸:加碳酸钠 B.CO2 与 O2:燃着的木条C.棉线与羊毛线:点燃后闻气味 D.KNO3 和NH4NO3:加熟石灰16.化学在健康、能源、材料、生活等方面有广泛的应用。下列说法正确的是A.装修材料挥发出来的甲醛对人体有害B.化石燃料属于可再生能源,太阳能、风能、氢能属于新能源C.合成材料包括塑料、合金和合成橡胶D.涤纶衣服的优点是吸湿性、透气性好二、综合应用题17.金属在生产、生活中有广泛的应用,认识金属的性质有利于我们更好地利用金属。(1)用铜制作导线是利用铜的________性。(2)“共享单车”是指在公共场所提供共享服务的自行车,由于符合“低碳出行”的理念,颇受年轻人的喜爱。①“低碳出行”中“低碳”指的是较低的 _________气体排放(填化学式);②采用实体轮胎的“共享单车”可有效防止爆胎。而普通自行车夏天易爆胎,请用分子的观点解释“夏天易爆胎”的原因______________________________;③扫描二维码可以租用“共享单车”,二维码的制作材料一般是用 PVC 不干胶贴纸。PVC材料是属于 _________。(填字母)A.复合材料 B.合成材料 C.金属材料 D.天然材料(3)化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:下列说法正确的是__________;A.固体丙中一定只含有银 B.四种金属的活动性顺序由强到弱的是Zn、X、Cu、AgC.滤液C中一定含有硝酸铜 D.固体甲中一定含有Cu和Ag,可能含有X(4)已知:铝在常温下能与O2反应,在铝表面形成一层氧化物薄膜;Al2O3能溶于NaOH溶液。某课外小组对“铝与氯化铜溶液反应”进行如下探究。①测得CuCl2溶液的pH<7;②将铝片放入CuCl2溶液中,没有观察到现象;③取出铝片用NaOH溶液浸泡一段时间,再取出铝片洗净后放入CuCl2溶液中,观察到铝表面产生大量气泡。请回答下列问题:a.步骤①观察到CuCl2溶液呈_______ 色,该溶液显_____性。(选填“酸”、“碱”或“中”)b.步骤②中没有现象的原因是________________________。c.步骤③中还可能观察到的现象是 _____________,产生此现象的化学方程式是________。 d.小组对步骤③产生的气体这一异常现象进行猜想、实验。其中有价值的是_____。A.甲同学推测气体是氢气并检验 B.乙同学认为气体是氨气并检验C.丙同学认为这与本实验无关,无需研究(5)镁铝合金是汽车制造中的重要材料之一。为测定某镁铝合金(只含镁、铝两种元素)的组成成分,某学习小组取1.8g合金粉末加入过量的质量分数为7.3%的盐酸中,充分反应后所得氢气的质量可能是__。A.0.1克 B.0.18克 C.0.2克 D.0.35克(6)若要配制20 g上述质量分数为7.3%的盐酸需要36.5%的浓盐酸和水的质量比为________。(写出计算过程,结果为最简整数比)18.见证中国力量,实现民族复兴(1)中国“嫦娥四号”登月探测器首次在月球背面软着陆。“嫦娥四号”月球探测器首次证实构成月幔的主要物质之一是Fe2SiO4,Fe2SiO4从物质的分类上属于______(填“氧化物”或“酸”或“碱”或“盐”)。“嫦娥四号”月球探测器中使用了大量材料如铝合金、高效吸能合金、有机高分子薄膜、玻璃钢等,这些材料中属于复合材料的是______;铝合金的优点是______(写一条即可)。(2)12月11日上午,由我国自主设计的世界首座高速铁路悬索桥一五峰山长江大桥正式通车。建设者采用了一系列国内自主生产的新材料,获得20余项专利,创造了多项纪录,代表着中国乃至世界同类型桥梁建设的最高水平。请根据材料及所学知识回答下列问题:①高速铁路离不开无缝钢轨,无缝钢轨表面有防锈涂漆,起到防锈的作用。铁生锈是铁与空气中的______、______共同作用的结果。下列实验组合能够达到验证上述结论目的的是______。A.②③ B.①②③ C.②③⑤ D.②③④②工人师傅在焊接钢铁制品时,通常先用稀盐酸清洗铁制品表面的铁锈,该反应的化学方程式为______,基本反应类型为______反应。(3)1926年我国科学家侯德榜创立侯氏制碱法,以饱和食盐水、二氧化碳、氨气等为主要原料制取纯碱,大大提高了食盐的利用率,促进了世界制碱技术的发展。Na2CO3和NH4C1的溶解度曲线如图所示,请回答下列问题: ①根据如图所示,写出P点表示的意义______(写出一条即可)。②t1℃时,50g水中加入15gNa2CO3固体,经充分搅拌后,所得溶液的质量为______g。③t1℃时,将不同质量的NH4C1饱和溶液和Na2CO3饱和溶液均升温至t2℃。此时,NH4C1溶液的溶质质量分数______Na2CO3溶液的溶质质量分数(填写“大于”、“等于”、“小于”之一)。④氯化铵是一种常用的化肥。下列有关化肥与农药的说法中,不正确的是______。A.铵态氮肥与碱性物质混合使用会降低肥效B.波尔多液(主要成分是硫酸铜)是常用的农药,可用铁桶盛放C.开发研制和推广使用新型高效、低毒、低残留的农药D.大棚种植中常用二氧化碳作为气态肥料19.金属及其化合物在生产生活中有广泛的应用。(一)金属的应用和防护(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于___________________材料。(2)航空煤油是飞机的燃料,它主要是由___________炼制的。(3)铁易生锈,提出防止铁生锈的一种方法__________。(4)特种钢中含有少量。和粉混合在高温下反应可得到,该反应的化学方程式为_______.(5)受热分解生成高熔点的。可用作阻燃剂,其主要原理是__________(选填序号)。a 分解吸热,降低可燃物着火点 b 覆盖燃烧物,隔绝氧气(二)制备还原性铁粉实验室利用废铁屑(含少量)为原料制备还原性铁粉的流程如下:(1)粉可使“酸溶”产生的转化为,该反应的化学方程式为_________.(2)检验已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加_______溶液,无明显现象。(3)“干燥”时有少量发生下列转化:,该转化的化学方程式为____________________.(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是_______________.(三)测定还原性铁粉的组成还原性铁粉中含有少量,小组同学在老师的指导下进行以下实验。资料:①在加热时与反应能生成相应氧化物。②不与酸反应。实验1:取样品,加入足量稀,充分反应后生成。实验2:另取样品,按下图进行实验。表:装置A和B的质量变化装置AB反应前300.00400.00反应后m400.44 实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。(1)装配好装置后,实验前先要_____________________________(2)装置C的作用是____________________________________(3)中,___________。表中m的值是____________.反思:若用空气替代进行实验,测得的值偏小,可能的原因是___________。20.华裔科学家高锟因提出“以高纯度的石英玻璃制造光纤”,获得2009年诺贝尔奖。从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料。回答问题:(1)地壳里各种元素的含量(质量分数)如图所示,其中表示Si元素的含量为_____。(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4。常温下,硅的化学性质______(填“活泼”或“不活泼”)。(3)制备硅半导体材料必须先得到高纯硅,工业上以石英砂(主要成分SiO2)制取高纯度石英玻璃的生产原理如下。请回答:①已知反应①的另一产物是有毒气体,其化学式为____,此副产物的用途是_______。②已知反应②为化合反应,该反应的化学方程式为________________。③反应③的化学方程式为SiCl4+O2SiO2+2Cl2,该反应的基本类型为______。④将反应③中的氧气换成氢气,可制得生产计算机芯片的高纯硅,则另一产物的化学式为_____。21.化学是造福人类的科学,请利用所学知识回答下列问题。(1)新型材料有着广泛的应用。应用“蛟龙”号深潜器“神舟”五号宇航员航天服 新型水处理剂 用到的材料 特种钢 高强度涤纶纳米铁粉 ①上述材料中属于有机合成材料的是______。②纳米铁粉能吸附废水中的某些污染物,被吸附后的废水经沉降、过滤可去除污染物。下列物质也能因吸附而具有净水作用的是______(填字母)a.生石灰 b.活性炭 c.纯碱(2)溶液与人们的生产生活密切相关,图1为甲、乙、丙三种固体物质的溶解度曲线。①t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是______。②某同学按图2所示进行实验,得到相应温度下的A、B、C三种溶液,其中属于饱和溶液的是______(填字母)。③t3℃时向盛有40g甲物质的烧杯中加入50g水充分溶解后,所得溶液溶质的质量分数为______。(结果精确到0.1%)22.(一)铁材料的有关知识(1)人类使用金属先后经历了“青铜”、“铁器”时代,到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是_______。(2)铁与铬(Cr)、镍(Ni)等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料。以上叙述中不涉及到_______(选填序号)。A 合金 B 无机非金属材料 C 合成材料 D 复合材料(3)在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_______。(4)钢铁露置在空气中易生锈,写出一种防止钢铁生锈的方法_______。以下是同学对铁锈的成分、铁锈制草酸亚铁晶体及草酸亚铁晶体热分解的研究。(二)用上述铁锈制草酸亚铁晶体(FeC2O4·nH2O)资料:①FeSO4遇到氧气氧化,会转化为Fe2(SO4)3②FeSO4的溶解度如下表:温度/℃010 305060708090溶解度/g14.017.025.033.035.333.030.527.0 【制备流程】(1)溶液加入过量铁粉,发生的反应有:Fe+Fe2(SO4)3=3FeSO4、_______。充分反应后要趁热过滤的目的是_______。(2)流程中产生草酸亚铁晶体反应的化学方程式为_______。(3)制备过程中,溶液中通入氮气的作用是_______。(三)探究FeC2O4·nH2O热分解的产物及n的值【实验装置】资料:①FeC2O4·nH2O为淡黄色粉末;FeO和Fe3O4都是黑色固体,其中FeO易被氧气氧化。②FeC2O4·nH2O加热至300℃完全失去结晶水;继续加热至400℃,剩余固体受热分解产生黑色固体、CO2和CO。【实验分析】(1)若通过E装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解产生CO,则需在B和C装置之间增加盛有_______(填试剂名称)的洗气瓶。(2)先鼓入氮气,再加热分解装置的原因是_______。(3)指出上述实验装置不足之处_______。(4)取3.60gFeC2O4·nH2O,按上述实验步骤进行实验,测得热分解装置中固体质量随温度变化曲线如下图所示:①FeC2O4·nH2O中n的值为_______。②反应后,热分解装置中残留的黑色物质为_______(填化学式)③草酸亚铁晶体受热分解的方程式为_______。④若将图中1.44g固体在空气中充分加热,固体增加0.16g,此固体(铁的氧化物)为_______。
参考答案:1.C2.B3.C4.C5.D6.A7.C8.A9.C10.A11.B12.A13.C14.B15.A16.A17. 导电 CO2 分子间有间隔,受热后分子间间隔变大 B BC 蓝 酸 铝在常温下与氧气反应,在铝表面形成一层氧化薄膜,阻止内层的铝与CuCl2溶液反应 有红色固体生成 2Al+3CuCl2=2AlCl3+3Cu A B. 1︰418. 盐 玻璃钢 硬度大(或抗腐蚀性能好) 氧气(或O2) 水蒸气(或H2O) B 复分解 t2℃时Na2CO3(或NH4Cl)的溶解度为40g(或t2℃时Na2CO3和NH4Cl的溶解度相同) 60 大于 B19. 复合 石油 涂油、喷漆等 4Al+3MnO22Al2O3+3Mn b Fe2(SO4)3+Fe=3FeSO4 氯化钡(或硝酸钡)溶液 4FeCO3+2H2O+O2=4FeOOH+4CO2 增大接触面积,加快反应速率,提高产物的质量和产量 检验装置的气密性 阻止空气中的水和二氧化碳进入B装置,避免影响实验准确性 5:2 312.48 空气中存在的二氧化碳被B装置吸收20. 26.30% 不活泼 CO 用于冶金工业或气体燃料 Si+2Cl2SiCl4 置换反应 HCl21. 高强度涤纶 b 丙>乙>甲 B 33.3%22. Al>Fe>Cu B 刷漆、涂油等 防止FeSO4因结晶而造成损失 或 防止FeSO4氧化成Fe2(SO4)3 氢氧化钠溶液( 或澄清石灰水) 排出装置内原有气体,防止产生干扰 没有进行尾气处理 2 FeO Fe2O3
相关试卷
这是一份初中化学科粤版九年级下册9.2 化学合成材料综合训练题,共8页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。
这是一份初中化学科粤版九年级下册9.2 化学合成材料综合训练题,共10页。试卷主要包含了单选题,判断题,填空题,综合应用题等内容,欢迎下载使用。
这是一份初中科粤版第九章 现代生活与化学9.2 化学合成材料课时训练,共10页。










