

2022重庆市西南大学附中高三上学期第四次月考试题化学含答案
展开西南大学附属中学校高2022届第四次月考
化学试题
(满分:100分;考试时间:75分钟)
2021年12月
注意事项:
1.答题前,考生先将自己的姓名、班级、考场/座位号、准考证号填写在答题卡上。
2.答选择题时,必须使用2B铅笔填涂;答非选择题时,必须使用0.5毫米的黑色签字笔书写;必须在题号对应的答题区域内作答,超出答题区域书写无效;保持答卷清洁、完整。
3.考试结束后,将答题卡交回(试题卷学生留存,以备评讲)。
可能用到的相对原子质量: H 1 Li 7 C 12 O 16 F 19 P 31 Cl 35.5 Mn 55
Cu 64 Sn 119 Sb 122
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与科学、技术、社会和环境密切相关,下列说法错误的是
A.二氧化硅用作太阳能电池板的主要材料
B.电池长期不彻底充放电,会使电池容量降低
C.地沟油经过加工处理后可用来制生物柴油和肥皂
D.铝制餐具不宜用来长时间存放酸性、碱性或咸的食物
2. 下列化学用语或模型正确的是
A.CO2的电子式: B.P4的空间结构:
C.Al3+的结构示意图: D.CH3CHO的比例模型:
3. 设NA为阿伏加德罗常数的值,下列说法正确的是
A.46 g乙醇中含有碳氢键的数目为6 NA
B.2.24 L SO2与1.12 L O2催化反应后分子总数为0.1 NA
C.将1 mol NH4NO3溶于稀氨水中使溶液呈中性,则溶液中NH4+的数目为NA
D.向沸水中滴加10 mL 1 mol/L FeCl3溶液,可制得0.01 NA个Fe(OH)3胶体微粒
4. 下列实验设计正确的是
A.利用盐析可以分离提纯蛋白质
B.用酸性高锰酸钾溶液可鉴别甲苯和苯甲醇
C.用氢氧化钠溶液除去溶在乙酸乙酯中的乙醇和乙酸
D.向淀粉和稀硫酸共热后的溶液中加入银氨溶液,检验淀粉是否水解
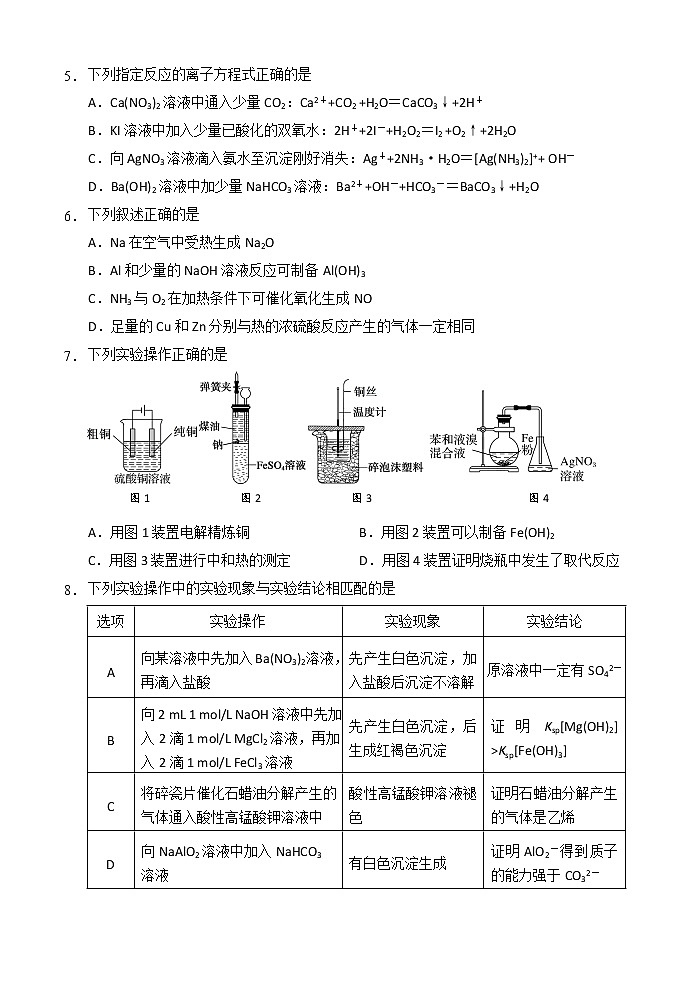
5. 下列指定反应的离子方程式正确的是
A.Ca(NO3)2溶液中通入少量CO2:Ca2++CO2 +H2O=CaCO3↓+2H+
B.KI溶液中加入少量已酸化的双氧水:2H++2I-+H2O2=I2 +O2↑+2H2O
C.向AgNO3溶液滴入氨水至沉淀刚好消失:Ag++2NH3·H2O=[Ag(NH3)2]++ OH-
D.Ba(OH)2溶液中加少量NaHCO3溶液:Ba2++OH-+HCO3-=BaCO3↓+H2O
6. 下列叙述正确的是
A.Na在空气中受热生成Na2O
B.Al和少量的NaOH溶液反应可制备Al(OH)3
C.NH3与O2在加热条件下可催化氧化生成NO
D.足量的Cu和Zn分别与热的浓硫酸反应产生的气体一定相同
7. 下列实验操作正确的是
图1 图2 图3 图4
A.用图1装置电解精炼铜 B.用图2装置可以制备Fe(OH)2
C.用图3装置进行中和热的测定 D.用图4装置证明烧瓶中发生了取代反应
8. 下列实验操作中的实验现象与实验结论相匹配的是
选项
实验操作
实验现象
实验结论
A
向某溶液中先加入Ba(NO3)2溶液,再滴入盐酸
先产生白色沉淀,加入盐酸后沉淀不溶解
原溶液中一定有SO42-
B
向2 mL 1 mol/L NaOH溶液中先加入2滴1 mol/L MgCl2溶液,再加入2滴1 mol/L FeCl3溶液
先产生白色沉淀,后生成红褐色沉淀
证明Ksp[Mg(OH)2] >Ksp[Fe(OH)3]
C
将碎瓷片催化石蜡油分解产生的气体通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
证明石蜡油分解产生的气体是乙烯
D
向NaAlO2溶液中加入NaHCO3
溶液
有白色沉淀生成
证明AlO2-得到质子的能力强于CO32-
9. 硝苯地平是一种治疗冠心病、心绞痛和高血压的常见药,其分子结构如图所示。下列说法错误的是
A.分子式为C17H18N2O6
B.该化合物的一氯取代有8种
C.1 mol该化合物最多可与8 mol H2发生加成反应
D.该化合物可以发生氧化反应、还原反应、取代反应、加成反应
10. 最近科学家设计出了LFP(Li1-xCoO2)-H2可充电电池,是由Pt/C催化剂作为负极材料和Li1-xCoO2为正极材料组成,Li2SO4、LiOH为电解质溶液,该电池工作原理如图所示。下列说法正确的是
A.放电时,Li+向负极区迁移
B.充电时,阳极的电极反应为LiCoO2–xe-=Li1-xCoO2 + xLi+
C.放电时,电子由负极经导线、正极、电解质溶液回到负极
D.充电时,若Pt/ C电极产生0.1 mol气体,Li1-xCoO2正极材料将减少1.4x g
11. 已知:2H2O(l)=2H2(g) + O2(g) ∆H=+571.0 kJ/mol,以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程I:2Fe3O4(s)=6FeO (s) + O2(g) ∆H=+313.2 kJ/mol
过程II:……
下列说法错误的是
A.过程I中每生成3molFeO,转移2mol电子
B.整个过程中能量转化形式只存在太阳能转化为化学能
C.利用该方法制备H2具有原料丰富,成本低,产物易分离等优点
D.过程II的热化学方程式为3FeO(s) + H2O(l)=H2(g) + Fe3O4(s) ∆H=+128.9 kJ/mol
12. 溴及其化合物在医药、农药、染料等生产中有广泛应用。工业上常用的一种海水提取溴技术叫做“吹出法”,其生产流程如图所示。下列说法错误的是
A.溶液X的主要成分是HBr和H2SO4
B.通过吹出塔、吸收塔实现了对溴的富集
C.用热空气将Br2吹出利用了Br2易挥发的性质
D.在工业生产中,也可以用足量的Na2CO3溶液代替SO2和水,发生的反应为:
6Na2CO3+ 3Br2=5NaBr + NaBrO3 + 6CO2↑
13. 常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L Na2A溶液,其滴定曲线如图所示。下列说法正确的是
A.水的电离程度:a>b>c>d
B.HA-水解常数的数量级为10-9
C.a点溶液中c(HA-)>c(A2-)>c(Cl-)
D.b点溶液中c(Na+) +c(H+)=c(HA-) + 2c(A2-) +c(OH-)
14. 在恒容密闭容器中充入一定量的 H2S气体,平衡时三种组分的物质的量与温度的关系如图所示。下列说法正确的是
A.反应2H2S(g)S2(g) + 2H2(g)的∆H<0
B.T1时,该反应的平衡常数K=1 mol/L
C.T2时,H2S的平衡转化率大于50 %
D.H2S在X点的逆反应速率大于Y点的正反应速率
二、非选择题:共58分。第15~17题为必考题,每个试题考生都必须作答。第18、19题为选考题,考生根据要求作答。
(一)必考题:共43分。
80℃
15. (15分)人们将酸强度超过100%H2SO4的一类酸叫做超酸,某实验小组用4.57 g SbCl3制备超酸HSbF6,并探究其性质。制备SbCl5的实验装置如图(夹持、加热及搅拌装置略):
已知:Ⅰ.制备HSbF6的化学反应为SbCl3+ Cl2 ==== SbCl5;SbCl5+ 6HF=HSbF6+ 5HCl
Ⅱ.毛细管连通大气,减压时可吸入极少量的空气,产生微小气泡以代替沸石。
Ⅲ.相关物质的部分性质如下:
物质
熔点
沸点
其他性质
SbCl3
73.4℃
220.3℃
极易水解
SbCl5
3.5℃
101KPa:140℃(同时开始分解);29KPa:79℃
极易水解
(1) 仪器D的名称是________________。
(2) A装置中发生反应的化学方程式为____________________________________________。
(3) 试剂X为____________;其作用是____________________、_____________________。
(4) 反应完成后,关闭活塞a并打开活塞b,减压转移SbCl5粗品至E中,用真空泵抽气进行减压蒸馏(29KPa)。E中毛细管产生微小气泡的作用是____________;用减压蒸馏而不用常压蒸馏的主要原因是___________________________________________________。
(5) 经后续反应制得HSbF6 4.27 g,计算所得HSbF6的产率为______(保留2位有效数字)。
(6) 1966年,美国研究员J·Lukas无意中将蜡烛扔进一个酸性溶液(HSbF6)中,发现蜡烛很快溶解,并放出H2。已知稳定性:,写出等物质的量的异丁烷与HSbF6发生反应的化学方程式:___________________________________。
16. (14分) MnO2常用作氧化剂和催化剂,以某含锰矿石[主要成分为MnCO3,含有少量Cu2(OH)2CO3、Fe3O4、CaO、MgO和NiO等]为原料制备MnO2,同时回收Ni2+用于制备可充电镍氢电池。主要流程如图:
已知:Ⅰ.相关金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Mg2+
Cu2+
Ni2+
Mn2+
开始沉淀pH
2.7
6.3
9.3
4.8
6.4
8.1
完全沉淀pH
3.7
8.3
10.8
6.3
9.2
10.1
Ⅱ.Ksp (CaF2)=4.0×10-11,Ksp (MgF2)=1.0×10-10
回答下列问题:
(1) 为提高酸浸的速率,可以采取的措施有________________________(写出两种方法)。
(2) 加入H2O2的目的是________________________________。
(3) “调pH除杂”后滤渣1中的成分除含有Cu(OH)2、CaSO4外还有________________,该步骤中应调节的pH范围为___________________。
(4) “沉淀除杂”时加入适量NaF溶液除Mg2+、Ca2+。若溶液中Mg2+和Ca2+完全沉淀(沉淀完全时,离子浓度小于1.0×10-5 mol/L),则滤液中F-的最低浓度为______________。
(5) 有机相提取出的Ni2+再生时可用于制备可充电镍氢(储氢)电池,该电池的总反应为NiOOH + MHNi(OH)2 + M,电解质溶液为KOH溶液,则放电时正极反应式为_________________________________________________________________________。
(6) “沉锰”过程中生成MnCO3,写出该反应的离子方程式________________________。
(7) MnO2质量分数的测定:取a g产品于烧杯中,加入足量的甲苯和硫酸溶液,生成苯甲醛、硫酸锰和水,萃取分液得到无机相,于100 mL容量瓶中定容。每次移取10.00 mL所配溶液,用b mol/L标准的Na2S2O8溶液进行滴定,发生反应Mn2++ S2O82-+ H2O→MnO4-+ SO42-+ H+(未配平),平行滴定三次,平均消耗Na2S2O8标准溶液V mL。则产品中MnO2的质量分数为_____________(用含a、b、V的式子表示)。
17. (14分) 乙醇既可作为清洁能源,又可作为有机物的萃取剂。除了用微生物发酵法制乙醇,还可用CO2或CO与H2直接反应合成乙醇。用化学法合成乙醇可能发生以下反应:
Ⅰ.2CO2(g) +6H2(g) C2H5OH(g) +3H2O(g) ∆H1=-171.4 kJ•mol-1
Ⅱ.CO2(g) +H2(g) CO(g) +H2O(g) ∆H2=+41.1 kJ•mol-1
Ⅲ.2CO(g) +4H2(g) C2H5OH(g) +H2O(g) ∆H3
回答下列问题:
(1) ∆H3=____________。
(2) 在恒温(T>100 ℃)下,向刚性容器中通入2 MPa CO和3 MPa H2,加入少量铑(Rh)基催化剂,假设只发生反应Ⅲ,30 min后达平衡,总压降低至原来的60%。则该温度下反应Ⅲ的平衡常数Kp为,CO的平衡转化率为___________________。可采取______________措施(填选项)来提高乙醇的平衡产率。
A.反应容器体积不变,充入一定量氩气 B.适当升高温度
C.再向容器中通入2 MPa CO和3 MPa H2 D.将H2O(g)从体系中分离出去
lnk
(3) 已知lnk=+lnA(Ea为活化能,k为速率常数,R和A为常数),下图线段b为反应Ⅲ中温度和速率常数的关系,则线段a可能改变的外界条件是。
/10-3K-1
(4) 研究者认为利用反应Ⅲ制乙醇时,铑基催化剂的催化反应机理如下图:
(“ad”表示被吸附;x=2或3)
该反应产生的副产物有;已知反应Ⅲ的速率方程为v=kc2(CO),且H2、CO在催化剂上的吸附速度很快,则该反应决速步骤最可能为第________步。(填序号)
(二)选考题:共15分。请考生从第18题和第19题中任选一道作答。如果多做,则按所做的第一题计分。
[化学——选修3:物质结构与性质](15分)
18. 在过渡元素中可以寻找催化剂和耐高温、耐腐蚀的合金材料;氟、氯、硫、磷等元素可用于农药的制作。回答下列问题:
(1) 基态铬的价电子排布式为______________________________,金属铬具有导电、导热及延展性,这些性质可用“_____________________理论”解释。
(2) TiO2与光气(COCl2)、氯化亚砜(SOCl2)等反应可以制得TiCl4,TiCl4常用于制造虹彩剂、人造珍珠、烟幕、颜料等。
①C、O、S的电负性由大到小的顺序为______________________________________。
②光气中心原子的杂化方式为_________杂化,氯化亚砜是________分子(填“极性”或“非极性”)。
(3) 四羰基合镍与镍之间的相互转化可用于镍的分离提纯,四羰基合镍常用作催化剂。
①四羰基合镍所含σ键和π键的数目之比为___________。
②四羰基合镍中CO的三键键长____________(填“>”“<”或“=”)游离态CO的三键键长,可能的原因是_________________________________________________。
(4) 某立方磷青铜晶胞结构如图:
若晶胞密度为dg/cm3,则最近的Cu原子之间的距离为__________nm(用含“d”、“NA”的代数式表示)。
[化学——选修5:有机化学基础](15分)
19. 磷酸氯喹是一种常见抗疟疾和抗炎剂,最新研究表明,该药在体外细胞水平上对新型冠状病毒具有抑制作用。以下为制备磷酸氯喹(W)的一种合成路线:
已知:Ⅰ.-X为邻对位定位基;
Ⅱ.和苯酚的化学性质相似;
Ⅲ.(R1、R2、R3=H/烃基等)。
(1) B的化学名称是_____________________;D中官能团的名称为。
(2) K→L的反应类型为。
(3) A→C的反应顺序可否调为?并解释原因:。
(4) M的结构简式为。
(5) E与氢氧化钠溶液反应的化学方程式为。
(6) 已知:G在兰尼Ni /H2条件下可转化为P(),则满足以下条件P的同分异
构体有种。其中核磁共振氢谱有5组峰,且峰面积之比为1∶1∶1∶1∶1的分子结构简式为(任写一种)。
①除一个苯环外无其他环状结构;
②苯环上有两个取代基且为对位,其中一个为-Cl;
③红外光谱检测到分子中有碳氧双键和氮氢键。
第四次月考化学参考答案
一、选择题(每小题3分,共42分)
1-5 ABCAD 6-10 CBDCB 11-14 BDAC
二、填空题(共58分)
15.(15分)
加热
(1)三颈烧瓶(1分)
(2)MnO2 + 4HCl(浓) ====MnCl2 + Cl2↑+ 2H2O(2分)
(3)碱石灰(2分)吸收氯气,防止污染空气;防止空气中的水蒸气进入三颈烧瓶中使
SbCl3、SbCl5水解(2分)
(4)防暴沸(2分)
降低SbCl5的沸点,防止温度过高导致SbCl5分解(2分)
(5)90%(2分)
(6)(CH3)3CH + HSbF6=(CH3)3CSbF6 + H2(2分)
16.(14分)
(1)粉碎、适当升温、搅拌、适当提高硫酸浓度(2分)
(2)将二价铁氧化为三价铁(1分)
(3)Fe(OH)3(1分) 6.3≤pH<6.4(2分)
(4)1.0×10-2.5mol/L(2分)
(5)MnOOH + e-+ H2O=Mn(OH)2 + OH-(2分)
(6)Mn2+ + HCO3_ + NH3·H2O=MnCO3↓+ H2O + NH4+(2分)
(7)%(2分)
17.(14分)
(1)-253.6 kJ • mol−1(2分)
(2)0.25 MPa-4(2分) 50%(2分) CD(2分)
(3)使用(更高效的)催化剂(2分)
(4)CH3OH、CH4(2分)⑦(2分)
18.(15分)
(1)3d54s1(2分)电子气(1分)
(2)① O>S>C(2分)② sp2(2分)极性(1分)
(3)① 1∶1(2分)
②>(1分)
Ni(CO)4中,由于C提供孤电子对形成配位键,导致C和O原子轨道重叠程度减小(2分)
(4)(2分)
19.(15分)
(1)硝基苯(1分);氯原子、氨基(2分)
(2)取代反应(2分)
(3)不能,-Cl为邻对位定位基,调换顺序后引入-NO2为-Cl的邻对位,而非间位。(2分)
(4)(2分)
(5)(2分)
(6)22 (2分)
(2分)
2023重庆市西南大学附中高三上学期12月月考试题化学含答案: 这是一份2023重庆市西南大学附中高三上学期12月月考试题化学含答案,共10页。试卷主要包含了答卷前,考生务必将自己的姓名,考试结束后,将答题卡交回等内容,欢迎下载使用。
2021重庆市西南大学附中高三下学期第四次月考化学试题含答案: 这是一份2021重庆市西南大学附中高三下学期第四次月考化学试题含答案,共12页。试卷主要包含了考试结束后,将答题卡交回等内容,欢迎下载使用。
2021重庆市西南大学附中高二下学期第四次月考化学试题含答案: 这是一份2021重庆市西南大学附中高二下学期第四次月考化学试题含答案,共13页。试卷主要包含了考试结束后,将答题卡交回等内容,欢迎下载使用。












