
2022届山东省济南市高三下学期3月一模考试化学试题含答案
展开
这是一份2022届山东省济南市高三下学期3月一模考试化学试题含答案,共11页。试卷主要包含了5 Ce-140等内容,欢迎下载使用。
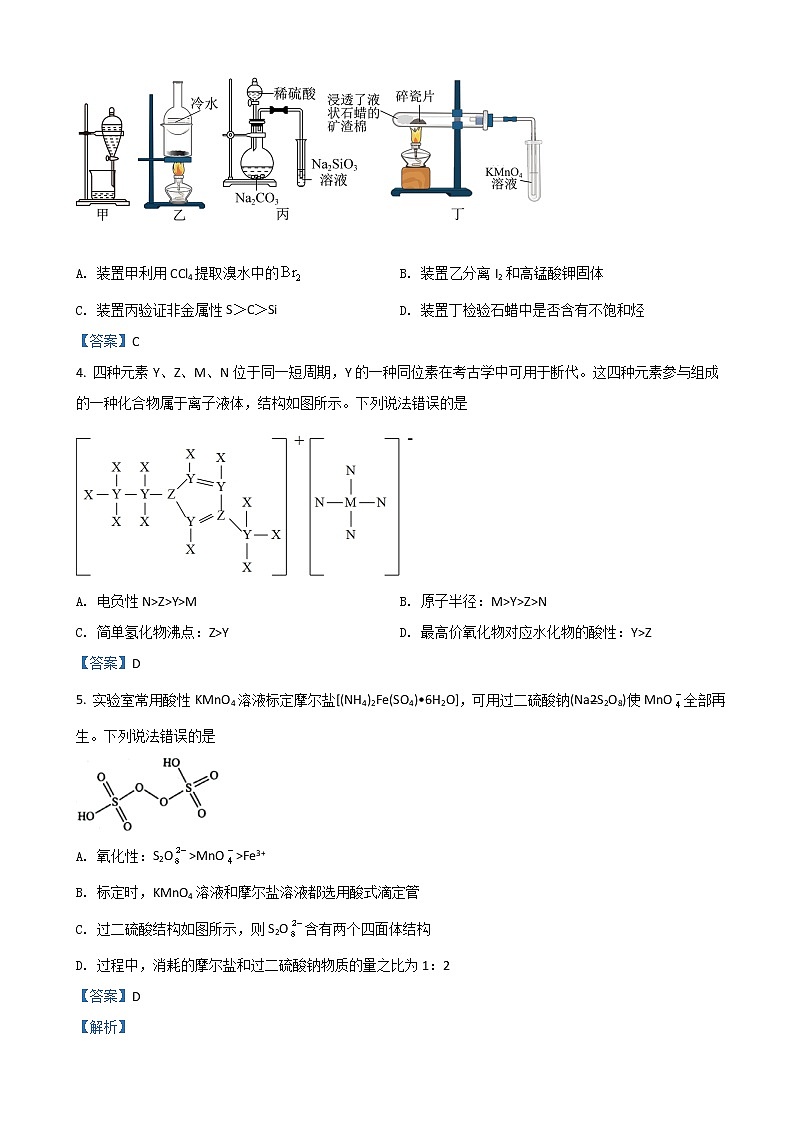
2022年高考模拟考试化学试题注意事项:1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。可能用到的相对原子质量:H-1 C-12 O-16 Si-28 Cl-35.5 Ce-140一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。1. 2022年2月4日,万众瞩目的第24届冬奥会在北京隆重开幕,本届冬奥会尽显化学高科技。下列有关说法错误的是A. “飞扬”火炬喷口外壳采用聚硅氮烷树脂,该树脂属于无机聚合物B. “战袍”利用微信小程序,调控石墨烯片加热保暖,石墨烯和碳纳米管互为同分异构体C. 国家速滑馆采用的硫化镉发电玻璃,可将太阳能转化为电能D. 滑雪头盔采用碳纤维、玻璃纤维和弹性体三种成分合成的新材料,其中玻璃纤维和普通玻璃的成分相同【答案】B2. 下列有关物质性质与应用的对应关系正确的是选项性质实际应用A小苏打不稳定,受热分解生成CO2用于泡沫灭火器B聚乙炔是无限延伸的线状结构用于导电材料CAl(OH)3受热分解,生成高熔点物质和水用作塑料的阻燃剂D石墨是混合型晶体,含大π键用作润滑剂 A. A B. B C. C D. D【答案】C3. 下列实验装置正确且能达到相应实验目的的是
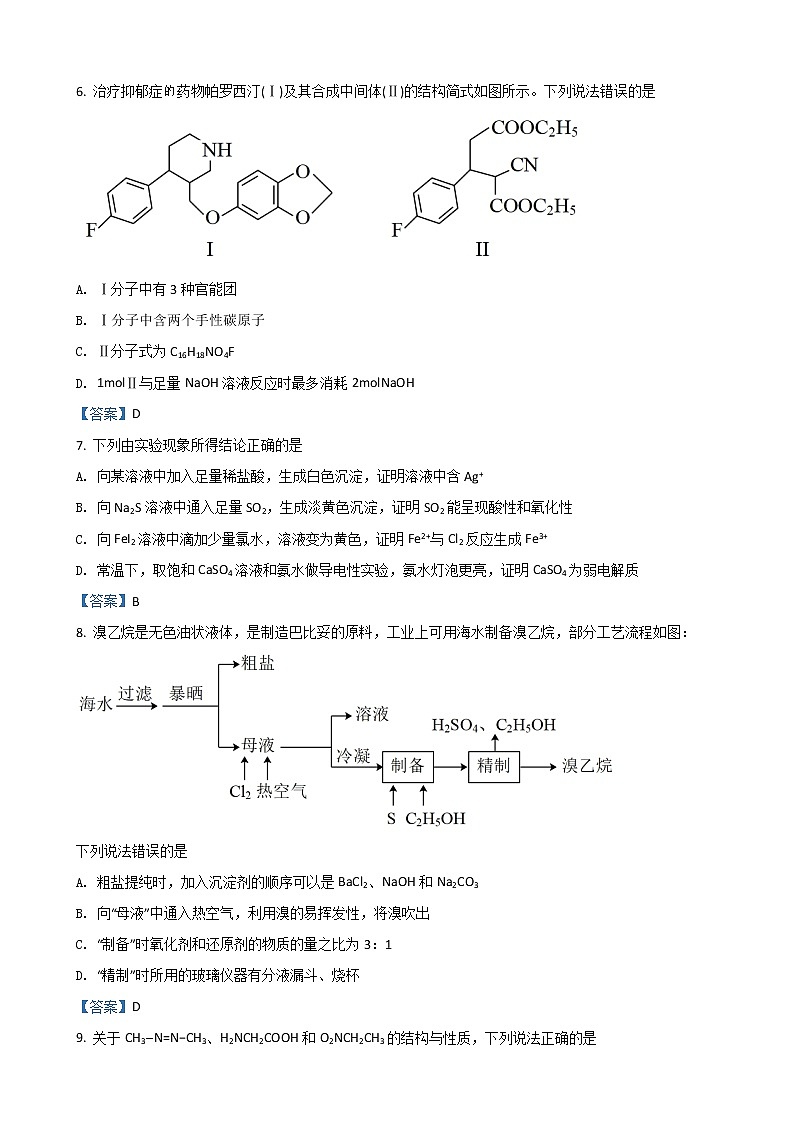
A. 装置甲利用CCl4提取溴水中的 B. 装置乙分离I2和高锰酸钾固体C. 装置丙验证非金属性S>C>Si D. 装置丁检验石蜡中是否含有不饱和烃【答案】C4. 四种元素Y、Z、M、N位于同一短周期,Y的一种同位素在考古学中可用于断代。这四种元素参与组成的一种化合物属于离子液体,结构如图所示。下列说法错误的是A. 电负性N>Z>Y>M B. 原子半径:M>Y>Z>NC. 简单氢化物沸点:Z>Y D. 最高价氧化物对应水化物的酸性:Y>Z【答案】D5. 实验室常用酸性KMnO4溶液标定摩尔盐[(NH4)2Fe(SO4)•6H2O],可用过二硫酸钠(Na2S2O8)使MnO全部再生。下列说法错误的是A. 氧化性:S2O>MnO>Fe3+B. 标定时,KMnO4溶液和摩尔盐溶液都选用酸式滴定管C. 过二硫酸结构如图所示,则S2O含有两个四面体结构D. 过程中,消耗的摩尔盐和过二硫酸钠物质的量之比为1:2【答案】D【解析】6. 治疗抑郁症药物帕罗西汀(Ⅰ)及其合成中间体(Ⅱ)的结构简式如图所示。下列说法错误的是A. Ⅰ分子中有3种官能团B. Ⅰ分子中含两个手性碳原子C. Ⅱ分子式为C16H18NO4FD. 1molⅡ与足量NaOH溶液反应时最多消耗2molNaOH【答案】D7. 下列由实验现象所得结论正确的是A. 向某溶液中加入足量稀盐酸,生成白色沉淀,证明溶液中含Ag+B. 向Na2S溶液中通入足量SO2,生成淡黄色沉淀,证明SO2能呈现酸性和氧化性C. 向FeI2溶液中滴加少量氯水,溶液变为黄色,证明Fe2+与Cl2反应生成Fe3+D. 常温下,取饱和CaSO4溶液和氨水做导电性实验,氨水灯泡更亮,证明CaSO4为弱电解质【答案】B8. 溴乙烷是无色油状液体,是制造巴比妥的原料,工业上可用海水制备溴乙烷,部分工艺流程如图:下列说法错误的是A. 粗盐提纯时,加入沉淀剂的顺序可以是BaCl2、NaOH和Na2CO3B. 向“母液”中通入热空气,利用溴的易挥发性,将溴吹出C. “制备”时氧化剂和还原剂的物质的量之比为3:1D. “精制”时所用的玻璃仪器有分液漏斗、烧杯【答案】D9. 关于CH3−N=N−CH3、H2NCH2COOH和O2NCH2CH3的结构与性质,下列说法正确的是A. CH3−N=N−CH3有顺反异构现象B. 1mol O2NCH2CH3含有10mol σ键C. 三种物质中,氮原子杂化方式相同D. 在乙醇中溶解度,H2NCH2COOH低于O2NCH2CH3,原因是前者与乙醇形成氢键【答案】A10. 在直流电源作用下,双极膜中间层中的H2O解离为H+和OH-,利用双极膜电解池产生强氧化性的羟基自由基(•OH),处理含苯酚废水和含SO2的烟气的工作原理如图所示。下列说法错误的是
A. 电势:N电极>M电极B. 阴极电极反应式为O2+2e-+2H+=2•OHC. 每处理9.4g苯酚,理论上有2.8molH+透过膜aD. 若•OH只与苯酚和SO2反应,则参加反应的苯酚和SO2物质的量之比为1:14【答案】C二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。11. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器) 实验目的玻璃仪器试剂A除去苯中少量的苯酚普通漏斗、烧杯、玻璃棒浓溴水B测定84消毒液的pH玻璃棒、表面皿pH试纸C实验室制备乙烯酒精灯、蒸馏烧瓶、温度计、导气管、胶头滴管浓硫酸、乙醇、碎瓷片D检验CH3CH2Br中的溴元素试管、胶头滴管、酒精灯NaOH溶液、硝酸、AgNO3溶液AA B. B C. C D. D【答案】CD12. 巴豆醛是橡胶硫化促进剂、酒精变性剂和革柔剂的合成中间体,存在如下转化过程:W巴豆醛XYZ已知:①X为CH3CH=CHCH(OH)CN;②Z为六元环状化合物;③羟基直接与碳碳双键上碳原子相连不稳定。下列说法错误的是A. 与X具有相同官能团的X的同分异构体有15种(不考虑立体异构)B. Y分子中可能共平面的碳原子最多为5个C. W的同分异构体中,含6个相同化学环境氢原子的有3种D. 可用饱和Na2CO3溶液分离提纯Z【答案】A13. 工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]•3H2O,工艺流程如图:
下列说法错误的是A. “焙烧”时氧化产物有Fe2O3和SO2B. “调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同C. “溶液Ⅰ”中主要反应的离子方程式为6OH-+6HCN+Fe2+=[Fe(CN)6]4-+6H2OD. “一系列操作”为过滤、洗涤、干燥【答案】C14. Beckmann反应是肟指在一定条件下生成酰胺的反应,机理中与羟基处于反位的基团迁移到缺电子的氢原子上,具体反应历程如图所示。已知:R、R′代表烷基。下列说法错误的是A. H+在该反应过程中作催化剂 B. N—O—H键角:物质Ⅰ>物质ⅡC. 物质Ⅲ→物质Ⅳ有配位键的形成 D. 发生上述反应生成【答案】BD15. 已知:联氢(N2H4)是二元弱碱(pKb1=6,pKb2=15;pK=-lgK),在水中的电离方式类似于氨气,常温下,向0.1mol·L-1N2H5Cl溶液通入HCl或加入NaOH固体(假设溶液总体积不变),溶液中c(N2H)随pOH变化的曲线如图所示,下列说法错误的是A. N2H5Cl溶液c(N2H)>c(N2H4)>c(N2H)B. b点加入NaOH(或HCl)的物质的量与d点加入HCl(或NaOH)物质的量相等C. 水的电离程度:b>aD. 若c(N2H)>c(N2H4),则pH小于3.5【答案】B三、非选择题:本题共5小题,共60分。16. 卤族元素及其化合物种类繁多,有着非常重要的用途,回答下列问题:(1)基态Br原子的电子排布式为[Ar]____。(2)HF分子的极性____(填“大于”“等于”或“小于”,以下同)HCl,同一条件下,HF在水中的溶解度____HCl,HF的沸点____HCl。SOCl2中心S原子VSEPR模型为____。1mol氟硼酸铵NH4BF4中含有____mol配位键。(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(,,),则m的原子分数坐标为____,距离Hg最近的Ag有____个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为Mg•mol-1,该晶体的密度为____g•cm-3(用代数式表示)。【16~18题答案】【答案】(1)3d104s24p5(2) ①. 大于 ②. 大于 ③. 大于 ④. 正四面体 ⑤. 2(3) ①. (,,) ②. 8 ③. ×103017. 铈可用作优良的环保材料,现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备铈,其工艺流程如图所示:已知:①滤渣Ⅰ主要成分是难溶于水的Ce(BF4)3;Ksp[Fe(OH)3]=8×10-38];②Ksp[Ce(OH)3]=1×10-22];③lg2=0.3。回答下列问题:(1)粉碎“焙烧”时,氧化数据如表所示:空气氧化法氧化温度/℃氧化率/%氧化时间/h暴露空气中450~5008gl4对流空气氧化炉中450~500986在对流空气氧化炉中可大大缩短氧化时间的原因是____。(2)用盐酸和H2BO3提取Ce元素时,体现盐酸的性质有____,“滤渣Ⅰ”用饱和KCl溶液溶解时发生复分解反应,则“滤渣Ⅱ”主要成分为____(化学式)。(3)“滤液Ⅰ”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是____,“滤液Ⅱ”中加入NH4HCO3反应的离子方程式为____,若Ce2(CO3)3经充分焙烧质量减少5.8t,则获得CeO2的质量为____t。(4)用过量铝粉还原CeO2即可得Ce,反应的化学方程式为____,铝粉必须过量的原因是____。【17~20题答案】【答案】(1)增大了气体与固体粉末间的接触面积(2) ①. 酸性、还原性 ②. KBF4(3) ①. 3.3≤pH<7 ②. 2Ce3++6HCO=Ce2(CO3)3+3CO2↑+3H2O ③. 17.2(4) ①. 3CeO2+4Al2Al2O3+3Ce ②. 使CeO2全部转化为Ce;铝与氧气反应,放出大量的热,营造高温环境18. 某实验小组用SiCl4和(CH3CO)2O合成四乙酸硅,装置如图所示(夹持装置略),相关物质的性质如表所示:物质性质SiCl4无色油状液体,能剧烈水解生成硅酸和HCl乙酸酐[(CH3CO)2O]无色油状液体,吸湿性很强四乙酸硅[Si(CH3COO)4]米黄色晶体,可溶于苯,遇水会迅速水解,超过160℃时可分解成乙酸酐和二氧化硅乙酰氯(CH3COCl)无色油状液体,遇水剧烈反应回答下列问题:(1)仪器①的名称是____,管口A所接干燥管中盛装的试剂是____(填“P2O5”、“CaCl2”或“碱石灰”)。(2)检查上述装置气密性,具体操作为先向②中注入一定量的____(填“水”或“苯”),然后密封管口A和B,打开旋塞⑥,若____(填现象),则证明装置的气密性良好。(3)取255gSiCl4放入1L仪器①中,关闭旋塞⑥,再由分液漏斗滴入稍过量的乙酸酐,反应发生,放出大量的热,混合物略微带色,不久仪器①底部析出大颗粒晶体。写出制备四乙酸硅的化学方程式:____,该过程中,玻璃管③的管口必须保持在液面上方的原因是____。(4)待放置一段时间,用干冰—丙酮冷冻剂冷却,然后____(填具体操作),小心缓慢地除去仪器①中的残留液体,接着再分两次由分液漏斗各滴入75mL左右的乙酸酐,再缓慢除去,最后得到335g精制的四乙酸硅,则四乙酸硅的产率为____%(保留到小数点后一位)。【答案】(1) ①. 三颈烧瓶(或三口烧瓶、三口瓶) ②. 碱石灰(2) ①. 苯 ②. ②中液面保持不变(3) ①. SiCl4+4(CH3CO)2O=Si(CH3COO)4+4CH3COCl ②. 防止结晶析出的四乙酸硅堵塞③的导气管口(4) ①. 将③的管口插入到液体中(或“插入到烧瓶底部”),再慢慢打开旋塞 ②. 84.619. 黄连素(化合物1)主要用于治疗胃肠炎、细菌性痢疾等肠道感染。一种合成路线如图:已知:①RCOOHRCOCl ②CH3NH2+CH3COCH3回答下列问题:(1)符合下列条件的A的同分异构体有____种(不考虑立体异构)。①含有两个酚羟基②苯环上有三个取代基③能发生银镜反应④能发生水解反应(2)B的结构简式为____,B→C的反应类型为____,C中官能团的名称是____。(3)C→D的化学方程式为____。(4)F→G中,参与反应的位点是____(填“①”或“②”),设计步骤E→F的目的是____。(5)写出由制备的合成路线____。【19~23题答案】【答案】(1)30(2) ①. ②. 取代反应 ③. 醚键、酰胺基(3)+H2O(4) ①. ① ②. 防止后续步骤得到过多副产物(或提高目标产物的纯度)(5)20. 反应Ⅰ可用于在国际空间站中处理二氧化碳,同时伴有副反应Ⅱ发生。主反应Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2O(g) △H1=-270kJ·mol-1副反应Ⅱ.CO2(g)+H2(g)CO(g)+H2O(g) △H2回答下列问题:(1)几种化学键的键能如表所示:化学键C—HH—HH—OC=O键能/kJ·mol-1413436463a则a=___。(2)为了进一步研究上述两个反应,某小组在三个容积相同的刚性容器中,分别充入1molCO2和4molH2,在三种不同实验条件(见表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:实验编号abc温度/KT1T1T2催化剂的比表面积/(m2•g-1)80120120①T1____T2(填“>”“<”或“=”),曲线Ⅲ对应的实验编号是____。②若在曲线Ⅱ的条件下,10min达到平衡时生成1.2molH2O,则10min内反应的平均速率v(H2O)=____kPa•min-1,反应Ⅱ的平衡常数Kp=____。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(3)对于反应Ⅰ,在一定条件下存在:v正(H2)=k1•c4(H2)•c(CO2)或v逆(H2O)=k2•c2(H2O)•c(CH4),相应的速率与温度关系如图所示。反应Ⅰ的平衡常数K=____(用含k1,k2的代数式表示);图中A、B、C、D四个点中,能表示反应已达到平衡状态的是____。【20~22题答案】【答案】(1)745(2) ①. < ②. b ③. 4.8 ④. (3) ①. ②. C
相关试卷
这是一份2023届山东省济南市高三下学期三模化学试题及答案,共14页。试卷主要包含了下列关于“碳”的说法错误的是,双极膜,以稳定产品等内容,欢迎下载使用。
这是一份2023届山东省济南市高三下学期一模考试化学试题及答案,共6页。
这是一份山东省济南市2022届高三下学期5月高考模拟考试(三模)化学试题,文件包含济南三模docx、济南三模答案pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。









