

初中化学科粤版九年级下册第六章 金属6.4 珍惜和保护金属资源课后测评
展开
这是一份初中化学科粤版九年级下册第六章 金属6.4 珍惜和保护金属资源课后测评,共16页。试卷主要包含了单选题,综合应用题等内容,欢迎下载使用。
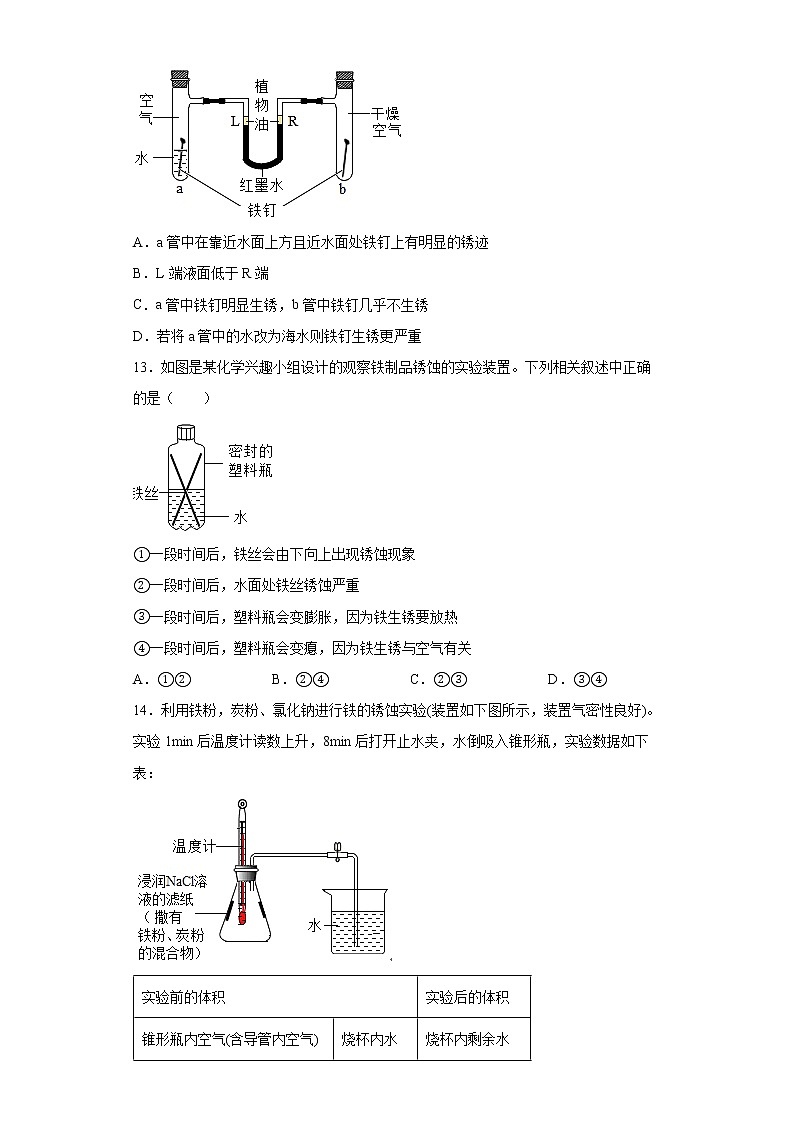
科粤版九年级化学下册 6.4 珍惜和保护金属资源 同步练习一、单选题1.下列说法不符合事实的是( )A.钢铁生锈是缓慢氧化B.合金的很多性能与组成它们的纯金属不同C.铁锈的主要成分是四氧化三铁D.铝在空气中表面会生成致密的氧化铝薄膜,使铝具有很好的抗腐蚀性能2.下列防锈措施合理的是A.经常用水冲洗自行车链条 B.在铁制暖气片上刷“银粉”C.用“钢丝球”打磨铝锅表面 D.用过的菜刀及时用盐水清洗3.如图为某化学兴趣小组同学设计的观察铁制品锈蚀的实验装置,下列叙述正确的是①一段时间后,铁丝会由下至上出现锈蚀现象②一段时间后,水面处铁丝锈蚀严重③一段时间后,塑料瓶会膨胀,因为铁生锈要放热④一段时间后,塑料瓶会变瘪,因为铁生锈要消耗氧气A.①③ B.②④ C.②③ D.①④4.下列关于金属材料的说法中,不正确的是A.生铁、硬铝、焊锡都属于合金B.铜有良好的导电性,因而大量用于制作电线C.铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性D.锈蚀后的铁制品没有回收价值5.下列措施不能在一定程度上防止金属生锈的是A.在金属表面涂油或刷漆 B.在金属表面镀上一层耐腐蚀的铬C.制成耐腐蚀的合金 D.用砂纸擦去铝制品表面的氧化膜6.近年来,株洲市政府高度重视垃圾分类存放的问题.下列垃圾中不属于有害垃圾的是( )A.破铜烂铁 B.废旧电池 C.变质药品 D.废荧光灯管7.光亮的铁钉在下列几种情况下,最不容易生锈的是A. B. C. D.8.2018年5月我国自主建造的第一艘航母下海,为保证航母的使用寿命,下列防锈措施不可行的是A.用抗锈蚀性能优异的合金制造航母零部件 B.刷防锈漆C.船体表面镀一层黄金 D.给某些部位涂油9.暖宝宝中的发热剂是铁粉、水和食盐等,用发热剂代替红磷测定空气中氧气含量,装置如图,以下对此改进实验的叙述错误的是A.实验前要检查装置的气密性 B.此实验测出空气中氧气的质量分数约18%C.此实验的原理是利用铁生锈消耗氧气 D.此实验必须到水不再流入左瓶才可获取进入广口瓶的水的体积10.下列做法不科学的是A.书包带要做宽一些以增大受力面积从而减小压强B.菜刀使用过后应立即擦干存放C.家庭电路中必须安装保险丝或空气开关D.用燃着的木条检验液化石油气是否泄露11.埋在地下的铸铁管道在下列哪种情况下腐蚀最慢A.在干燥、致密的土壤中 B.在干燥、疏松的土壤中C.在潮湿、致密的土壤中 D.在潮湿、疏松的土壤中12.如图是探究铁器锈蚀条件的装置。调节L端与R端的液面高度使之相同,塞紧橡皮塞,一周后观察。下列说法错误的是A.a管中在靠近水面上方且近水面处铁钉上有明显的锈迹B.L端液面低于R端C.a管中铁钉明显生锈,b管中铁钉几乎不生锈D.若将a管中的水改为海水则铁钉生锈更严重13.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )①一段时间后,铁丝会由下向上出现锈蚀现象②一段时间后,水面处铁丝锈蚀严重③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关A.①② B.②④ C.②③ D.③④14.利用铁粉,炭粉、氯化钠进行铁的锈蚀实验(装置如下图所示,装置气密性良好)。实验1min后温度计读数上升,8min后打开止水夹,水倒吸入锥形瓶,实验数据如下表:实验前的体积实验后的体积锥形瓶内空气(含导管内空气)烧杯内水烧杯内剩余水246.0mL100.0mL51.5mL 下列说法不合理的是A.铁的锈蚀是放热反应B.使用氯化钠溶液的目的是加快铁的锈蚀C.此实验能推断出铁的锈蚀需要水的参与D.计算得出空气中氧气的含量约为19.7%15.金属防锈既可以节约资源,又能美化环境.下列钢铁制品经过如下处理后,防锈效果最差的是A.经常在表面涂油的大型钢制机械B.涂上防锈漆后的“辽宁”号航母舰体外壳C.擦洗干净后长期存放在室外的大型铁制农机具D.经过“烤蓝”,在表面形成致密氧化膜的钢制枪管16.以下说法正确的是①工业上采用液化空气的方法制备氧气②氢气、甲烷在点燃前要检验气体的纯度 ③一般情况下,合金的熔点和硬度都比组成合金的纯金属高 ④铁生锈是铁与氧气、水蒸气和二氧化碳作用的结果⑤干冰灭火既能降温,又能隔绝空气,而且灭火后不会留痕迹 ⑥二氧化硫、氮氧化物、一氧化碳和二氧化碳都是大气污染物A.②③⑥ B.①④⑥ C.①②⑤ D.②④⑤二、综合应用题17.人类的生活和生产都离不开金属和金属化合物。(1)如图是金属活动性顺序中铜、锡、铁和铝元素被人类大规模开发利用的大致年限,根据图中数据和有关化学知识。下列因素:①地壳中金属元素的含量;②金属的导电性;③金属的活动性;④金属的延展性;⑤金属冶炼的难易程度。你认为与金属大规模开发利用的先后顺序有关的是_____。A.①②③④⑤B.①③④⑤C.①③⑤D .③⑤(2)目前世界上年产量最高的金属是铁,但铁的锈蚀也带来了巨大的损失,铁生锈的主要过程为:FeFe(OH)2Fe(OH)3Fe2O3•xH2O,写出Fe(OH)2→Fe(OH)3的化学反应方程式_____;为什么铝的活动性比铁强,但铝却有良好的抗腐蚀性?_____。(3)向Cu(NO3)2和AgNO3的混合溶液中加入一定量的铁粉和镁粉,充分反应后过滤,得到固体和滤液。①向过滤所得固体中滴加稀盐酸,发现有气泡产生,请分析滤液中溶质的成分_____。②与反应前溶液质量相比,为什么反应后溶液质量一定会变小?_____。(4)如图是用CO还原氧化铁,同时收集尾气中CO的模拟炼铁实验装置。①写出C装置内发生反应的化学方程式:_____。②请设计实验证明:实验结束后B装置溶液的成分中含有NaOH(写出实验步骤、现象和结论)_____。③取18g赤铁矿粉(主要成分是氧化铁,杂质不反应)进行实验,完全反应后,冷却并称量玻璃管内剩余物质质量为13.5g,请计算该赤铁矿中含氧化铁的质量分数(准确到0.1%)_____。18.我国城市高铁和地铁的开通运行,给天们的生活带来了很多便利。高铁和地铁的建设广泛使用了金属材料。(1)地铁建没中使用了钢轨,钢轨长时间使用后会生锈,写出用稀盐酸除去铁锈的化学方程式__________。写出防止铁制品锈蚀的一种常用方法___________。(2)防止金属锈蚀是保护金属资源的有效途径之一。下列情况铁最不容易生锈的是__________(填序号)。①部分浸没在海水中少许 ②在潮湿空气中 ③浸没在植物油中(3)我国的高铁技术在当今世界上遥遥领先,其中铁轨用锰钢而不使用纯铁的原因是__________,已知锰的金属活动性介于镁和锌之间,下列试剂能够验证铁和锰的金属活动性强弱的是__________。A铁、锰、硫酸锌溶液B铁、锰、硫酸镁溶液C铜、硫酸亚铁溶液、硫酸锰溶液19.铁及其化合物在生产生活中应用广泛。Ⅰ.铁的性质和防护(1)某麦片中含微量铁粉,食用后铁粉与胃酸(含HCl)反应转化为人体可吸收的铁元素,此反应的基本反应类型为________。(2)钢铁的锈蚀主要是铁与空气中的______等物质发生化学反应的结果。(3)为防止铁生锈,可对铁制品进行“发蓝”处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为_______。Ⅱ.废铁的再利用硫酸铁在农业可用作肥料,是花木,果树制造叶绿素的催化剂。用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备硫酸铁的主要流程如下:已知:FeCO3 + H2SO4 = FeSO4 + H2O +CO2↑(4)酸溶时生成的气体成分为______。(5)“转化1”温度不宜过高的原因是_____。Ⅲ.铁的冶炼我国劳动人民在春秋战国时期就会治铁炼钢,实验室模拟炼铁实验装置如图所示。(6)实验时,应先注水片刻后再加热的目的是________。(7)实验过程中,硬质玻璃管中的现象为______。(8)若取 16g 氧化铁粉末进行实验,反应一段时间后,经检测剩余黑色固体全是 Fe,称量固体的质量为 X,求 X的值______。(写出计算过程)20.铁是生活中常用的金属,请你根据学习回答下列问题。(1)金属元素在自然界中分布很广,铁的矿物主要有赤铁矿、磁铁矿、黄铁矿等,生产生活中常用金属矿物冶炼金属,而一般情况下,不选择黄铁矿(FeS2)来炼铁,原因之一是______,原因二是生成的二氧化硫会污染空气。(2)冬天使用的“取暖片”中,发热剂的主要成分有铁粉、活性炭、氯化钠、水等,发热剂需接触到空气才会发热,原因是铁要与______等物质共同作用才会“生锈”。(3)第一种新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:①完成上述制作工艺II中发生置换反应的化学方程式(氮气不参与反应):______。②在制备纳米级Fe粉的工艺流程中,通入N2的目的是______。(4)为了研究炼铁的主要反应原理,某化学兴趣小组的同学用一氧化碳还原氧化铁做实验。装置如图所示。请回答下列问题:①组装好仪器后,检查气密性并在玻璃管中装入红色氧化铁粉末后的实验操作顺序为______。a、通一氧化碳并点燃处理尾气的酒精灯b、点燃给硬质玻璃管加热的酒精喷灯c、检验一氧化碳的纯度②实验中硬质玻璃管内可以观察到的现象为:______。③某学校研究性学习小组为了测定某炼铁厂生产出来的生铁(铁碳合金, 其中含碳量2~ 4.3%)是否达到要求,取来了一些生铁样品,并取稀盐酸400g,平均分成4份,进行实验,结果如下:实验1234稀盐酸的质量/g100100100100加入样品的质量/g36912生成的H2质量/g0.10.20.25m Ⅰ、上表中的m的数值为______。Ⅱ、试计算这种生铁样品中碳的质量分数并判断是否达到要求______。Ⅲ、试计算第2次实验后所得溶液的溶质质量分数。______(Ⅱ、Ⅲ写出计算过程,计算结果保留小数点后一位)21.铜及其化合物在生产、生活中都有广泛的应用。一、铜的性质及其应用兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。青铜器属于无机材料(1)铜绿分解的化学方程式为_____。(2)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“”为铜片)。实验较长时间后,发现_____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和______(写出试管中需要的物质)。可以省略不做的实验是试管_____(填试管编号)。二、铜的制备研究铜可采用如下方法制备:方法一:火法炼铜:Cu2S+O22Cu+SO2方法二:湿法炼铜:CuSO4+Fe=FeSO4+Cu上述两种方法中,你认为哪种方法更好_____,原因是_____(写出1条原因即可)。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu2S 80%的辉铜矿_____t(取整数)。(3)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5_____。(4)加入Na2CO3沉淀时,反应液pH对产品中的SO42- 含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在_______。(5)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O。某研究小组设计如上图实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。实验步骤如下:①连接装置并 ;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;④向锥形瓶内加入50mL(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172ml。Ⅰ.请将上述实验步骤补充完整_______;Ⅱ.装置B的作用是_______,少量植物油的作用是_______,C中的试剂是_______(填字母序号);a 碱石灰 b 浓硫酸 c 无水硫酸铜Ⅲ.步骤⑥中调节液面相平的操作是将水准管_______(填“缓慢上移”或“缓慢下移”)。Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程)_______。(保留到0.1%)V.若其他操作均正确,仅因下列因素可使测定结果偏小的是_______(填字母序号);A 步骤③中平视刻度,步骤⑥中仰视读数 B 硫酸的用量不足C 量气管中未加植物油 D 步骤⑥中没有调节量气装置两边液面相平,直接读数(6)碱式碳酸铜【xCuCO3·yCu(OH)2·zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如下图。(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)Ⅰ.通过计算可得x:y:z=_______;Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式:_______。22.金属材料对于促进生产发展、改善人类生活发挥了巨大作用。请回答下列问题。(1)“共享单车”方便市民出行,颇受人们的喜爱。①如图所示,单车上标示出的部件中由金属材料制成的是______(任写一条,填字母序号)。②铁制品表面刷漆,主要是为了防止其与______、氧气接触而锈蚀。为防止钢铁生锈可采取的措施是______(任写一条)。③废旧单车中金属部件回收再利用的意义是______(写一条即可)。(2)阅读下列材料铝合金是目前用途广泛的合金之一,例如硬铝的密度小、强度高、具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。将某种铝合金放入氢氧化钠溶液中,其中铝会与氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和一种可燃性气体。近年来,为满足某些尖端技术发展的需要,人们又设计和合成了许多新型合金。例如:钛合金与人体具有很好的“相容性”,可以用来制造人造骨;耐热合金和形状记忆合金广泛应用于航空航天等。回答下列问题:①用于制造飞机和宇宙飞船利用了硬铝______(多选,填标号)的性质。A.密度小B.强度高C.具有较强的抗腐蚀能力D.硬而脆②可以用来制造人造骨的是______合金。③铝与氢氧化钠溶液反应的化学方程式是______。(3)将一定量的铝粉加入到Mg(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤渣和蓝色滤液。下列说法正确的是______(多选)。A.滤渣中一定有Ag、CuB.滤渣中一定有Ag,可能有Cu,一定没有MgC.滤液中一定没有AgNO3D.滤液中一定有Al(NO3)3、Mg(NO3)2、Cu(NO3)2
参考答案:1.C2.B3.B4.D5.D6.A7.B8.C9.B10.D11.A12.B13.B14.C15.C16.C17. D 铝容易与空气中的氧气发生反应,会生成一层致密的氧化铝膜覆盖在铝的表面,阻止反应的进行 一定有硝酸镁,一定没有硝酸银和硝酸铜,可能含有硝酸亚铁 镁、铁与硝酸银溶液、硝酸铜溶液发生置换反应时,溶液的质量均减小 取实验结束后B装置中的少量溶液于试管中,滴加过量的氯化钡溶液,会产生白色沉淀,静置一段时间后,向上层清液中,滴加几滴无色酚酞溶液,若观察到溶液由无色变成红色,说明实验结束后B装置溶液的成分中一定含有NaOH 83.3%18. 刷漆(涂油等合理即可) ③ 锰钢比纯铁的硬度大(合理即可) A19.(1)置换反应(2)氧气、水或O2、H2O(3)Fe3O4(4)二氧化碳、氢气或CO2、H2(5)温度过高,会造成过氧化氢的分解(6)排尽装置内的空气,防止加热时发生爆炸(7)红色粉末变成黑色(8)假设剩余黑色固体成份全部是铁,则设氧化铁与一氧化碳反应生成的铁的质量为XX=11. 2g故X的值为11. 2g。20. 黄铁矿含铁量低 氧气、水 排尽空气,防止铁粉遇到氧气自燃(防止铁粉被氧化) cab 红色固体变为黑色 0.25 根据实验1,3g样品中加入100g稀盐酸,生成0.1g氢气,设生铁样品中铁的质量是x解得x=2.8g;碳元素的质量分数为:,所以不符合要求。 第2次实验中,6g样品中加入100g稀盐酸,生成0.2g氢气,由Ⅱ中可知3g样品含杂质为3g-2.8g=0.2g,则6g样品中含杂质0.4g;设溶液中氯化亚铁的质量是yy=12.7g;。答:第二次实验后溶液中的溶质质量分数是12.0%。21. D CO2和O2 ABC 方法二 能耗低 111 8.5 连接装置后补充检查装置气密性 除去二氧化碳中的水 防止二氧化碳溶于水 c 缓慢下移 0.62g÷1.2g×100%≈51.7% BCD 1:1:1 22.(1) a##d##e 水##H2O 涂油,镀保护层等 保护环境或节约金属资源(2) ABC 钛 (3)BD
相关试卷
这是一份科粤版九年级下册6.4 珍惜和保护金属资源达标测试,共12页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。
这是一份化学九年级下册第六章 金属6.4 珍惜和保护金属资源课时训练,共10页。试卷主要包含了下列措施不利于保护金属资源的是,下列做法,能防止菜刀生锈的是等内容,欢迎下载使用。
这是一份化学九年级下册7.3 溶液浓稀的表示当堂达标检测题,共14页。试卷主要包含了单选题,综合应用题等内容,欢迎下载使用。










