

初中化学鲁教版 (五四制)九年级全册1 溶液的形成课堂检测
展开1.1 溶液的形成
一、单选题
1.在甲组物质中加入乙组物质,反应过程中产生的沉淀的质量与加入乙的质量的关系,符合如图所示关系的是( )
A. 甲组:硫酸钠和硫酸铜的混合溶液,乙组:氢氧化钠溶液;
B. 甲组:氯化钠和氯化钙的混合溶液,乙组:纯碱溶液;
C. 甲组:稀盐酸和氯化钡的混合溶液,乙组:纯碱溶液;
D. 甲组:稀盐酸和稀硫酸的混合溶液,乙组:氯化钡溶液;
2.下列说法错误的是( )
A. 煮沸的汤比煮沸的水温度高
B. 在积雪的公路上撒盐可加快冰雪融化
C. 可用水区分NaOH固体和NH4NO3固体
D. 用洗涤剂除油污是因为洗涤剂能将油污溶解,形成溶液
3.下列有关溶液的说法正确的是( )
A. 溶液的各部分性质均相同
B. 配制溶液时,搅拌溶液可以增大溶质的溶解度
C. 将10%的KNO3 , 溶液倒出一半,剩余溶液中溶质的质量分数为20%
D. 无色澄清液体一定是溶液
4.下列物质加入水中,能形成溶液的是( )
A. 面粉 B. 豆油 C. 冰糖 D. 牛奶
5.下图是甲、乙两种物质(不含结晶水)的溶解度曲线。下列说法中正确的是( )
A. 甲的溶解度大于乙的溶解度
B. t1℃时,50g甲的饱和溶液中有15g甲
C. t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液
D. 当甲中含有少量乙时,可以用降温结晶的方法提纯甲
6.以下说法中正确的组合是( )
①白炽灯工作时电能全部变为光能
②电解水生成氢气和氧气时,电能主要变为化学能
③在化合物中,各种元素化合价的代数和一定等于零
④生活中,“娃哈哈”、“农夫山泉”矿泉水都是纯净物
⑤等质量的烧碱溶液与盐酸混合后,溶液的pH=7
⑥科学家把由四个中子构成的粒子称为“四中子”,是新发现的元素
⑦升高温度一定能使饱和溶液变成不饱和溶液.
A. ②③ B. ①②⑤ C. ③④⑥ D. ①⑤⑦
7. 地球上71%的面积覆盖着水,水是生命之源,也是重要的溶剂,下列说法正确的是( )
A. 将1gCaO投入到99g水中,溶质的质量分数1%
B. 常温下KNO3、Ca(OH)2的饱和溶液降温后仍是饱和溶液
C. 将NaCl、蔗糖溶于水后,溶质均以分子形式存在
D. 溶质在溶解的过程中,有的放出热量,有的吸收热量
8.有关溶液的说法正确的是( )
A. 均一、稳定的液体都是溶液 B. 溶液是均一、稳定的纯净物
C. 溶液是无色、透明的液体 D. 溶液是均一、稳定的混合物
9.放入水中能形成溶液的是( )
A. 白糖 B. 面粉 C. 花生油 D. 胡椒粉
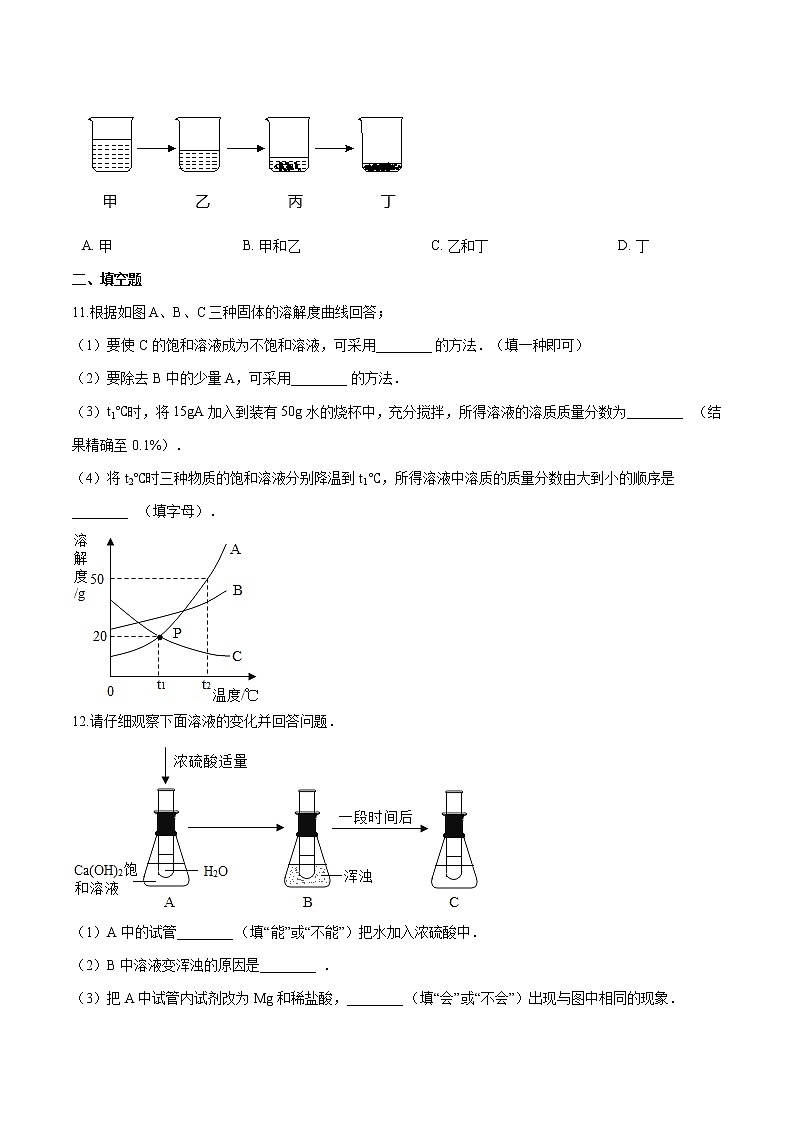
10.如图是恒温下模拟海水晒盐过程的示意图,所表示溶液一定是不饱和溶液的是( )
A. 甲 B. 甲和乙 C. 乙和丁 D. 丁
二、填空题
11.根据如图A、B、C三种固体的溶解度曲线回答;
(1)要使C的饱和溶液成为不饱和溶液,可采用________ 的方法.(填一种即可)
(2)要除去B中的少量A,可采用________ 的方法.
(3)t1℃时,将15gA加入到装有50g水的烧杯中,充分搅拌,所得溶液的溶质质量分数为________ (结果精确至0.1%).
(4)将t2℃时三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序是 ________ (填字母).
12.请仔细观察下面溶液的变化并回答问题.
(1)A中的试管________ (填“能”或“不能”)把水加入浓硫酸中.
(2)B中溶液变浑浊的原因是________ .
(3)把A中试管内试剂改为Mg和稀盐酸,________ (填“会”或“不会”)出现与图中相同的现象.
(4)在A、B、C中Ca(OH)2溶液的质量分数的大小关系是________ (用A、B、C和“>”、“<”、“=”表示).
13.如图所示,四圆分别表示浓溶液、稀溶液、饱和溶液、不饱和溶液的集合,A、B、C、D集合分别表示:
A________
B________
C________
D________.
三、解答题
14.使接近饱和的硝酸钾溶液变为饱和溶液的方法是什么?
四、综合题
15.2010年3月22日是第十八届“世界水日”.主题是“关注水质、抓住机遇、应对挑战”.水与人类的生活和生产密切相关.请回答以下问题:
(1)生理盐水中的溶剂是________ .
(2)保护水环境、珍爱水资源,是每个公民应尽的责任和义务.下列做法有利于保护水资源的是________ (填序号).
A.大量使用化肥农药 B.工业废水处理达标后排放
C.使用含磷洗衣粉 D.生活污水直接排放
(3)在水蒸发的过程中,下列说法正确的是 ________ (填序号).
A.水分子不断运动 B.水分子之间间隔不变
C.水分子分解成氢原子和氧原子 D.水分子可以保持水的物理性质
(4)课外活动中,同学们玩起了以水为主题的“化学反应接龙”游戏.游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,如图所示.仿照示例完成下列反应的化学方程式.
示例:①分解反应:电解水2H2O2H2↑+O2↑;
②置换反应________ ;
③化合反应________ ;
④复分解反应 ________ .
16.如图是硝酸钾和氯化钠的溶解度曲线,请回答:
(1)50℃时,100g水中最多可以溶解________g硝酸钾。
(2)20℃时,向100g水中加入30g硝酸钾固体,充分搅拌后,所得溶液为________溶液(填“饱和”或“不饱和”),将该溶液升温到50℃时,其质量分数是________(只列计算式)
(3)欲将硝酸钾溶液从A点转化为B点,可采取的措施是________。
(4)20℃时,将KNO3、NaCl两种物质的饱和溶液各100g,分别恒温蒸发10g水,析出晶体最多的是________(填“KNO3”或“NaCl”)。
答案解析部分
一、单选题
1.【答案】 C
【解析】【解答】图象的意义是:随着乙的不断加入,反应开始没有沉淀生成,然后沉淀逐渐增加;A、氢氧化钠溶液不与硫酸钠反应,但能与硫酸铜反应生成氢氧化铜沉淀,所以开始就有沉淀生成,不符合图象,A不符合题意;
B、纯碱溶液不与氯化钠反应,纯碱溶液和氯化钙的反应生成碳酸钙沉淀,所以开始就有沉淀生成,不符合图象,B不符合题意;
C、盐酸不会和氯化钡溶液反应,盐酸和纯碱溶液反应消耗完后,纯碱溶液氯化钡溶液生成碳酸钡沉淀,所以反应开始没有有沉淀,一段时间后才有沉淀,所以符合图象,C符合题意;
D、氯化钡溶液不与稀盐酸反应,氯化钡溶液和稀硫酸反应生成的硫酸钡沉淀不溶于稀硫酸,所以开始就有沉淀生成,不符合图象,D不符合题意。
故答案为:C。
【分析】A根据硫酸钠不会与氢氧化钠反应,硫酸铜与氢氧化钠反应生成氢氧化铜和硫酸钠解答
B氯化钠不与碳酸钠反应,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠解答
C根据稀盐酸和氯化钡的混合溶液,滴加碳酸钠溶液,碳酸钠先和稀盐酸反应,在和氯化钡反应
D根据硫酸根离子和钡离子一接触就会生成沉淀解答
2.【答案】 D
【解析】【解答】A.溶液的沸点比水高,所以煮沸的汤比煮沸的水温度高,A不符合题意;
B.在积雪的公路上撒盐可降低雪水的凝固点,加快冰雪融化,B不符合题意;
C.硝酸铵溶解吸热,氢氧化钠溶解放热,可用水区分NaOH固体和NH4NO3固体,C不符合题意;
D. 用洗涤剂除油污是因为洗涤剂能将油污乳化,D符合题意;
故答案为:D。
【分析】根据溶液能使水的凝固点降低沸点升高分析;根据物质溶解放热与吸热现象分析;根据洗涤剂具有乳化作用,可乳化油污分析。
3.【答案】 A
【解析】【分析】A、根据溶液的特点考虑;B、根据溶液溶解度的影响因素考虑;C、根据溶液的特点考虑;D、根据溶液的判断方法考虑.
【解答】A、溶液具有均一性,所以溶液的各部分性质均相同,故A正确;
B、搅拌溶液可以加快物质的溶解速度,不能改变溶解度,故B错;
C、由于溶液具有均一性,将10%的KNO3溶液倒出一半,剩余溶液中溶质的质量分数仍为10%,故C错;
D、溶液必须是均一、稳定的混合物,不一定无色,故D错.
故选A.
【点评】解答本题关键是要根据溶液的均一性和溶液判断方法,必须满足溶液的三个特点才属于溶液,搅拌只能影响溶解速度,温度能影响物质的溶解度
4.【答案】 C
【解析】【解答】A. 面粉以固体颗粒和水分子混合,形成的不是均一稳定的混合物,不是溶液; A不符合题意
B. 豆油以油滴和水分子混合,形成的不是均一稳定的混合物,不是溶液; B不符合题意
C. 冰糖以蔗糖分子和水分子混合,形成的是均一稳定的混合物,是溶液; C符合题意
D. 牛奶以油滴、固体颗粒等与水分子混合,形成的不是均一稳定的混合物,不是溶液。D不符合题意
故答案为:C。
【分析】溶液是均一、稳定的混合物,在溶液中各物质以分子、原子等微观粒子的形式相互混合。据此分析解答
5.【答案】 D
【解析】【解答】A、甲的溶解度大于乙的溶解度,不正确,比较溶解度要指明温度.
B、t1℃时,50g甲的饱和溶液中有15g甲,不正确,溶解度对于的溶剂是100克,所以50克甲的饱和溶液中的溶质不到15克.
C、t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液,不正确,因为甲的溶解度随温度升高而增大,故降低温度,甲的饱和溶液还是饱和的,并且有甲的晶体析出.
D、当甲中含有少量乙时,可以用降温结晶的方法提纯甲,正确,因为甲的溶解度受温度影响变化大,乙的溶解度受温度影响很小.
故选D
【分析】溶 解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况.溶解度曲线有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的 变化而变化的情况. (2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小. (3)根据溶解度曲线,选择分离某些可溶性混合物的方法.本题较全面的考查了有关溶解度曲线的应用,涉及到温度,饱和,100克溶剂等重要条件.
6.【答案】A
【解析】【解答】解:①白炽灯工作时,电能转化为光能和热能,故错误.②电解水时,电能主要变为化学能,故正确;③化合物中各元素的代数和为0,故正确;④生活中,“娃哈哈”、“农夫山泉”、矿泉水等物质都是由多种物质组成的物质,都是混合物,故错误;⑤氢氧化钙和盐酸反应的化学方程式为:
2NaOH+
2HCl=CaCl2+2H2O
80
73
氯化氢和氢氧化钠完全反应的质量比是73:80,但题目中未说明两种溶液中溶质的质量分数,故不知氯化氢和氢氧化钠的质量,无法判断谁过量,故错误;⑥科学家把由四个中子构成的粒子称为“四中子”,不是新发现的元素,故错误;⑦升高温度不一定能使饱和溶液变成不饱和溶液,例如氢氧化钙的溶解度随着温度的升高而减小,升高温度时,饱和氢氧化钙溶液仍然是饱和溶液,故错误.
故选:A.
【分析】①白炽灯工作时电能全部变为光能;②水电解时生成氢气和氧气2H2O 2H2↑+O2↑将电能转化为化学能;③根据化合物中各元素的代数和为0进行解答;④生活中的饮料绝大多数是混合物;⑤根据计算结果判定“酸碱发生中和反应后酸和碱哪种物质过量”是本题的关键,但题目中未说明两种溶液中溶质的质量分数,故无法判断谁过量;⑥中子是原子核的构成部分;⑦有些的溶解度随着温度的升高而减小.
7.【答案】D
【解析】【解答】解:A、氧化钙溶于水与水反应生成氢氧化钙,氢氧化钙做溶质;溶质的质量不是1g;故溶质的质量分数不是1%;故错
B、氢氧化钙随温度的升高而减小降温会变成不饱和溶液;故错
C、氯化钠属于盐在溶液中电离出钠离子和氯离子;故错
D、物质在溶解的过程中,有的放出热量,有的吸收热量;正确
故选D
【分析】A、氧化钙溶于水与水反应生成氢氧化钙,氢氧化钙做溶质;
B、氢氧化钙随温度的升高而减小降温会变成不饱和溶液;
C、氯化钠属于盐在溶液中以离子形式存在
D、在溶解的过程中,有的放出热量,有的吸收热量
8.【答案】 D
【解析】【解答】解:A、均一的、稳定的液体不一定是溶液,如水是均一的、稳定的液体,但不是混合物,不是溶液,故选项说法错误.
B、溶液的本质特征是均一性、稳定性,属于混合物,故选项说法错误.
C、溶液不一定都是无色的,有些溶液是有颜色的,如硫酸铜溶液是蓝色的;故选项说法错误.
D、溶液的本质特征是均一性、稳定性,属于混合物,故选项说法正确.
故选D.
【分析】溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物;据此结合各选项的说法分析判断.
9.【答案】 A
【解析】【解答】A、白糖易溶于水,能形成均一、稳定的混合物,属于溶液,选项符合题意;
B、面粉不溶于水,与水混合形成的是悬浊液,选项不符合题意;
C、花生油不溶于水,与水混合形成的是乳浊液,选项不符合题意.
D、胡椒粉不溶于水,与水混合形成悬浊液,选项不符合题意。
故答案为:A。
【分析】A、白糖在水中以分子的形式分散,能形成溶液;
B、面粉是以固体小颗粒分散在水中,形成悬浊液;
C、花生油是以小液滴分散在水中,形成的是乳浊液;
D、胡椒粉是以以固体小颗粒分散在水中,形成悬浊液;
10.【答案】 A
【解析】【解答】海水晒盐原理是通过水分蒸发使氯化钠析出,甲蒸发水后形成乙,没有固体析出,则甲为不饱和溶液,乙蒸发水后形成丙有固体析出,乙可能是饱和溶液可能是不饱和溶液,丙、丁溶液有固体析出,则丙丁为饱和溶液;
故答案为:A。
【分析】根据饱和溶液与不饱和溶液定义分析。
二、填空题
11.【答案】 降低温度 ;蒸发结晶 ;16.7% ;B>A>C
【解析】【解答】解:(1)C物质的溶解度随温度的升高而减小,所以要使C的饱和溶液成为不饱和溶液,可采用降低温度的方法;
(2)A物质的溶解度受温度影响较大,B物质的溶解度受温度影响较小,所以要除去B中的少量A,可采用蒸发结晶的方法;
(3)t1℃时,A物质的溶解度是20g,所以将15gA加入到装有50g水的烧杯中,充分搅拌,所得溶液的溶质质量分数为:×100%=16.7%;
(4)A、B物质的溶解度随温度的升高而增大,C物质的溶解度随温度的升高较小,通过分析溶解度曲线可知,将t2℃时三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序是B>A>C.
故答案为:(1)降低温度;
(2)蒸发结晶;
(3)16.7%;
(4)B>A>C.
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
12.【答案】不能 ;浓硫酸溶于水放热,溶液温度升高使Ca(OH)2析出 ;会 ;A=C>B
【解析】【解答】(1)稀释浓硫酸的操作应该是酸入水,否则会使由于放出大量的热而使酸液飞溅发生危险,故答案为:不能.
(2)浓硫酸溶于水会放热,使溶液温度升高,导致氢氧化钙的溶解度变小,溶质析出.故答案为:浓硫酸溶于水放热,溶液温度升高使Ca(OH)2析出.
(3)Mg和稀盐酸反应时也会放出热量,因此会出现相同的现象,故答案为:会.
(4)A、C是常温时的氢氧化钙的饱和溶液,B是温度升高后的氢氧化钙的饱和溶液,由于氢氧化钙的溶解度随温度升高而降低,故溶质质量分数的关系是A=C>B.故答案为:A=C>B.
【分析】(1)稀释浓硫酸的操作应该是酸入水,否则会使酸液飞溅发生危险.
(2)浓硫酸溶于水会放热,使溶液温度升高,导致氢氧化钙的溶解度变小.
(3)Mg和稀盐酸反应也会放热,也会出现相同的现象.
(4)A、B、C中A、C是常温时的氢氧化钙的饱和溶液,B是高温时的氢氧化钙的饱和溶液,利用这一关系可解决此题.
13.【答案】饱和浓溶液;饱和稀溶液;不饱和浓溶液;不饱和稀溶液
【解析】【解答】解:从图中可以看出A处是饱和溶液和浓溶液的相交的区域,故A是饱和浓溶液; B是饱和溶液和稀溶液的相交处,B是饱和稀溶液;
C是不饱和溶液和浓溶液的相交处,C是不饱和浓溶液,
D处是不饱和溶液和浓溶液的相交的区域,故D是不饱和稀溶液;
故答案:A.饱和浓溶液 B.饱和稀溶液 C.不饱和浓溶液 D.不饱和稀溶液
【分析】饱和溶液和不饱和溶液的本质区别是:继续加入该溶质看能否溶解,和溶液的浓稀没有必然的关系.
三、解答题
14.【答案】加入硝酸钾;蒸发溶剂;降低温度
【解析】【解答】由硝酸钾的溶解度随温度的降低而减小,所以不饱和溶液转化为饱和溶液的方法有:加入溶质,蒸发溶剂,降低温度,所以使接近饱和的硝酸钾溶液变为饱和溶液方法有:加入硝酸钾,蒸发溶剂,降低温度.
故答案为:加入硝酸钾;蒸发溶剂;降低温度.
【分析】根据饱和溶液与不饱和溶液的转化关系考虑本题.
四、综合题
15.【答案】(1)H2O(水)
(2)B
(3)A
(4)CuO+H2Cu+H2O ;CaO+H2O=Ca(OH)2 ;Ca(OH)2+2HCl=CaCl2+2H2O
【解析】【解答】(1)生理盐水是在水中溶解的食盐即氯化钠,所以溶剂是水;
(2)工业废水处理达标后排放,有利于保护水资源;而大量使用化肥农药、使用含磷洗衣粉、生活污水直接排放等都会污染水资源,造成水质恶化;
(3)水蒸发发生了物理变化,状态改变了,并且水分子不断的在运动;但水分子没有发生化学变化,水分子没有分解成氢原子和氧原子.故A水分子不断运动的说法正确;
(4)②如氢气与氧化铜在加热条件下反应生成铜和水,该反应由一种单质和一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念.
该反应的化学方程式为:H2+CuOCu+H2O;
③该反应由两种物质反应生成一种物质,符合化合反应的概念.该反应的化学方程式为:CaO+H2O=Ca(OH)2(其他酸性氧化物或者可溶性碱对应的金属氧化物也可以);
④如氢氧化钙与盐酸反应生成碳酸钙和水,该反应由两种化合物互相交换成分反应生成两种新的化合物,符合复分解反应的概念.该反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O(和上一空对应即可).
故答案为:(1)H2O(水);
(2)B;
(3)A;
(4)②CuO+H2Cu+H2O;③CaO+H2O=Ca(OH)2;④Ca(OH)2+2HCl=CaCl2+2H2O.
【分析】首先考虑生理盐水的组成,确定水是溶剂;然后分析出工业废水处理达标后排放,有利于保护水资源,而大量使用化肥农药、使用含磷洗衣粉、生活污水直接排放等都会污染水资源;水蒸发发生了物理变化,状态改变了,并且水分子不同的在运动;书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须遵守质量守恒定律、依据客观事实,只有熟悉四种基本反应类型的概念,才能正确解答本题.
16.【答案】(1)85.5
(2)不饱和;×100%
(3)降温至20℃
(4)NaCl
【解析】【解答】(1)由图可知,50℃时,硝酸钾溶解度为85.5g,故50℃时,100g水中最多可以溶解85.5g硝酸钾;(2)由图可知,20℃时,硝酸钾溶解度为31.6g,故20℃时,向100g水中加入30g硝酸钾固体,充分搅拌后,所得溶液为不饱和溶液;将该溶液升温到50℃时,溶质和溶剂质量不变,其质量分数= ×100%;(3)A点为硝酸钾不饱和溶液,B点为硝酸钾饱和溶液,故将硝酸钾溶液从A点转化为B点,可采取的措施是降温至20℃;(4)20℃时,氯化钠的溶解度大于硝酸钾的溶解度,故两种物质的饱和溶液各100g中含溶质质量较大的是氯化钠,故分别恒温蒸发10g水,析出晶体最多的是氯化钠。
故答案为:(1) 85.5 (2) 不饱和 ; ×100% (3) 降温至20℃ (4) NaCl
【分析】(1)根据溶解度的概念结合溶解度曲线图分析解答
(2)根据 20℃时, 硝酸钾的溶解度解答啊,溶液中溶质的质量分数等于溶质的质量除以溶液的质量解答
(3)根据溶液由不饱和转化为饱和的方法解答
(4)根据物质的溶解度随温度的变化情况确定提纯方法
化学九年级全册4 酸碱中和反应同步训练题: 这是一份化学九年级全册4 酸碱中和反应同步训练题,共14页。试卷主要包含了单选题,填空题,解答题,综合题等内容,欢迎下载使用。
鲁教版 (五四制)九年级全册3 海水“制碱”一课一练: 这是一份鲁教版 (五四制)九年级全册3 海水“制碱”一课一练,共4页。试卷主要包含了下列做法错误的是,下列关于化肥的说法正确的是,下列物质能做钾肥的是等内容,欢迎下载使用。
化学九年级全册1 酸及其性质课时训练: 这是一份化学九年级全册1 酸及其性质课时训练,共12页。试卷主要包含了单选题,填空题,解答题,综合题等内容,欢迎下载使用。













