

2022届山东省济南外国语学校高三上学期11月月考化学试题含答案
展开
这是一份2022届山东省济南外国语学校高三上学期11月月考化学试题含答案,共12页。试卷主要包含了5,Fe-56,Ba-137,1 溶液中通入少量,7,则溶液中,6%,2 g等内容,欢迎下载使用。
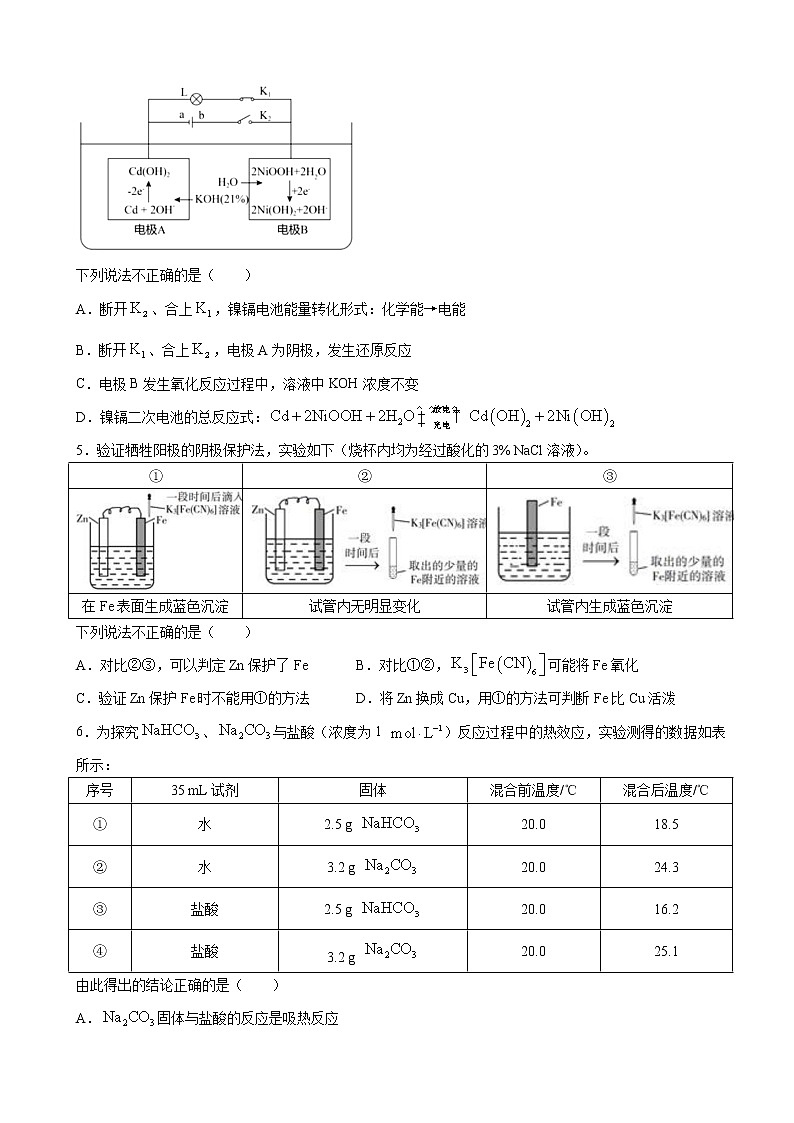
济南外国语学校高三年级十一月阶段性测试化学试题原子量:H-1,C-12,O-16,Na-23,Al-27,S-32,C-l35.5,Fe-56,Ba-137第Ⅰ卷(选择题)一、单选题1.下列说法正确的是( )A.天然气、水煤气、沼气等不可再生能源,完全燃烧主要产物均为和B.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀C.农村推广风力发电、光伏发电有利于“碳达峰、碳中和”D.“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能2.下列说法正确的是( )①氯化钠溶液在电流作用下电离成钠离子和氯离子②溶于水电离出的化合物都是酸③难溶于水,但属于强电解质④金属铜能导电,但它不是电解质,是非电解质⑤溶于水,溶液能导电,故属于电解质⑥相同条件下,浓度相同的盐酸和醋酸溶液导电能力相同⑦在熔融状态下电离生成三种离子A.③⑥ B.①④⑦ C.②③⑥ D.④⑦3.下列离子方程式书写正确的是( )A.溶于HI溶液:B.溶液与溴水反应:C.NaOH溶液与过量溶液反应:D.0.1 溶液中通入少量:4.镍镉电池是二次电池,其工作原理示意图如下(L为小灯泡,、为开关,a、b为直流电源的两极)。下列说法不正确的是( )A.断开、合上,镍镉电池能量转化形式:化学能→电能B.断开、合上,电极A为阴极,发生还原反应C.电极B发生氧化反应过程中,溶液中KOH浓度不变D.镍镉二次电池的总反应式:5.验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3% NaCl溶液)。①②③在Fe表面生成蓝色沉淀试管内无明显变化试管内生成蓝色沉淀下列说法不正确的是( )A.对比②③,可以判定Zn保护了Fe B.对比①②,可能将Fe氧化C.验证Zn保护Fe时不能用①的方法 D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼6.为探究、与盐酸(浓度为1 )反应过程中的热效应,实验测得的数据如表所示:序号35 mL试剂固体混合前温度/℃混合后温度/℃①水2.5 g 20.018.5②水3.2 g 20.024.3③盐酸2.5 g 20.016.2④盐酸3.2 g 20.025.1由此得出的结论正确的是( )A.固体与盐酸的反应是吸热反应B.固体与盐酸的反应是放热反应C.20.0℃时,含3.2 g 的饱和溶液和35 mL盐酸混合后的温度将低于25.1℃D.20.0℃时,含2.5 g 的饱和溶液和35 mL盐酸混合后的温度将低于16.2℃7.反应经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度随时间的变化曲线如图所示。下列说法错误的是( )A.a为随的变化曲线 B.时,C.时,Y的消耗速率大于生成速率 D.后,8.在容积均为1 L的a、b、c三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:,当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )A.正反应为吸热反应,平衡常数B.反应进行到5 min时,a容器中C.b中大于a中D.达到平衡时,a、b、c中CO的转化率:b>c>a9.丙烷经催化脱氢可制丙烯:。600℃,将一定浓度的与固定浓度的通过含催化剂的恒容反应器,经相同时间,流出的、CO和浓度随初始浓度的变化关系如图。已知:① ② ③ 下列说法不正确的是( )A. B.和变化差异的原因:C.其他条件不变,投料比越大,转化率越大D.若体系只有、CO、和生成,则初始物质浓度与流出物质浓度之间一定存在:10.常温下,下列有关电解质溶液的说法错误的是( )A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则B.相同浓度的和两溶液等体积混合后pH约为4.7,则溶液中C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则D.在1 mol/L 溶液中,二、不定项选择题(每题4分,漏选2分)11.常温下,已知溶液中含磷物种的浓度之和为0.1 ,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(),pOH表示的浓度负对数[];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是( )A.曲线①表示pc()随pOH的变化B.的结构简式为C.pH=4的溶液中:D.的平衡常数12.科学家最近发明了一种电池,电解质为、、KOH,通过x和y两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域(a>b),结构示意图如图所示。下列说法错误的是( )A.通过X膜移向M区B.R区域的电解质浓度逐渐减小C.放电时,Al电极反应为:D.消耗1.8 g Al时,N区域电解质溶液减少16.0 g13.已知: ,向一恒温恒容的密闭容器中充入1 mol A和3 mol B发生反应,时达到平衡状态Ⅰ,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )A.容器内压强不变,表明反应达到平衡 B.时改变的条件:向容器中加入CC.平衡时A的体积分数: D.平衡常数:14.在3个体积均为2.0 L的恒容密闭容器中,反应 分别在一定温度下达到化学平衡状态。下列说法正确的是( )容器温度()起始时物质的量/mol平衡时物质的量/molⅠ0.61.2000.2Ⅱ1.21.200xⅢ000.60.6yA.当温度为时,该反应的化学平衡常数值为0.05B.若5 min后容器Ⅰ中达到平衡,则5 min内的平均反应速率:C.达到平衡时,容器Ⅱ中的转化率比容器Ⅰ中的小D.达到平衡时,容器Ⅲ中的CO的转化率小于66.6%15.高铁酸钾()是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数随pH的变化如图所示[已知]。下列说法正确的是( )A.、都属于强电解质B.由B点数据可知,的第一步电离常数C.25℃,的平衡常数D.A、C两点对应溶液中水的电离程度不相等第Ⅱ卷(非选择题)三、填空题(每空2分)16.(20分)、是中学化学中常见的弱酸,请回答下列问题:(1)常温下,下列叙述能证明为弱酸是______。a.溶液的pH大于7;b.相同体积相同浓度的盐酸和醋酸溶液,分别与足量锌粉反应,放出相同体积的氢气;c.相同体积、相同pH的盐酸和醋酸,醋酸中和NaOH的物质的量多;d.0.01 mol/L的溶液,PH>2(2)常温下,向0.1 溶液中加蒸馏水稀释,稀释后,下列各量增大的是______:a. b. c.(3)将浓度均为0.1 mol/L 和溶液等体积混合,测得混合液中,则下列关系式中正确的是______A. B.C. D.(4)若等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,溶液呈______(填“酸性”,“中性”或“碱性”),原因是______(用离子方程式表示)。若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈______(填“酸性”,“中性”或“碱性”),溶液中______(填“>”或“=”或“<”)。(5)25℃时,的电离常数,,则该温度下的水解平衡常数______mol/L。Ⅱ.常温下,将NaOH溶液滴加到亚磷酸()溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则:(6)表示的是曲线______(填“Ⅰ”或“Ⅱ”);(7)亚磷酸()的______17.(12分)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。方法Ⅰ:氨热分解法制氢气一定温度下,利用催化剂将分解为和,回答下列问题:(1)已知反应 ,在下列哪些温度下反应能自发进行?______(填标号)。A.25℃ B.125℃ C.225℃ D.457℃(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol 通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。①若保持容器体积不变,时反应达到平衡,用的浓度变化表示时间内的反应速率______(用含的代数式表示)②时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后分压变化趋势的曲线是______(用图中a、b、c、d表示)。③在该温度下,反应的标准平衡常数______。(已知:分压=总压×该组分物质的量分数,对于反应,,其中,、、、为各组分的平衡分压)。方法Ⅱ:氨电解法制氢气利用电解原理,将氨转化为高纯氢气,其装置如图所示。(3)电解过程中的移动方向为______(填“从左往右”或“从右往左”)。(4)阳极的电极反应式为______。18.(12分)当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:物质C(石墨,s)燃烧热/()-286394-3268则25℃时和C(石墨,s)生成的热化学方程式为______。(2)一氧化碳与氢气的反应历程如图,其中吸附在催化剂表面上的物种用*标注。①该反应历程中控速步骤的能垒为______eV。②写出虚线框内发生的化学反应方程式______。(3)105℃时,将足量的某碳酸氢盐()固体置于真空恒容容器中,存在如下平衡:。上述反应达平衡时体系的总压为46 kPa。保持温度不变,开始时在体系中先通入一定量的,再加入足量,欲使平衡时体系中水蒸气的分压小于5 kPa,的初始压强应大于______kPa。(4)我国科学家研究电池,取得了重大科研成果,回答下列问题:电池中,Li为单质锂片,则该电池中的在______(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。Ⅰ. Ⅱ.Ⅲ.______ Ⅳ.19.(16分)中国提出力争于2030年前实现碳达峰,2060年前实现碳中和,因此碳的捕集和利用成了研究的重点。(1)目前国际空间站处理的一个重要方法是将还原,所涉及的反应方程式为:。已知的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)平衡常数转化率________________________(2)在常压、催化下,和混和气体(体积比1∶4,总物质的量 mol)进行反应,反应相同时间时测得转化率、和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的中生成或CO的百分比)。反应Ⅰ: 反应Ⅱ: ①下列说法不正确的是______。A.小于零B.温度可影响产物的选择性C.平衡转化率随温度升高先增大后减少D.其他条件不变,将和的初始体积比改变为1∶3,可提高平衡转化率②350℃时,反应Ⅰ在时刻达到平衡,平衡时容器体积为L,该温度下反应Ⅰ的平衡常数为______(用、表示)。(3)常温下,用NaOH溶液作捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品。①若某次捕捉后得到pH=10的溶液,则溶液中______。(已知:常温下、)②欲用2 L 溶液将2.33 g 固体全都转化为,则所用的溶液的物质的量浓度至少为______。(已知:常温下,。)(忽略溶液体积的变化) 答案:1~5.CABCD;6~10.CBCCA;11.D;12.AB;13.BD;14.AC;15.BD16.【答案】(1)acd;(2)c;(3)AD(4)碱性 酸性 < (6)Ⅰ;(7)17.【答案】(1)CD(2) b 0.48(3)从右往左(4)18.【答案】(1) (2)0.8 (3)100.8(4)正极 19.【答案】(1)增大 增大 减小 减小(2)CD (3)0.54 0.055 mol/L
相关试卷
这是一份山东省济南外国语学校2022-2023学年高一上学期期末考试化学试题(含答案解析),文件包含精品解析山东省济南外国语学校2022-2023学年高一上学期期末考试化学试题原卷版docx、精品解析山东省济南外国语学校2022-2023学年高一上学期期末考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
这是一份2022-2023学年山东省济南外国语学校高一上学期期末考试化学试题(解析版),共17页。
这是一份2023济南外国语学校高一上学期12月月考化学试题含解析,文件包含山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题含解析docx、山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。









