



(全国通用)高考化学二轮热点题型归纳与变式演练 专题29 电化学计算的三种常用方法(解析+原卷)学案
展开【题型一】 根据总反应式计算…………………………………………………………..………………1
【题型二】 根据电子守恒计算………………………………………………………...…………………5
【题型三】 根据关系式计算…………………………………………………………………...…………9
二、最新模考题组练……………………………………………………………………………………………13
【题型一】 根据总反应式计算
【典例分析】
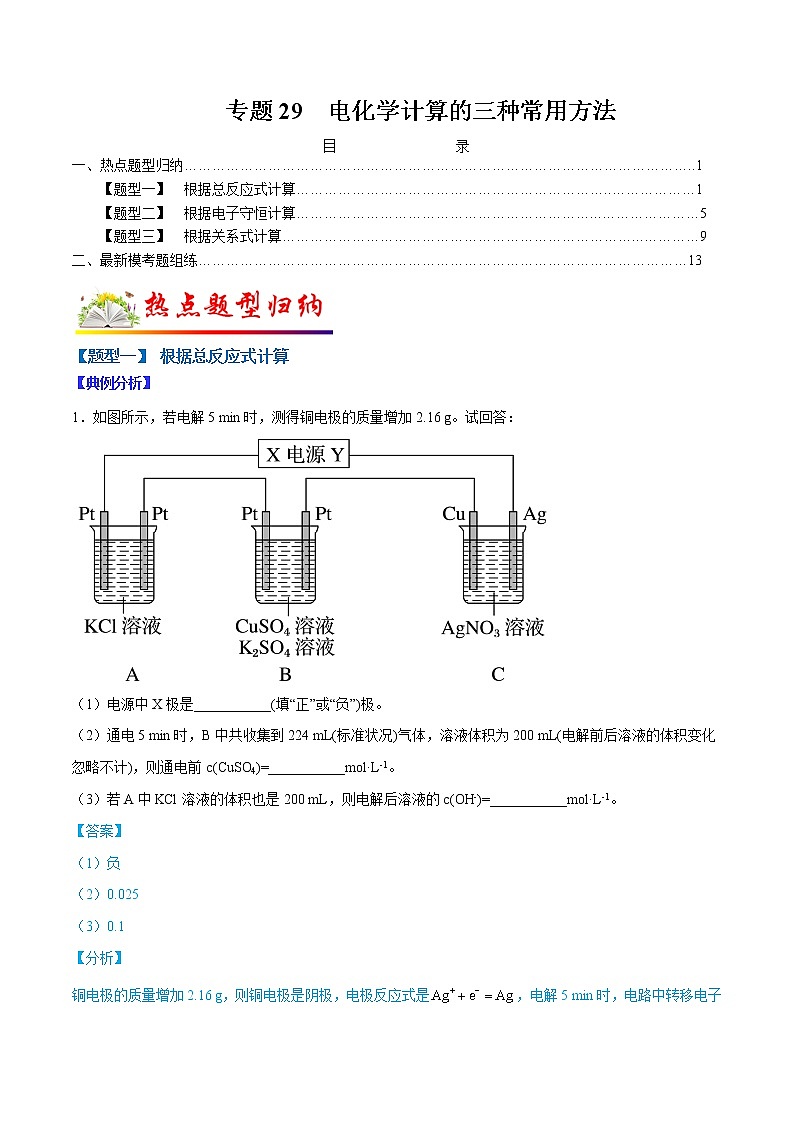
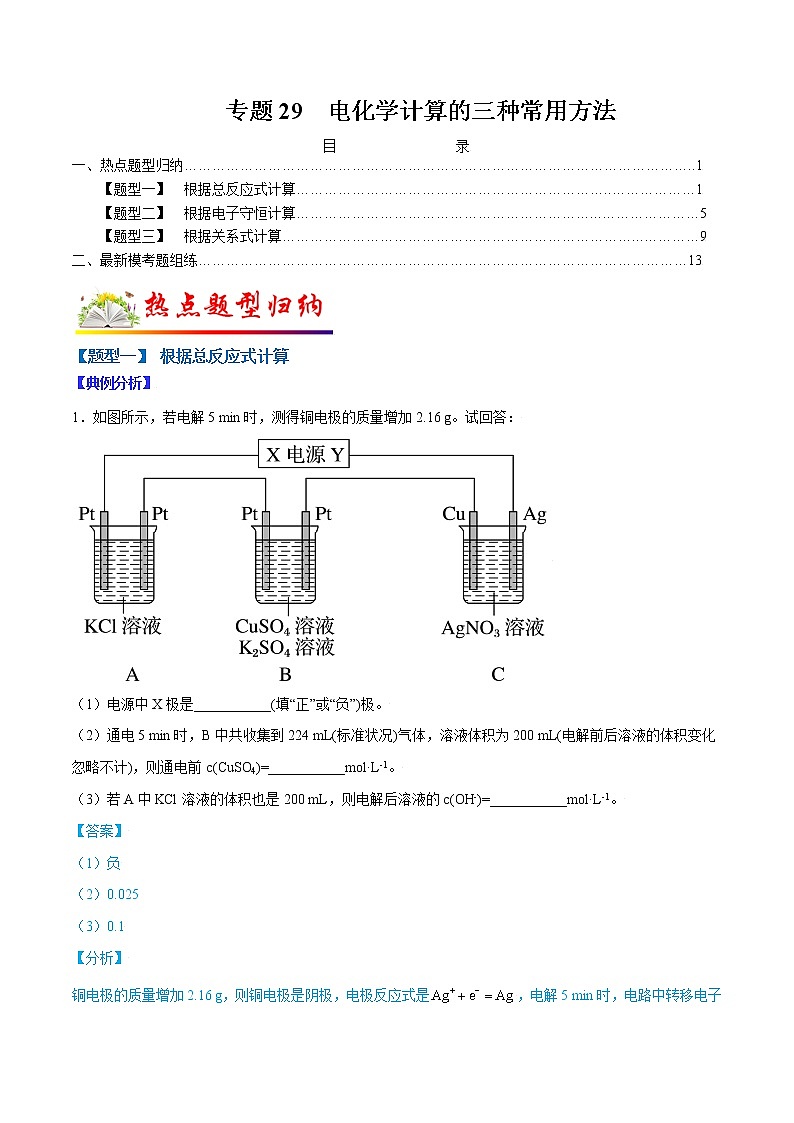
1.如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:
(1)电源中X极是___________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=___________ml·L-1。
(3)若A中KCl溶液的体积也是200 mL,则电解后溶液的c(OH-)=___________ml·L-1。
【答案】
(1)负
(2)0.025
(3)0.1
【分析】
铜电极的质量增加2.16 g,则铜电极是阴极,电极反应式是,电解5 min时,电路中转移电子的物质的量是。
(1)铜电极的质量增加2.16 g,说明铜电极是阴极,则X为负极;
(2)B中阳极反应式是,通电5 min时,生成氧气的物质的量是0.02ml÷4=0.005ml, 则B中阴极生成氢气的物质的量是,生成氢气转移电子0.01ml,根据电子守恒,生成铜转移电子0.02ml-0.01ml=0.01ml,生成铜的物质的量是,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=;
(3)A中电解的总反应式是↑+H2↑ ,电解5 min时,电路中转移电子的物质的量是0.02ml,则A中生成KOH的物质的量是0.02ml,若A中KCl溶液的体积也是200 mL,则电解后溶液的c(OH-)=。
【提分秘籍】
根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
【变式演练】
1.某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量,体积均为1L),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲、乙、丙三池中为原电池的是___________(填“甲池”,“乙池”,“丙池”),A电极的电极反应式为___________。
(2)丙池中E电极为 ___________ (填“正极”、“负极”、“阴极”或“阳极”),该池总反应的化学方程式为___________。
(3)当甲池中B电极上消耗O2的体积为560mL(标准状况)时,乙池中C极质量理论上减轻___________g,则丙池溶液的pH为___________
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___________ (填选项字母)。
A.CuB.CuOC.CuCO3D.Cu(OH)2
【题型二】 根据电子守恒计算
【典例分析】
1.钠离子电池因具有安全性高、能量密度大等特点而具有良好的发展前景。某钠离子电池工作原理如图所示,下列有关说法中正确的是
A.②表征的是放电时的电子流向
B.放电时,M极电极反应式为MO3+xe-+xNa+=NaxMO3
C.若使用氢氧燃料电池给该电池充电,氢电极应连接M极
D.充电时,外电路中每转移0.2mle-,理论上N极将减重4.6g
【答案】B
【解析】
A.由电池的工作原理图可知放电时Na转变为Na+ ,N极为负极,M极为正极。②表征的是充电时电子的流向,A项错误;
B.放电时,M极的电极反应式为MO3+xe-+xNa+=NaxMO3,B项正确;
C.若使用氢氧燃料电池给该电池充电,氢电极应连接该电池负极,即N极,C项错误;
D.充电时,由电子守恒可知外电路每转移0.2 mle- ,理论上N极将增重4.6 g,D项错误;
故选:B。
【提分秘籍】
根据电子守恒计算
①用于串联电路中阴、阳两极产物或正、负两极产物在相同电量时的计算,其依据是各电极上转移的电子数相等。
②用于混合溶液中电解的分阶段计算。
【变式演练】
1.相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和。下列说法不正确的是
A.a电极的电极反应式为
B.电池放电过程中,电极上的电极反应式为
C.c、d离子交换膜依次为阴离子交换膜和阳离子交换膜
D.电池从开始工作到停止放电,电解池理论上可制得
2.“长征”火箭发射使用的是偏二甲肼[(CH3)2NNH2]清洁燃料,产生巨大能量将火箭送上太空。某校外研究性学习小组根据电化学原理设计如下装置。下列说法错误的是
A.石墨C1为阳极
B.通入O2一极的电极反应式为:O2+4e-+4H+=2H2O
C.一段时间后,向乙中加入0.2ml Cu(OH)2后恰好使溶液复原,则通入O2 6.4g
D.当消耗0.1ml(CH3)2NNH2时,C1电极产生4.48L气体(标准状况)
【题型三】 根据关系式计算
【典例分析】
1.电解法处理酸性含铬废水(主要含有Cr2O)时,以铁板作阴、阳极,处理过程中存在反应Cr2O+6Fe2++14H+=2Cr3+ +6Fe3+ +7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是
A.阳极反应为Fe-2e- =Fe2+
B.电解过程中溶液pH不断减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移6ml电子,最多有0. 5 ml Cr2O被还原
【提分秘籍】
根据关系式计算
根据得失电子守恒关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。
如以通过4 ml e-为桥梁可构建如下关系式:
(式中M为金属,n为金属离子的化合价数值)
该关系式具有总揽电化学计算的作用,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。
提示:在电化学计算中,还常利用Q=I·t和Q=n(e-)×NA×1.60×10-19C来计算电路中通过的电量。
【变式演练】
1.科学家采用碳基电极材料设计了一种制取氯气的新工艺方案,装置如图示。下列说法正确的是
A.电解池可用铁作阴极,铜作阳极
B.阴极反应式为
C.电路中转移1ml电子,消耗氧气5.6L
D.该工艺的总反应为
2.某同学设计用NO—空气质子交换膜燃料电池探究将雾霾中的SO2、NO转化为的原理。
下列说法正确的是
A.甲、乙装置中NO均被氧化,物质A为HNO3
B.燃料电池放电过程中正极的电极反应式为
C.若甲装置中消耗22.4LO2(标况),则乙装置中SO2和NO转化的物质的量共有2.8ml
D.该装置中,电子的转移方向为Pt(I)→石墨(II)→电解质溶液→石墨(I)→Pt(II)
1.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是
A.理论上锌的质量每减小13g,外电路中通过0.4ml电子
B.电池工作时,锌作负极,失去电子,发生氧化反应,Zn被还原
C.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
D.电池工作时,氢氧化钾电解质溶液中OH-移向负极
2.热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,受热后,电池可瞬间输出电能。该电池的总反应为。下列有关说法错误的是
A.正极上的电极反应式为
B.可用LiCl-KCl的混合水溶液作电解质
C.每转移0.2 ml电子,理论上生成20.7 g Pb
D.常温下,在正、负极间接上电流表,指针不偏转
3.全固态锂硫电池能量密度高、成本低,其工作原理如图所示。其中电极a常用掺有石墨烯的S8材料制作,电池反应式为16Li+xS8=8Li2Sx(2≤x≤8)。,下列说法错误的是
A.电极b的材料是金属锂
B.放电时,电极a上的反应式可表示为xS8+16Li++16e-=8Li2Sx
C.电池充电时,电子从充电电源的负极出发,沿导线流向电极b,再通过电池电解质经电极a流回充电电源的正极
D.电池放电时,当外电路中流过0.3ml电子,负极材料质量减少2.1g
4.利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:。下列说法不正确的是
A.当电路中有2ml电子通过时,阳极会产生11.2L(在标准状况下)气体
B.Na2Cr2O7在阳极室制得
C.电解过程中,阴极溶液pH增大
D.该离子交换膜为阴离子交换膜
5.利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2的装置如图所示。下列说法正确的是
A.a极反应:CH4+8e-+4O2-=CO2+2H2O
B.若去掉C膜,产品室中有可能产生CaHPO4、Ca3(PO4)2等沉淀
C.A、C膜均为阴离子交换膜,B膜为阳离子交换膜
D.标准状况下,a极上通入1.12L甲烷,阳极室Ca2+减少0.4ml
6.用惰性电极电解法制备硼酸(H3BO3)的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是
A.膜A为阴膜,膜B为阳膜
B.产品室中发生的反应为B(OH)+H+=H3BO3+H2O
C.电解过程中,a极附近溶液pH减小
D.电解过程中,阴极与阳极产生的气体物质的量比为1∶2
7.某科研团队利用连续闭合的电化学—化学反应循环实现氮还原的原理示意图如图所示,其中Fe-TiO2作为氮还原的催化剂,则下列说法正确的是
A.氢离子由A电极经过质子交换膜移向B电极
B.电解液中POM2转化为POM1的过程为还原反应
C.A电极的电势高于B电极
D.该电池生成3ml氧气时可还原标准状况下的氮气44.8L
8.利用下图所示的光电催化体系,双极膜可以实现烟气脱。双极膜是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的解离成和,作为和离子源。下列说法正确的是
A.a极为正极
B.阳极反应为:
C.阴极附近pH减小
D.每生成,同时生成
9.如图所示的装置,X、Y都是惰性电极。将电路接通电极后,向乙中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:
(1)甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是___________ (填“CH4”或“O2”),电极上发生的电极反应是___________。
(2)如果丙装置中精铜电极的质量增加了6.4g,则甲装置中消耗的CH4的质量为___________。
10.相同金属在其不同浓度的盐溶液中可形成浓差电池。现用此浓差电池电解Na2SO4溶液(电极a和b均为石墨电极)可以制得O2、H2、H2SO4、NaOH。
(1)当电路中转移1ml电子时,电解池理论上能产生标况下的气体___L。
(2)电池从开始工作到停止放电,电解池理论上可制得NaOH___g。
11.用如图所示装置做电解实验,a、b、c、d均为铂电极,A槽与B槽选择的溶液足量但不同,可供选择的电解质溶液有:①500 mL 2 ml·L-1 CuSO4溶液 ②500 mL 2 ml·L-1NaCl溶液 ③500 mL 2 ml·L-1Na2SO4溶液 ④500 mL2 ml·L-1AgNO3溶液 ⑤500 mL2 ml·L-1CuCl2溶液。
(1)若A槽选择500 mL2 ml·L-1CuCl2溶液,B槽选择500 mL 2 ml·L-1 CuSO4溶液,闭合开关K2,则b极为___________ (填 阴极”或“阳极”),与a极现象相同的电极为___________(填“c极”或“d极”),d极上的电极反应式为___________。
(2)若电解池工作时,a、b、c、d电极均有气体产生,且只有a极产生的是黄绿色气体,则A槽选择的溶液为___________ (填标号,下同),B 槽选择的溶液为___________,闭合的开关是 ___________,相同时间内,a、c电极上产生气体的体积(相同状况)之比为___________。
(3)若A槽选择500 mL2 ml·L-1AgNO3溶液,B槽选择500 mL 2 ml·L-1 CuSO4溶液,闭合开关K1,则析出固体的电极是___________。
(全国通用)高考化学二轮热点题型归纳与变式演练 专题30 电化学中的交换膜(解析+原卷)学案: 这是一份(全国通用)高考化学二轮热点题型归纳与变式演练 专题30 电化学中的交换膜(解析+原卷)学案,文件包含全国通用高考化学二轮热点题型归纳与变式演练专题30电化学中的交换膜解析版docx、全国通用高考化学二轮热点题型归纳与变式演练专题30电化学中的交换膜原卷版docx等2份学案配套教学资源,其中学案共41页, 欢迎下载使用。
(全国通用)高考化学二轮热点题型归纳与变式演练 专题28 新型化学电源(解析+原卷)学案: 这是一份(全国通用)高考化学二轮热点题型归纳与变式演练 专题28 新型化学电源(解析+原卷)学案,文件包含全国通用高考化学二轮热点题型归纳与变式演练专题28新型化学电源解析版docx、全国通用高考化学二轮热点题型归纳与变式演练专题28新型化学电源原卷版docx等2份学案配套教学资源,其中学案共31页, 欢迎下载使用。
(全国通用)高考化学二轮热点题型归纳与变式演练 专题25 关于化学平衡的计算(解析+原卷)学案: 这是一份(全国通用)高考化学二轮热点题型归纳与变式演练 专题25 关于化学平衡的计算(解析+原卷)学案,文件包含全国通用高考化学二轮热点题型归纳与变式演练专题25关于化学平衡的计算解析版docx、全国通用高考化学二轮热点题型归纳与变式演练专题25关于化学平衡的计算原卷版docx等2份学案配套教学资源,其中学案共33页, 欢迎下载使用。












