
苏教版(2019)高考一轮复习专题质检卷九 化学实验基础
展开专题质检卷九 化学实验基础
一、选择题
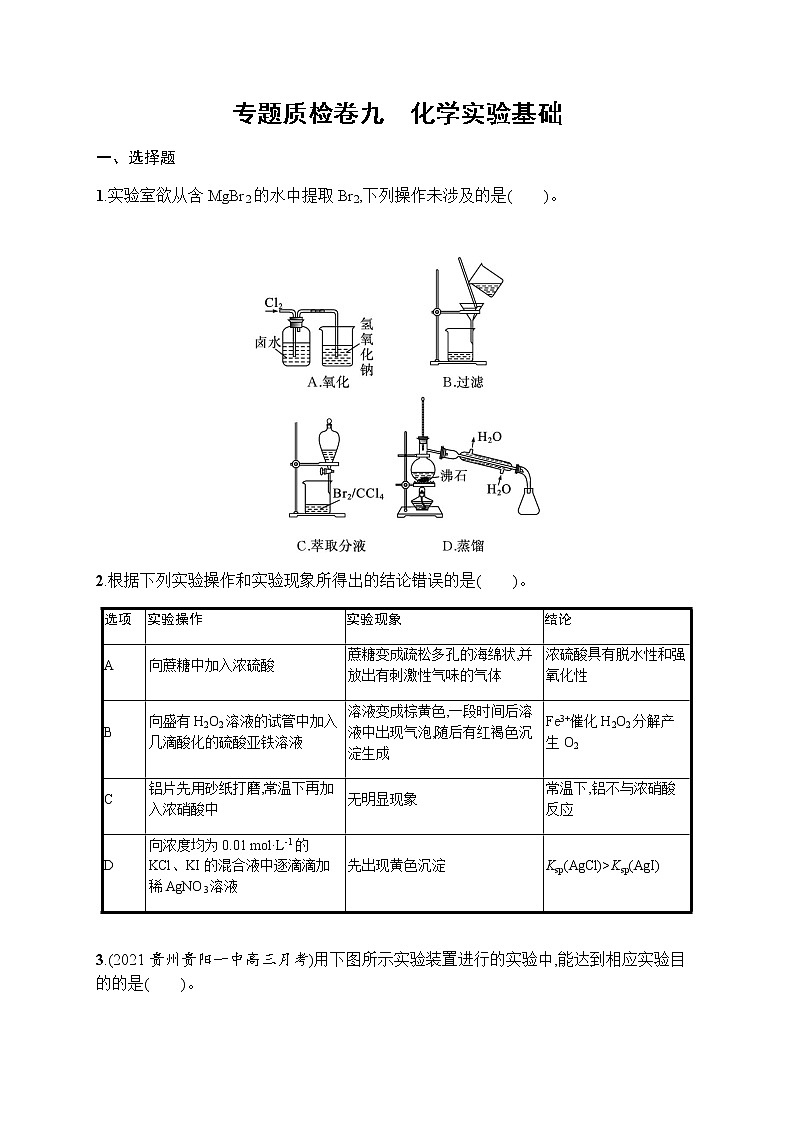
1.实验室欲从含MgBr2的水中提取Br2,下列操作未涉及的是( )。
2.根据下列实验操作和实验现象所得出的结论错误的是( )。
选项 | 实验操作 | 实验现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
B | 向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液 | 溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成 | Fe3+催化H2O2分解产生O2 |
C | 铝片先用砂纸打磨,常温下再加入浓硝酸中 | 无明显现象 | 常温下,铝不与浓硝酸反应 |
D | 向浓度均为0.01 mol·L-1的KCl、KI的混合液中逐滴滴加稀AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
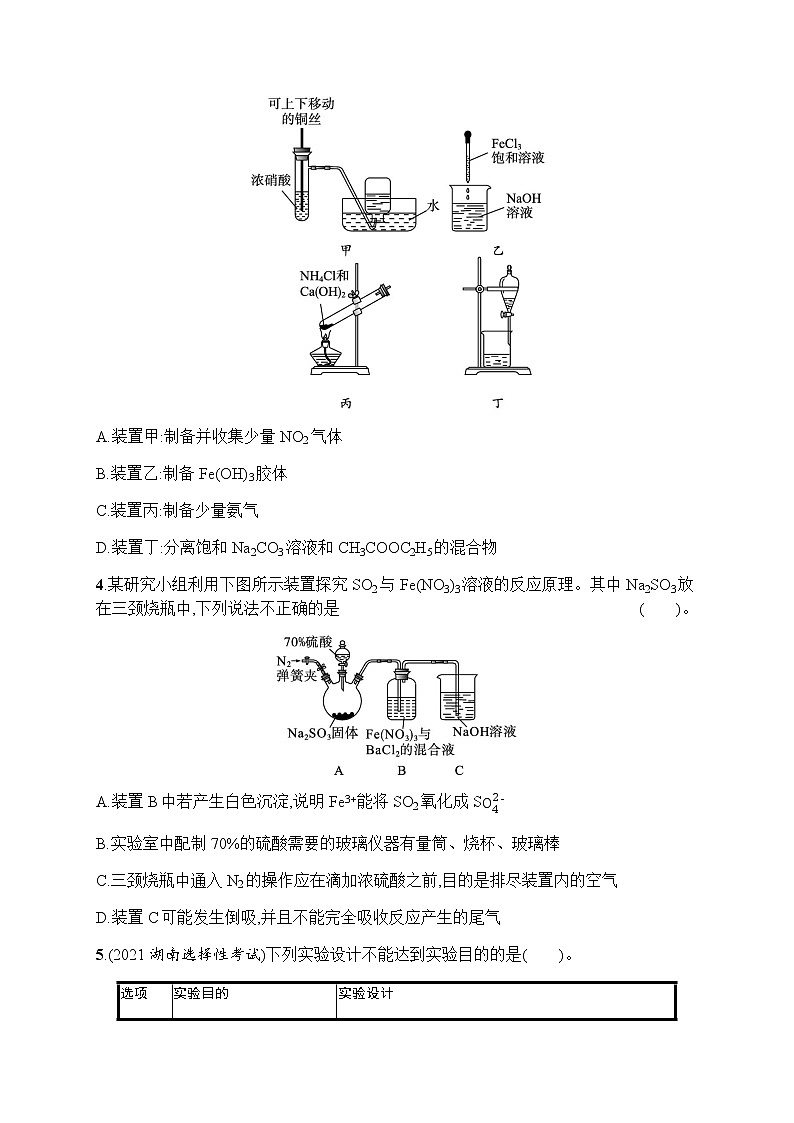
3.(2021贵州贵阳一中高三月考)用下图所示实验装置进行的实验中,能达到相应实验目的的是( )。
A.装置甲:制备并收集少量NO2气体
B.装置乙:制备Fe(OH)3胶体
C.装置丙:制备少量氨气
D.装置丁:分离饱和Na2CO3溶液和CH3COOC2H5的混合物
4.某研究小组利用下图所示装置探究SO2与Fe(NO3)3溶液的反应原理。其中Na2SO3放在三颈烧瓶中,下列说法不正确的是 ( )。
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成S
B.实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,并且不能完全吸收反应产生的尾气
5.(2021湖南选择性考试)下列实验设计不能达到实验目的的是( )。
选项 | 实验目的 | 实验设计 |
A | 检验溶液中 FeSO4是否被氧化 | 取少量待测液,滴加KSCN溶液,观察溶液颜色变化 |
B | 净化实验室制备的Cl2 | 气体依次通过盛有饱和NaCl溶液、浓硫酸的洗气瓶 |
C | 测定NaOH溶液的pH | 将待测液滴在湿润的pH试纸上,与标准比色卡对照 |
D | 工业酒精制备无水乙醇 | 工业酒精中加生石灰,蒸馏 |
6.某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
下列说法不正确的是( )。
A.固体Ⅰ中含有SiO2,固体Ⅱ中含有Fe(OH)3
B.加入石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为Al
C.试剂a选用盐酸,从溶液Ⅲ得到CaCl2·6H2O产品的过程中,应控制条件防止其分解
D.若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净的CaCl2·6H2O
二、非选择题
7.(2021广西高三开学考试)某学习小组根据氨气还原氧化铜的反应,设计实验测定铜元素相对原子质量Ar(Cu)(近似值)。甲同学模拟合成氨工业制备氨气,反应前先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。装置图如下:
已知:实验室用亚硝酸盐、铵盐的混合浓溶液共热制备N2,化学方程式为NaNO2+NH4ClN2↑+NaCl+2H2O。请回答下列问题:
(1)C装置应选用 (填“Ⅰ”“Ⅱ”或“Ⅲ”)。制备氢气时,若在硫酸溶液中加入少量的硫酸铜固体,反应速率将 (填“增大”“减小”或“不变”)。
(2)装置B的作用是:①干燥氢气和氮气;②使气体混合均匀;③ 。
(3)氨气还原炽热氧化铜的化学方程式为 。
(4)干燥管F中盛放的干燥剂为 (填字母)。
A.碱石灰
B.无水CuSO4
C.五氧化二磷
D.无水CaCl2
(5)乙同学经过思考认为上述装置操作麻烦并对原装置进行了改进。装置如图所示(夹持装置略)。实验前将硬质玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入硬质玻璃管中,再次将装置C称重,记为m2 g。按图连接好装置进行实验。
①将下列实验操作步骤正确排序:j、d、g、a、b、 (填字母);重复上述操作步骤。直至C恒重,记为m3 g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2
e.称量装置C的质量
f.冷却至室温
g.打开分液漏斗活塞,使装置中充满NH3
h.关闭分液漏斗活塞
j.检验装置气密性
②根据实验记录,计算铜元素相对原子质量Ar(Cu)= (列式表示)。
③在本实验中,若CuO中混有不反应的杂质,使测定结果Ar(Cu) (填“偏大”“偏小”或“无影响”)。
8.某研究性学习小组为合成1-丁醇。查阅资料得知一条合成路线:
CH3CHCH2+CO+H2CH3CH2CH2CHOCH3CH2CH2CH2OH
CO的制备原理:HCOOHCO↑+H2O,并设计出原料气的制备装置(如图)
请回答下列问题:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式 , 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 、 ;c和d中盛装的试剂分别是 、 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正反应放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是 。
a.低温、高压、催化剂
b.适当的温度、高压、催化剂
c.常温、常压、催化剂
d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:
粗品滤液有机层1-丁醇、乙醚纯品
试剂1为 ,操作1为 ,操作2为 ,操作3为 。
专题质检卷九 化学实验基础
1.B 欲从含MgBr2的水中提取Br2,首先氯气与溴化镁溶液反应生成氯化镁和溴,即发生反应:Cl2+MgBr2MgCl2+Br2,通过A装置完成;因为溴溶于水,更易溶于有机溶剂,所以再加入苯或四氯化碳进行萃取,使溶液分层,然后进行分液,通过C装置完成;又因为溴与溶剂的沸点不同,可进行蒸馏操作,得到溴单质,通过D装置完成。根据以上分析没有用到过滤操作,所以答案为B。
2.C 蔗糖含有C、H、O三种元素,加入浓硫酸,浓硫酸具有脱水性,将蔗糖脱水变成碳,过程放热,碳与浓硫酸反应生成二氧化碳和二氧化硫,浓硫酸表现强氧化性,A项正确。溶液变棕黄色,说明H2O2溶液氧化硫酸亚铁溶液生成Fe3+,一段时间后,溶液中有气泡生成,则说明溶液中的Fe3+催化H2O2分解产生O2,B项正确。浓硝酸具有强氧化性,能与铝发生反应,使铝表面形成致密的氧化膜从而钝化,而不是不发生反应,C项错误。AgCl、AgI组成相似,则溶度积小的物质先生成沉淀,向浓度均为0.01 mol·L-1的KCl、KI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀,可说明Ksp(AgCl)>Ksp(AgI),D项正确。
3.D NO2能与水反应,不能用排水法收集,故A项错误;制备Fe(OH)3胶体应向沸水中滴加氯化铁饱和溶液,继续加热直至溶液出现红褐色,乙中用NaOH溶液不可以,得到的是氢氧化铁沉淀,故B项错误;给固体加热,试管口应略向下倾斜,故C项错误;饱和Na2CO3溶液和CH3COOC2H5的混合物互不相溶,故可用分液的方法分离,故D项正确。
4.A 装置A中70%的硫酸与亚硫酸钠反应放出二氧化硫,二氧化硫的水溶液显酸性,在酸性条件下,N能够氧化二氧化硫生成S,从而在B中产生硫酸钡白色沉淀,不能说明是Fe3+将SO2氧化成S,A项不正确。实验室中配制70%的硫酸,需要用量筒量取适当体积的浓硫酸,然后慢慢倒入一定量水中,边倒边搅拌,故需要的玻璃仪器有量筒、烧杯、玻璃棒,B项正确。二氧化硫能够被氧化,为了排除空气中氧气的干扰,在滴加浓硫酸之前,三颈烧瓶中需要通入N2,C项正确。导气管直接插入溶液,可能会因为压强变化较大而发生倒吸,反应可能会生成NO,NO不能被氢氧化钠溶液吸收,D项正确。
5.C 含Fe3+的溶液遇KSCN溶液变为血红色,观察溶液的颜色可检验FeSO4是否被氧化,故A项正确;饱和NaCl溶液可除去HCl,浓硫酸干燥氯气,可净化氯气,故B项正确;测定NaOH溶液的pH,应选干燥的pH试纸,不能滴在湿润的pH试纸上,否则导致溶液被稀释,故C项错误;加CaO与水反应除去水,然后蒸馏可分离,故D项正确。
6.D SiO2难溶于盐酸,固体Ⅰ中含有SiO2;氯化铝、氯化铁与氢氧化钙反应生成Al(OH)3、Fe(OH)3,所以固体Ⅱ中含有Fe(OH)3,A项正确。Al(OH)3可溶于强碱,加入石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为Al,B项正确。CaCl2·6H2O易失去结晶水,所以应控制条件防止其分解,C项正确。溶液Ⅰ中直接加氨水至沉淀完全,滤液中除了有CaCl2,还会有氯化铵,其溶液经蒸发浓缩、冷却结晶不能得到纯净的CaCl2·6H2O,D项错误。
7.答案 (1)Ⅰ 增大
(2)观察和控制气体的流速
(3)2NH3+3CuON2+3H2O+3Cu
(4)A
(5)①f、h、c、e ② ③偏大
解析 (1)实验室用亚硝酸盐、铵盐的混合浓溶液共热制备N2,化学方程式为NaNO2+NH4ClN2↑+NaCl+2H2O,属于液体和液体混合加热制备气体的反应,则C装置应选用Ⅰ。Zn先与CuSO4反应置换出Cu,Cu、Zn构成Cu-Zn原电池,加快了反应速率,所以制备氢气时,若在硫酸溶液中加入少量的硫酸铜固体,反应速率将增大。
(2)B装置有浓硫酸,具有吸水性,可干燥混合气体,还可以使氢气和氮气混合均匀,还可观察和控制气体的流速。
(3)氨气还原炽热氧化铜生成氮气、铜和水,该反应的化学方程式为2NH3+3CuON2+3H2O+3Cu。
(4)干燥管F用于测定生成物水的质量,但不能吸收剩余的氨气,应该为碱石灰,无水硫酸铜检验水的存在,五氧化二磷、无水CaCl2均能吸收氨气,答案选A。
(5)①根据图示装置及实验目的可知操作步骤为:检查装置气密性→用氨气排出装置中空气→加热反应→熄灭酒精灯→冷却后关闭分液漏斗活塞→关闭K1和K2→称量装置C的质量,即j.检验装置气密性、d.打开K1和K2、g.打开分液漏斗活塞,使装置中充满NH3、a.点燃酒精灯,加热、b.熄灭酒精灯、f.冷却至室温、h.关闭分液漏斗活塞、c.关闭K1和K2、e.称量装置C的质量,则实验操作步骤正确排序为j、d、g、a、b、f、h、c、e;
②CuO的质量为(m2-m1)g,该CuO中含有O的质量为:(m2-m3) g,n(O)= mol,则n(Cu)=n(CuO)=n(O),Cu的质量为(m3-m1) g,则Cu的摩尔质量为: g·mol-1,所以Cu的相对原子质量为;
③在本实验中,若CuO中混有不反应的杂质,测定的m3偏大,根据Ar(Cu)=可知,测定结果偏大。
8.答案 (1)Zn+2HClZnCl2+H2↑ (CH3)2CHOHCH2CHCH3↑+H2O
(2)保持恒压 防倒吸 NaOH溶液 浓硫酸
(3)④⑤①③②
(4)b
(5)饱和NaHSO3溶液 过滤 萃取 蒸馏
解析 (1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,制备H2的化学方程式为Zn+2HClZnCl2+H2↑;2-丙醇通过消去反应即可得到丙烯,方程式为(CH3)2CHOHCH2CHCH3↑+H2O。
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸。又因为甲酸易溶于水,所以必须防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO。
(3)检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液、品红溶液或澄清石灰水,检验CO2可以用澄清石灰水,检验水蒸气可以用无水CuSO4,所以检验这四种气体必须考虑试剂的选择和顺序。只要通过溶液,就会产生水蒸气,因此先检验水蒸气,然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,然后检验CO2,最后检验丙烯,因此顺序为④⑤①③②。
(4)由于合成正丁醛的反应是一个体积减小的可逆反应,所以采用高压,有利于增大反应速率和提高原料气的转化率;正向反应是放热反应,虽然低温有利于提高原料气的转化率,但不利于增大反应速率,因此要采用适当的温度;催化剂不能提高原料气的转化率,但有利于增大反应速率,缩短达到平衡所需要的时间,故正确选项是b。
(5)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇,因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开。
高中考试化学单元质检卷(九)——化学实验基础: 这是一份高中考试化学单元质检卷(九)——化学实验基础,共15页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
第十单元 化学实验基础 单元质检卷10(含解析)-2024届高考化学一轮复习: 这是一份第十单元 化学实验基础 单元质检卷10(含解析)-2024届高考化学一轮复习,共23页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024届高考化学一轮总复习单元质检卷10第十单元化学实验基础: 这是一份2024届高考化学一轮总复习单元质检卷10第十单元化学实验基础,共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












