所属成套资源:高中化学苏教版(2019)选择性必修一课后强化
- 专题1第二单元第二课时化学电源同步练习—2021-2022学年高一化学上学期苏教版(2019)选择性必修一 试卷 0 次下载
- 专题1第三单元第一课时金属的电化学腐蚀同步练习—2021-2022学年高一化学上学期苏教版(2019)选择性必修一 试卷 0 次下载
- 专题1第一单元第二课时反应热的测量与计算同步练习—2021-2022学年高一化学上学期苏教版(2019)选择性必修一 试卷 0 次下载
- 专题1第三单元第二课时金属的电化学防护同步练习—2021-2022学年高一化学上学期苏教版(2019)选择性必修一 试卷 0 次下载
- 专题1第二单元第三课时电解池的工作原理及应用同步练习—2021-2022学年高一化学上学期苏教版(2019)选择性必修一 试卷 0 次下载
高中苏教版 (2019)专题1 化学反应与能量第二单元 化学能与电能的转化第一课时同步测试题
展开
这是一份高中苏教版 (2019)专题1 化学反应与能量第二单元 化学能与电能的转化第一课时同步测试题,共10页。试卷主要包含了单选题,原理综合题等内容,欢迎下载使用。
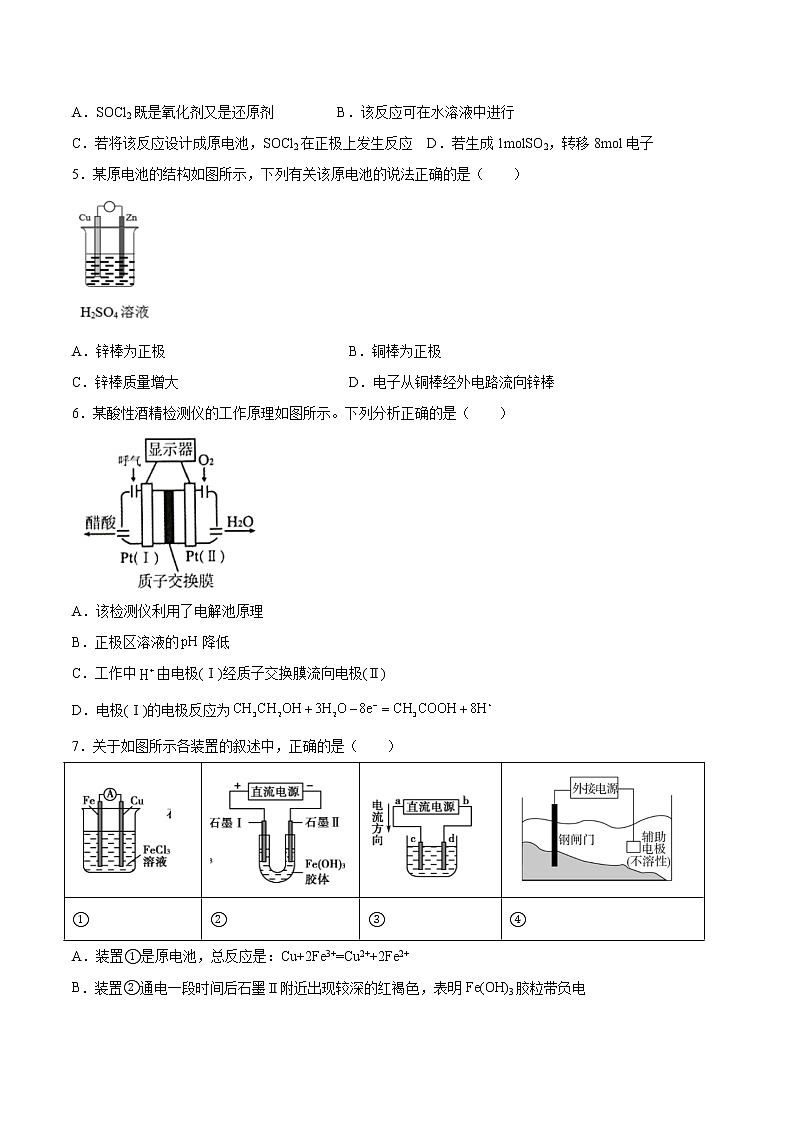
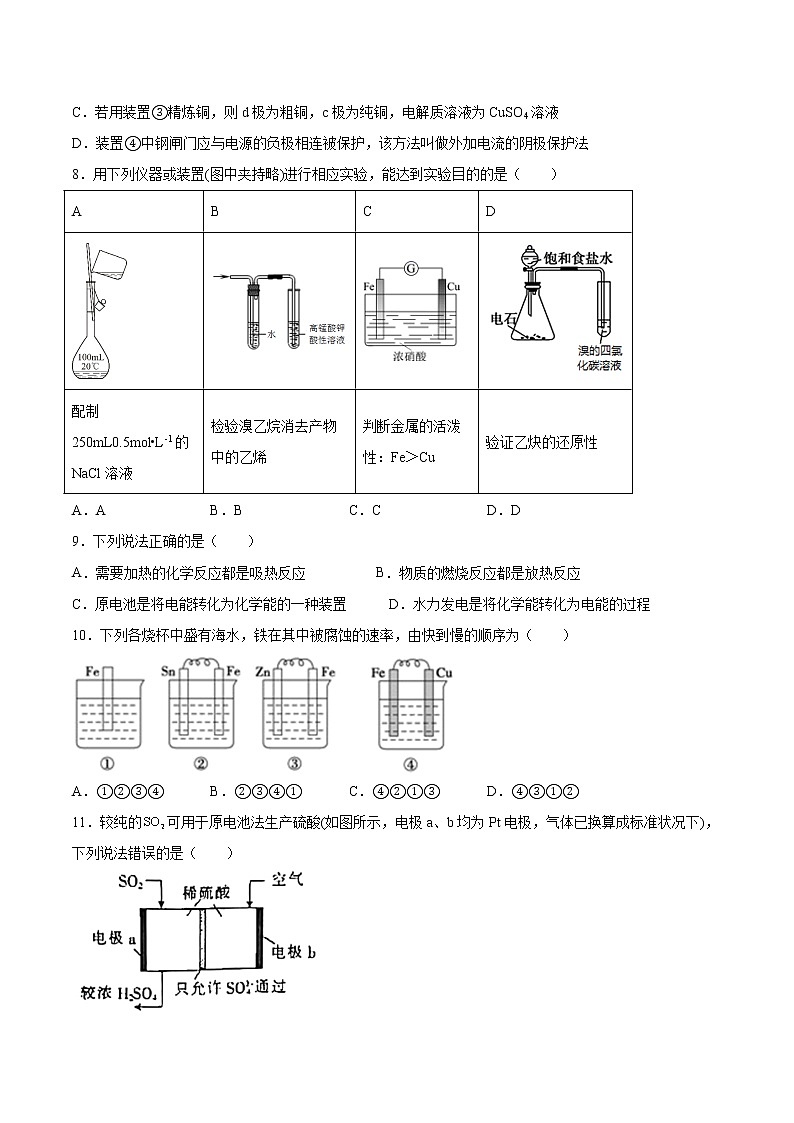
专题1第二单元第一课时原电池的工作原理同步练习—2021-2022学年高一化学上学期苏教版(2019)选择性必修一一、单选题(共16题)1.下列设备工作时,可以实现化学能转化为电能的是( )ABCD太阳能集热器锂离子电池电饭煲风力发电机A.A B.B C.C D.D2.下列反应可设计成原电池的是( )A.CaCO3(s)+2HCl(aq)=CaCl2(aq)+CO2(g)+H2O(l) <0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) <0C.Fe(s)+2HCl(aq)=FeCl2(aq)+H2(g) <0 D.Ba(OH)2(aq)+2NH4Cl(aq)=BaCl2(aq)+2NH3(g)+2H2O(l) >03.如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是 ( )选项MNPAZnCu稀H2SO4BCuFe稀HClCAgZnAgNO3溶液DZnFeFe(NO3)3溶液A.A B.B C.C D.D4.关于反应4Li+2SOCl2=4LiCl+S+SO2↑的叙述,正确的是( )A.SOCl2既是氧化剂又是还原剂 B.该反应可在水溶液中进行C.若将该反应设计成原电池,SOCl2在正极上发生反应 D.若生成1molSO2,转移8mol电子5.某原电池的结构如图所示,下列有关该原电池的说法正确的是( )A.锌棒为正极 B.铜棒为正极C.锌棒质量增大 D.电子从铜棒经外电路流向锌棒6.某酸性酒精检测仪的工作原理如图所示。下列分析正确的是( )A.该检测仪利用了电解池原理B.正极区溶液的降低C.工作中由电极(Ⅰ)经质子交换膜流向电极(Ⅱ)D.电极(Ⅰ)的电极反应为7.关于如图所示各装置的叙述中,正确的是( )①②③④A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+B.装置②通电一段时间后石墨Ⅱ附近出现较深的红褐色,表明Fe(OH)3胶粒带负电C.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液D.装置④中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法8.用下列仪器或装置(图中夹持略)进行相应实验,能达到实验目的的是( )ABCD配制250mL0.5mol•L-1的NaCl溶液检验溴乙烷消去产物中的乙烯判断金属的活泼性:Fe>Cu验证乙炔的还原性A.A B.B C.C D.D9.下列说法正确的是( )A.需要加热的化学反应都是吸热反应 B.物质的燃烧反应都是放热反应C.原电池是将电能转化为化学能的一种装置 D.水力发电是将化学能转化为电能的过程10.下列各烧杯中盛有海水,铁在其中被腐蚀的速率,由快到慢的顺序为( )A.①②③④ B.②③④① C.④②①③ D.④③①②11.较纯的可用于原电池法生产硫酸(如图所示,电极a、b均为Pt电极,气体已换算成标准状况下),下列说法错误的是( )A.电板a发生氧化反应,得到电子 B.电极b的反应式为C.电路中每转移电子,消耗 D.电池总反应为12.如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )选项MNPA锌铜稀硫酸B铜铁浓硝酸C银锌硝酸银溶液D铝铁硝酸铁溶液A.A B.B C.C D.D13.NA为阿伏加德罗常数的值,下列说法正确的是( )A.1L0.5mol/L的KMnO4溶液中,氧原子的总数为2NAB.1mol熔融状态的NH4HSO4中含1NA个H+C.1L5mol/L的浓盐酸与足量MnO2共热,完全反应可生成1.25NA个Cl2分子D.NaBH4燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA14.CO2辅助的Na—CO2电池工作原理如下图所示。该电池电容量大,能有效利用CO2,电池的总反应为。下列有关说法不正确的是( )A.电路中每转移4mol电子,理论上要消耗67.2LCO2(标状) B.放电时,正极反应为:C.该电池可用硫酸溶液代替含NaClO4的有机溶液 D.放电时,ClO向b极移动15.如图所示为碱性介质中,金属银与次氯酸钾构成的原电池,总反应方程式为:2Ag+2I-+ClO-+H2O=2AgI(s)+Cl-+2OH-。下列叙述正确的是( )A.随着反应的进行,石墨电极附近pH减小 B.正极的电极反应式为:ClO-+2e-+2H+=Cl-+H2OC.负极的电极反应式为:Ag-e-=Ag+ D.当电路中有0.2mol电子转移时,交换膜右侧离子增加0.4mol16.如图所示是和形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下。则卡片上的描述合理的是( )2021.6.18,实验后的记录:①为正极,为负极 ②极上有气泡产生,发生还原反应③向极移动 ④若有0.5电子流经导线,则可产生0.25气体⑤电子的流向是: ⑥正极反应式:,发生氧化反应A.①②④ B.②④ C.②③④ D.③④⑤二、原理综合题(共5题)17.化学作为一门中心科学,在人类能源开发与利用中起着十分关键的作用。化学电源是一种直接把化学能转变为电能的装置,其研究为各国科学家所关注。利用燃料和氧化剂的氧化还原反应也可以组成一个电池,而且与传统的电池不同,其工作物质可以源源不断由外部输人,因此可以长时间的不间断工作。将氢气(H2)、甲烷(CH4)。乙醇(C2H5OH)等物质在氧气(O2)中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。人们已将它用于航天飞行器上。下图为氢-氧燃料电池反应的完整过程:(1)请将上图方框中的反应填补完整;H吸附:_______,O2吸附:_______;(2)该电池反应为:_______;(3)人们将它用于航天飞行器上原因有二:一是_______,因此减轻重量就等于降低向太空发射的费用,与另一种绿色能源_______配合,可以使飞行器在空间停留的时间较长;二是_______,更可减少携带重量。18.按要求完成下列问题: (1)A、B、C之间有如图的转化关系,若A为AlCl3,写出A和C反应的离子方程式:_______________;(2)检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是_____________ 、_______________(3)已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式____________________。(4)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为__________。若电解液为氢氧化钠溶液,负极的电极反应为________________。(5)写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:__________________。(6)若铅蓄电池负极质量增加19.2g,则其正极质量增加____________ g。19.锂一氧化铜电池是一种新型绿色电池。它的比能量高、电压高、工作温度宽,使用寿命长,适合于大电流、重负载放电应用。回答下列问题:(1)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣。、、分别作为电极时比能量由大到小的顺序为:___________。(2)通过如下过程制备:①写出“氧化”时生成的离子反应方程式___________。②“沉铜”时,将溶液加入溶液中时,研究二者不同物质的量之比与产品纯度的关系(用铜元素的含量来表示产品的纯度),结果如图1所示。已知:中铜元素的含量为。二者比值为时,产品中可能含有的杂质是___________[填“”或“”]。③“灼烧”时反应的化学方程式是___________,该反应是___________(填“放热”或“吸热”)反应。(3)锂一氧化铜电池以有机溶液为电解质溶液,电池总反应为,其工作原理示意图如图2。①正极反应式为___________。②每转移,理论上消耗的质量为___________。20.氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
请回答下列问题:(1)氯化铁做净水剂的原因是(结合化学用语表达)___________。(2)吸收剂X的化学式为___________,氧化剂Y的化学式为___________。(3)碱性条件下反应①的离子方程式为___________。(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因_______________。(5)K2FeO4在水溶液中易发生反应:4 FeO+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___________(填序号)。A.H2OB.稀KOH溶液C.NH4Cl溶液D.Fe(NO3)3溶液除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是_____________ 。(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式_____________ 。21.现有A、B、C、D、E、F、G七种短周期元素,原子序数依次增大。已知A与E、D与F分别同主族,E、F、G同周期;A、C的最外层电子数之和与D的最外层电子数相等,A与D形成的化合物常温下为液态,A分别与F、G形成的气体分子电子总数相等、B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具。请回答下列问题:(1)元素C在周期表中的位置是_______元素E的原子结构示意图为_______(2)A、D、E形成的化合物与过量的B的最高价氧化物发生反应,离子方程式为:_______(3)在一定条件下,Fe、Cu单质和A、D、F形成的化合物的水溶液可构成电池,该电池负极的电极反应式为_______, 该电池在放电过程中,电解质溶液的pH将_______(填“增大”、“减小”或“不变”)。(4)化合物C2A4(g)是一种高效清洁的火箭燃料,0.25 mol C2A4完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,同时放出热量133.5 kJ的热量。则该反应的热化学方程式为(用具体物质化学式表示)_______。 参考答案1.B2.C3.C4.C5.B6.C7.D8.B9.B10.C11.A12.C13.D14.C15.D16.A17.(1) 2H吸附-2e→2H+ O2 吸附+2e+2H+→H2O (2)H2+O2 =H2O(3) 燃料电池有很高的质量比能量(能质比)光电池 燃抖 电池的产物为水,经过处理之后正好可供宇航员使用 18.Al3+ + 3AlO2- +4H2O =4Al(OH)3↓ Ba(NO3)2 AgNO3 C(s)+O2(g) =CO2(g) ∆H=-(a+b-d-c)kJ/mol 2H+ + 2e- = H2↑ Al - 3e- + 4OH- = AlO2 -+ 2H2O CH3OH- 6e- + 8OH- = CO32-+6 H2O 12.8 19. 吸热 1.4g 20.Fe3+ +3H2OFe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质; FeCl2 NaClO 2Fe3++3ClO-+10OH-=2 FeO+3Cl-+5H2O K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行 B 高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率 FeO+ 3e- + 4SO3 = Fe3+ + 4SO 21.第二周期第VA族 OH-+CO2=HCO Fe-2e-=Fe2+ 增大 N2H4(g)+O2(g)=N2(g)+2H2O(l)∆H=-534kJ/mol
相关试卷
这是一份高中化学第一节 原电池精品第一课时习题,共10页。试卷主要包含了关于右图装置的叙述,正确的是,有关电化学知识的描述正确的是等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第二单元 化学能与电能的转化当堂达标检测题,共30页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
这是一份化学苏教版 (2019)第二单元 化学能与电能的转化课后练习题,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。









