

所属成套资源:高中化学人教版(2019)选择性必修一课后强化
- 第三章第三节第二课时影响盐类水解的主要因素课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 2 次下载
- 第三章第三节第三课时盐类水解的应用课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 1 次下载
- 第三章第四节第二课时沉淀的生成课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 0 次下载
- 第三章第四节第三课时沉淀的溶解课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 0 次下载
- 第三章第四节第四课时沉淀的转化课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 0 次下载
化学人教版 (2019)第三节 盐类的水解第一课时同步练习题
展开
这是一份化学人教版 (2019)第三节 盐类的水解第一课时同步练习题,共9页。试卷主要包含了单选题,综合题等内容,欢迎下载使用。
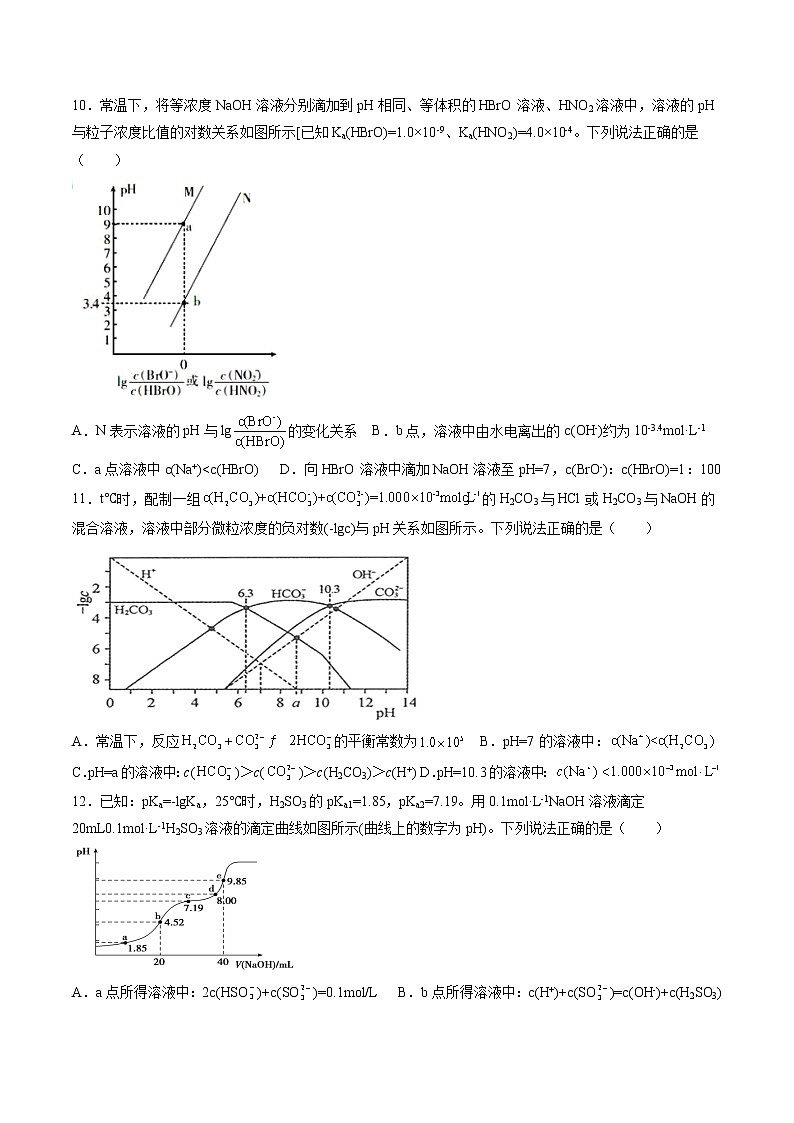
第三章第三节第一课时盐类水解课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一一、单选题(共16题)1.下列离子方程式书写正确的是( )A.向硫酸铝溶液中滴加碳酸钠溶液:B.向KI与稀硫酸的混合溶液中通入氧气:C.已知还原性,a mol 溶液中通入a mol :D.在澄清石灰水中加入过量的碳酸氢钠溶液:2.下列有关化学用语表示正确的是( )A.正丁烷的球棍模型:B.质子数为、中子数为的原子:C.和的原子结构示意图均可以表示为D.溶液中水解的离子方程式:3.在K2S溶液中,c(K+)与c(S2-)的关系正确的是( )A.c(K+)=c(S2-) B.c(K+):c(S2-)=2:1C.c(K+):c(S2-)>2:1 D.c(K+):c(S2-)<2:14.侯氏制碱法中发生的主要反应:。下列有关说法正确的是( )A.中子数为8的碳原子: B.水解的离子方程式:C.的原子结构示意图: D.的电子式:5.在生活中 Na2CO3和NaHCO3都可作食用碱。下列对其性质的描述用化学方程式或离子方程式表示正确的是( )A.NaHCO3可作发酵粉:2NaHCO3Na2CO3 + CO2↑ + H2OB.饱和Na2CO3溶液中通入CO2: +CO2+ H2O→C.Na2CO3溶液呈碱性:+ 2H2O→H2CO3+ 2OH-D.饱和Na2CO3溶液除去CH3COOC2H5中的CH3COOH:+2H+ CO2↑+ H2O6.常温下,下列说法正确的是( )A.某溶液中含有、、和Na+,若向其中加入Na2O2,充分反应后,四种离子的浓度不变的是(忽略反应前后溶液体积的变化)B.水电离的c水(H+)=10-12mol·L—1的溶液中,下列离子能大量共存:、Na+、、C.氢氧化铁溶于HI溶液中的离子方程式为:2Fe(OH)3+6H++2I—=2Fe2++I2+6H2OD.NaHS溶液中,下列离子能大量共存:K+、Al3+、Cl—、7.改变二元弱酸溶液的,溶液中的、、的物质的量分数随的变化如下图所示。(已知)下列叙述不正确的是( )A.B.时,C.时,D.在的溶液中,存在关系:8.是一种常用的食品防腐剂。已知。下列叙述正确的是( )A.溶液的B.溶液的随温度升高而增大C.溶液中D.溶液中9.25℃时,下列混合物的水溶液pH一定小于7的是( )A.和 B.和C.和 D.和10.常温下,将等浓度NaOH溶液分别滴加到pH相同、等体积的HBrO溶液、HNO2溶液中,溶液的pH与粒子浓度比值的对数关系如图所示[已知Ka(HBrO)=1.0×10-9、Ka(HNO2)=4.0×10-4。下列说法正确的是( )A.N表示溶液的pH与lg的变化关系 B.b点,溶液中由水电离出的c(OH-)约为10-3.4mol·L-1C.a点溶液中c(Na+)<c(HBrO) D.向HBrO溶液中滴加NaOH溶液至pH=7,c(BrO-):c(HBrO)=1:10011.t℃时,配制一组的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如图所示。下列说法正确的是( ) A.常温下,反应的平衡常数为 B.pH=7的溶液中:C.pH=a的溶液中:c()>c()>c(H2CO3)>c(H+) D.pH=10.3的溶液中:12.已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是( )A.a点所得溶液中:2c(HSO)+c(SO)=0.1mol/L B.b点所得溶液中:c(H+)+c(SO)=c(OH-)+c(H2SO3)C.c点所得溶液中:c(Na+)>3c(HSO) D.d点所得溶液中:c(Na+)>c(OH-)>c(SO)13.向含Na2CO3、Na[Al(OH)4](NaAlO2)的混合溶液中逐滴加入150mL1mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )A.a曲线表示的离子方程式为:[Al(OH)4]-+H+=Al(OH)3↓+H2O B.b和c曲线表示的离子反应是相同的C.M点时,溶液中沉淀的质量为3.9g D.原混合溶液中的CO与[Al(OH)4]-的物质的量之比为1∶214.H2CO3和H2C2O4都是二元弱酸,常温下,不同pH环境下它们不同形态的粒子的组成百分率如图所示。下列说法错误的是( )A.由图可知,草酸酸性比碳酸要强B.反应CO+H2O→HCO+OH-的平衡常数为10-7.23C.0.1mol/LNaHC2H4溶液中c(C2O)>c(H2C2O4)D.往Na2CO3溶液中加入少量草酸溶液,发生反应2CO+H2C2O4=2HCO+C2O15.苹果酸(简写为)是二元弱酸,、。20℃时,向的溶液中缓慢通入气体(忽略溶液体积的变化)。下列指定溶液中微粒关系正确的是( )A.测得的溶液为8.6,此时溶液中存在:B.通入后的溶液中:C.在的溶液中:D.溶液从3.4变为2时,发生的主要反应为:16.已知常温下的,,的。下列说法不正确的是( )A.溶液中存在:B.向溶液中通入少量的离子方程式:C.等浓度、等体积的和的混合溶液中存在:D.溶液中水电离出的小于等浓度的溶液中水电离出的二、综合题(共5题)17.Na2S常用作皮革脱毛剂,工业上用反应Na2SO4 +2C Na2S+2CO2↑ 进行制取。(1)上述反应中涉及的各元素中原子半径最小的是_______(填元素符号),该原子有_____种不同能量的电子。(2)羰基硫的化学式为COS,结构和CO2 相似,请写出COS的电子式_________,判断羰基硫分子属于________(选填“极性”或“非极性”)分子。(3)写出一个能比较S和O非金属性强弱的化学事实_____________________ ;请从原子结构解释原因_____________________________。(4)将Na2S溶液滴入AlCl3溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解释上述现象__________________________。18.聚合硫酸铁(PFS)是一种性能优异的无机高分子絮凝剂,其化学式通常表示为[Fe2(OH)2a(SO4)3-a]b。某化工厂制备PFS并用其处理废水。I.用硫酸铜废液制备PFS(1)试剂A为___。(2)“控温氧化”发生反应的离子方程式为__。(3)测定PFS样品中的n(OH-):取ag样品,溶解于V1mLc1 mol∙L−1HCl溶液中,用KF溶液掩蔽Fe3+(使Fe3+不能与OH-反应),滴入酚酞溶液,再用c2 mol∙L−1NaOH溶液滴定,到达滴定终点时消耗NaOH溶液体积为V2mL。agPFS样品中的n(OH-)=__mol。II.用石灰乳-PFS法处理含砷废水已知:i.常温下,Ca3(AsO4)2、CaHAsO4的Ksp均大于FeAsO4的Ksp,Fe2(HAsO4)3可溶;ii.常温下,溶液中含砷微粒的物质的量分数与pH的关系如图。(4)下列说法不正确的是___(填序号)。a.NaH2AsO4溶液的pH<7b.pH=11.5时,c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)c.Na3AsO4溶液中,3c(Na+)=c(AsO)+c(HAsO)+c(H2AsO)+c(H3AsO4)(5)“一级沉降”中,石灰乳的作用是___。(6)“二级沉降”中,溶液的pH在8~10之间,PFS形成的Fe(OH)3胶体粒子可以通过沉淀反应进一步减少溶液中的As含量,反应的离子方程式为___。(7)溶液的pH和m(Fe)/m(As)对As去除率的影响如图。某酸性含砷废水中As含量为20mg/L,为达到排放标准(As含量≤1mg/L),从节约成本的角度考虑,工业上选择的最佳条件是__(填序号)。a.pH=8.2m(Fe)/m(As)=5 b.pH=8.2m(Fe)/m(As)=8c.pH=9.0m(Fe)/m(As)=5 d.pH=9.0m(Fe)/m(As)=8[m(Fe)/m(As)指PFS中Fe元素质量与对应废水中As元素质量之比]19.碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼钢的阳极泥(主要含有TeO2、少量Ag、 Au)为原料制备单质碲的一种工艺流程如下:已知Te02微溶于水,易溶于较浓的强酸和强碱。(1)“碱浸”时所用的试剂是 ___(填化学式)。(2)碱浸后的“滤渣”可用于____。(3)“沉碲”时,缓慢加入H2SO4,并不断搅拌。为生成TeO2沉淀需控制溶液的pH为4.5—5.0,其原因是____。(4)“酸溶”后,将SO2通入TeC14酸性溶液中进行“还原”得到碲,该反应的化学方程式是____。(5) 25℃时,亚碲酸(H2Te03)的Kal=lxl0-3,Ka2=2×l0-8①0.lmol/L的NaHTe03的溶液中c(TeO32-) - c(H2TeO3)= ____(填离子浓度表达式)。②0.lmol.L-1的NaHTe03溶液呈__________填“酸性”,“碱性”,“中性”)理由是____(写出利用平衡常数汁算及推理过程).20.甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题:(1)戊离子的结构示意图为________。(2)写出乙的单质的电子式:________。(3)戊的单质与X反应生成的Y和Z的物质的量之比为2∶4,反应中被氧化的物质与被还原的物质的物质的量之比为________。(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:____________。(5)按图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:____________。21.甲、乙、丙是都含有同一种元素的不同物质,转化关系如下图:(1)若甲是CO2。①常用于泡沫灭火器的是_______(填“乙”或“丙”,下同)。②浓度均为0.01 mol·L-1的乙溶液和丙溶液中,水的电离程度较大的是_________。(2)若甲是Al。①Al的原子结构示意图为__________。②当n(Al)︰n(NaOH)︰n(H2SO4)=1︰1︰2时,丙的化学式是_________。(3)若甲是Cl2。①甲转化为乙的离子方程式是____________。②已知:TiO2(s)+2Cl2 (g)+2C(s)=TiCl4(l)+2CO(g) △H=-81 kJ·mol-12C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1写出TiO2和Cl2反应生成TiCl4和O2的热化学方程式:_________。③常温下,将a mol·L-1乙溶液和0.01 mol·L-1H2SO4溶液等体积混合生成丙,溶液呈中性,则丙的电离平衡常数Ka=___________(用含a的代数式表示)。
参考答案1.C2.A3.C4.C5.A6.C7.C8.D9.B10.D11.C12.C13.D14 B15.A16.C17.O 3 极性 水的热稳定性比硫化氢强 S 和 O为同主族元素,最外层电子数相同,原子半径越小,原子核对最外层电子的吸引力越大,使得H-O键比H-S稳定 Na2S 溶液中 S2-水解显碱性:S2-+H2O⇌HS-+OH-,AlCl3溶液中 Al3+水解显酸性:Al3++H2O⇌Al(OH)3+3H+,两个水解反应相互促进,使水解进行到底,产生白色沉淀,同时有臭鸡蛋气味的气体产生 18.Fe 2Fe2++H2O2+2H+=2Fe3++2H2O (c1V1-c2V2)×10-3 bc 中和酸性溶液,调节溶液pH;形成CaSO4、Ca3(AsO4)2沉淀,去除部分SO和H3AsO4 Fe(OH)3+HAsO=FeAsO+2OH-+H2O c 19.NaOH溶液(KOH溶液) 提炼贵金属(或提取银和金或其它合理答案) 溶液酸性过强,TeO2会继续与酸反应导致碲元素损失 TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4 c(H+)-c(OH-) 酸性 NaHTeO3的水解平衡常数Kh=Kw/Ka1=1×10-14/1×10-3=10-11 , Kh < Ka2=2×10-8所以呈酸性 20. 2∶3 H++AlO+H2O===Al(OH)3↓ NaCl+H2ONaClO+H2↑ 21.乙 乙 Al2(SO4)3 Cl2+2OH-=Cl-+ClO-+H2O TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=+140 kJ·mol-1 ()×10-5
相关试卷
这是一份人教版 (2019)选择性必修1第三节 盐类的水解精品第二课时课后作业题,共8页。试卷主要包含了下列说法与盐的水解有关的是,下列关于盐类水解的说法错误的是等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解精品第一课时课堂检测,共7页。试卷主要包含了下列关于盐类水解的叙述错误的是,下列说法中正确的是,室温下,0等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解第2课时精练,共8页。试卷主要包含了1 ml·L-1的溶液,将标准状况下的2等内容,欢迎下载使用。










