

所属成套资源:高中化学人教版(2019)选择性必修一课后强化
- 第四章第三节第二课时电化学保护法课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 0 次下载
- 第四章第三节第一课时金属的腐蚀课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 0 次下载
- 第四章第一节第二课时一次电池课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 0 次下载
- 第四章第一节第四课时燃料电池课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 0 次下载
- 第四章第一节第一课时原电池的工作原理课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一 试卷 0 次下载
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池第三课时巩固练习
展开
这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池第三课时巩固练习,共7页。试卷主要包含了单选题,综合题等内容,欢迎下载使用。
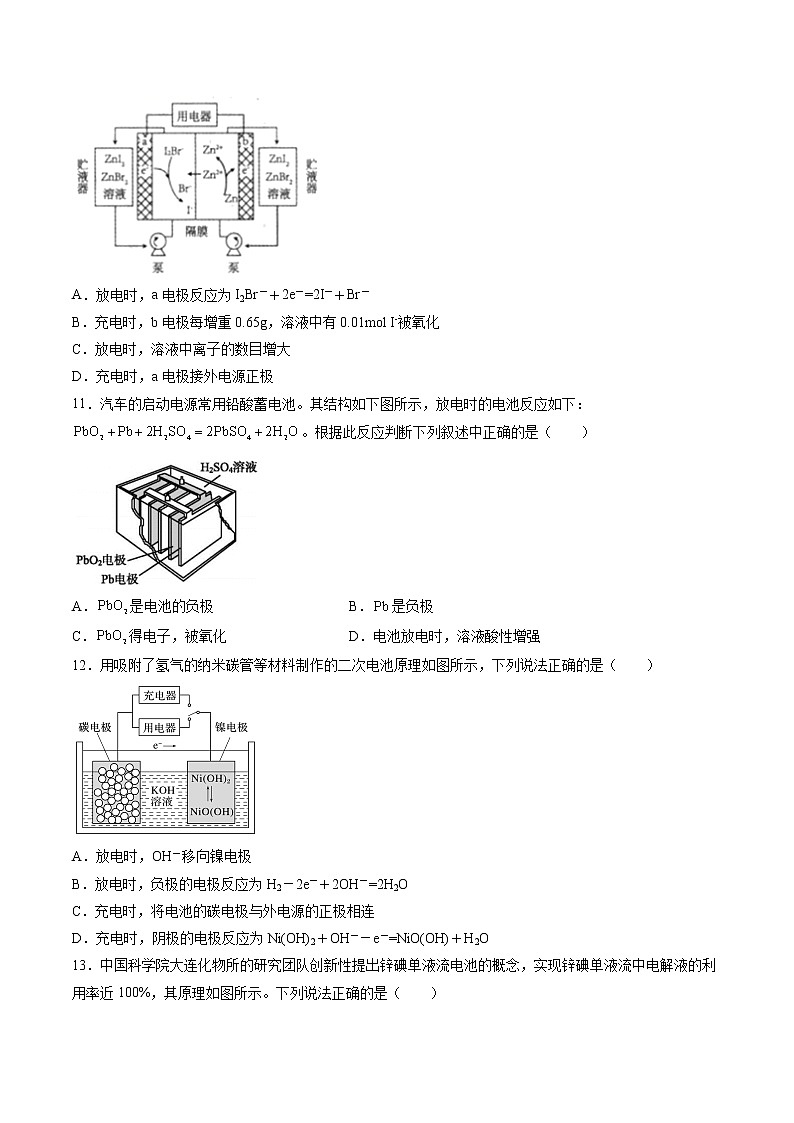
第四章第一节第三课时二次电池课后强化习题—2021-2022学年高二化学上学期人教版(2019)选择性必修一一、单选题(共16题)1.下列有关电池的叙述正确的是( )A.氢氧燃料电池属于环境友好电池,能量转化率可达100% B.锌锰干电池是一种常用的二次电池C.锌锰干电池工作一段时间后锌外壳逐渐变薄 D.铅蓄电池负极是PbO2,正极是Pb2.下列说法错误的是( )A.化学电池是将化学能转化为电能的装置 B.化学电池中离子导体的作用是传递电子C.碱性锌锰电池以锌作负极,为电解质 D.铅蓄电池是一种二次电池,以作正极3.化学与生活密切相关。下列说法正确的是( )A.医学上常采用碳酸钡作为钡餐 B.热纯碱溶液洗涤油污的能力比冷纯碱溶液强C.“84消毒液”和75%的酒精都能杀菌,两者能混合使用 D.手机中的电池属于一次性电池4.汽车的启动电源常用铅蓄电池,放电时的电池反应:PbO2+Pb+2H2SO42PbSO4+2H2O,根据此反应判断下列叙述中正确的是( )A.PbO2是电池的负极 B.电子从Pb极流出C.PbO2得电子,被氧化 D.电池放电时,溶液酸性增强5.下列说法正确的是( )A.铅蓄电池充电时,阳极质量增大B.室温下,稀释氨水,的值减小C.标准状况下,苯中含有的碳原子数为D.溶液加热后,溶液的pH减小6.锌-空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时发生反应:2Zn+O2+4OH-+2H2O=2[Zn(OH)4]2-。下列说法错误的是( )A.放电时,负极反应为Zn+4OH--2e-=[Zn(OH)4]2-B.充电时,电解质溶液中c(OH)-逐渐增大C.放电时,当0.1molZn完全溶解时,流经电解质溶液的电子个数约为1.204×1023D.采用多孔炭可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面7.镁原子电池放电时电压高且平稳,电池反应为xMg+Mo3O4MgxMo3O4,下列说法错误的是( )A.放电时,负极的电极反应式为Mg-2e-=Mg2+ B.充电时,阳极的电极反应式为Mo3O4+ xMg2++2xe-=MgxMo3O4C.放电时,Mg2+向正极区移动 D.充电时,阴极与电源的负极相连8.一种新型可充水系电池工作原理如图3所示,总反应为。下列说法错误的是( )A.充电时,电解液中浓度不会改变B.放电时,向电极迁移C.放电时,Zn上电势比上的低D.充电时,阳极反应为9.镍镉(Ni-Cd)可充电电池在现代生活中有广应用,已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2 ,则下列说法正确的是( )A.放电时,负极板上发生了还原反应B.放电时,正极的电极反应式为:Cd-2e-+2OH-=Cd(OH)2C.充电时,镍镉电池的负极应与充电器电源的正极相连D.充电时,阳极反应的电极反应式为:Ni(OH)2+OH――e-=NiOOH+H2O10.我国科学家研制了一种新型的高比能量锌—碘溴液流电池,其工作原理如图所示。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )A.放电时,a电极反应为I2Br-+2e-=2I-+Br-B.充电时,b电极每增重0.65g,溶液中有0.01mol I-被氧化C.放电时,溶液中离子的数目增大D.充电时,a电极接外电源正极11.汽车的启动电源常用铅酸蓄电池。其结构如下图所示,放电时的电池反应如下:。根据此反应判断下列叙述中正确的是( )A.是电池的负极 B.是负极C.得电子,被氧化 D.电池放电时,溶液酸性增强12.用吸附了氢气的纳米碳管等材料制作的二次电池原理如图所示,下列说法正确的是( )A.放电时,OH-移向镍电极B.放电时,负极的电极反应为H2-2e-+2OH-=2H2OC.充电时,将电池的碳电极与外电源的正极相连D.充电时,阴极的电极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O13.中国科学院大连化物所的研究团队创新性提出锌碘单液流电池的概念,实现锌碘单液流中电解液的利用率近100%,其原理如图所示。下列说法正确的是( )A.放电时A电极反应式为:Zn2++2e-=Zn B.放电时电解质储罐中离子总浓度减小C.M为阴离子交换膜,N为阳离子交换膜 D.充电时A极增重65g,C区增加离子数为2NA14.氢镍电池是可充电电池,它的总反应是:H2+NiO(OH)=Ni(OH)2,根据此反应判断,下列说法正确的是( )A.电池放电时,电池负极周围溶液的碱性不断增大 B.电池放电时,镍元素被氧化C.电池放电时,氢元素被还原 D.电池放电时,H2是负极15.下列说法或实验方案正确的是( )A.相同条件下等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多B.用甲基橙试剂可以检验溶液的酸碱性C.铅蓄电池在进行放电反应时,其正极和负极的质量都会增加D.合成氨工业中通常采用高温高压的方法来加快化学反应速率和提高氨的产率16.一种高性能水系铁-氢气二次电池工作原理如图所示,下列说法中正确的是( )A.放电时,碳网电极为负极B.离子交换膜为阳离子交换膜,充电时,K+通过离子交换膜从左极室移向右极室C.放电时,负极区pH变大D.充电时,电池总反应为二、综合题(共4题)17.按照要求书写方程式。(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏(CaSO4)可以降低土壤的碱性。用离子方程式表示盐碱地产生碱性的原因:____________________________________;用化学方程式表示用石膏降低其碱性的反应原理:_________________________________。(2)SOCl2是一种液态化合物。向盛有10 ml水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。请写出SOCl2与水反应的化学方程式:___________________________________________。(3)铅蓄电池是最常见的二次电池,使用方便,安全可靠,在生活中有广泛的应用。请写出铅蓄电池放电时电池反应的离子方程式:_________________________________。(4)制备像钠、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法。请写出工业上冶炼铝的化学方程式:_____________________________________________。18.用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4·H2O(三盐),主要制备流程如下。请回答下列问题:(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO42PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为__________。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为_____。(2)将滤液Ⅰ、滤液Ⅲ合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为________。(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO的离子方程式为____________;滤液Ⅱ中溶质的主要成分为________(填化学式)。(4)步骤⑥合成三盐的化学方程式为____________。(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是____________。(6)已知:常温下,Ksp(PbSO4)≈2.0×10−8,Ksp(PbCO3)≈1.0×10−13。在步骤①转化中,若硫酸铅和碳酸铅在浊液中共存, =____。19.铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)。根据上述情况判断:(1)放电时,电解质溶液的pH________(填“增大”“减小”或“不变”)。(2)放电时,电解质溶液中阴离子移向_____极,电子从_____极流向____极。(3)写出负极的电极方程式:_____________________________________。20.SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。已知:CH4(g) +2SO2(g)=CO2(g) +2S(s) +2H2O(l) ΔH= -295.9 kJ·mol-1S(s)+O2(g)=SO2(g) ΔH= -297.2 kJ·mol-1则CH4的燃烧热ΔH=_______。(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示) ,该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:①由分析可知X为_______ (填化学式)。②0~t1时间段的温度为_______。(3)燃煤烟气中可通过反应SO2(g)+2CO(g)2CO2(g)+S(l)实现硫的回收。将1molSO2和2molCO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106Pa条件下反应,5min时,反应达到平衡,气体密度减小16g·L-1。①0~5min内,CO的反应速率是_______;若升高温度,气体的密度增加(S仍为液体),则该反应的ΔH_______(填“>”或“<”)0。②T℃时,平衡常数Kp=_______Pa-1。(4)单质硫也可以生成多硫化物从而实现能量间的转化。①钠硫电池是一种新型高能电池,总反应为2Na+2SNa2S2,该电池工作时正极的电极反应式为_______;给该电池充电时,钠电极应与外电源的_______(填“正”或“负”)极相连接。②在碱性溶液中,S被BrO氧化成SO,BrO被还原成Br-。该反应的离子方程式是_______。
参考答案1.C2.B3.B4.B5.B6.C7.B8.A9.D10.B11.B12.B13.C14.D15.C16.D17.(1) CO+ H2O⇌OH-+HCO Na2CO3 + CaSO4=CaCO3+Na2SO4 (2)SOCl2 + H2O=2HCl + SO2↑(3)Pb + PbO2 + 4H+ + 2SO=2PbSO4 +2H2O(4)18.PbSO4+2H2O−2e−PbO2++4H+ 16 g Na2SO4·10H2O 3Pb+8 H++23Pb2++2NO↑+4H2O HNO3 4PbSO4+6NaOH3PbO·PbSO4·H2O↓+3Na2SO4+2H2O 取少量最后一次洗涤后的滤液于试管中,滴加BaCl2溶液和盐酸,若产生白色沉淀,则沉淀未洗涤完全;若没有白色沉淀生成,则沉淀已洗涤完全 2.0×105 19.增大 负 负 正 Pb -2e-+SO4 2-=PbSO4 20.-890.3kJ·mol-1 H2S 300℃ 0.2mol-1·L-1·min-1 < 2.4×10-6 2S+2e-=S 负 3S+6OH-+7BrO=6SO+7Br-+3H2O
相关试卷
这是一份化学选择性必修1第一节 原电池第一课时课后作业题,共9页。试卷主要包含了单选题,综合题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 原电池第四课时达标测试,共9页。试卷主要包含了单选题,综合题等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 原电池第二课时达标测试,共9页。试卷主要包含了单选题,综合题等内容,欢迎下载使用。










