2022年中考化学二轮专题复习——常见的酸及性质
展开2022年中考化学二轮专题复习——常见的酸及性质
一.选择题
1.向石蕊试液中通入二氧化碳气体,再进行加热,溶液颜色变化顺序正确的是( )
A.红色——紫色——红色
B.紫色——红色——紫色
C.红色——紫色——蓝色
D.紫色——无色——紫色
2.下列物质不能与稀盐酸反应的是( )
A.铜 B.氧化铜 C.氢氧化钙 D.碳酸氢钠
3.柠檬汁能使石蕊试液变红色,由此可知柠檬汁( )
A.显酸性 B.显碱性 C.显中性 D.无法确定
4.归纳推理是化学学习中常用的思维方法,下列推理正确的是( )
A.酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定呈酸性
B.单质是由一种元素组成的物质,因此由一种元素组成的物质一定是单质
C.常温下,pH<7的溶液显酸性,因此pH<7的雨水一定都是酸雨
D.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
5.下列性质中属于物理性质的是( )
A.盐酸可以除去铁锈 B.盐酸能使紫色石蕊溶液变红
C.浓盐酸在空气中易形成白雾 D.盐酸遇金属铁会放出气体
6.下列说法不正确的是( )
A.有一种溶液能使无色的酚酞试液变红,则该溶液呈碱性
B.有一种溶液能使紫色的石蕊试液变蓝,则该溶液呈碱性
C.有一种溶液不能使无色的酚酞试液变色,则该溶液呈酸性
D.有一种溶液能使紫色的石蕊试液变红,则该溶液呈酸性
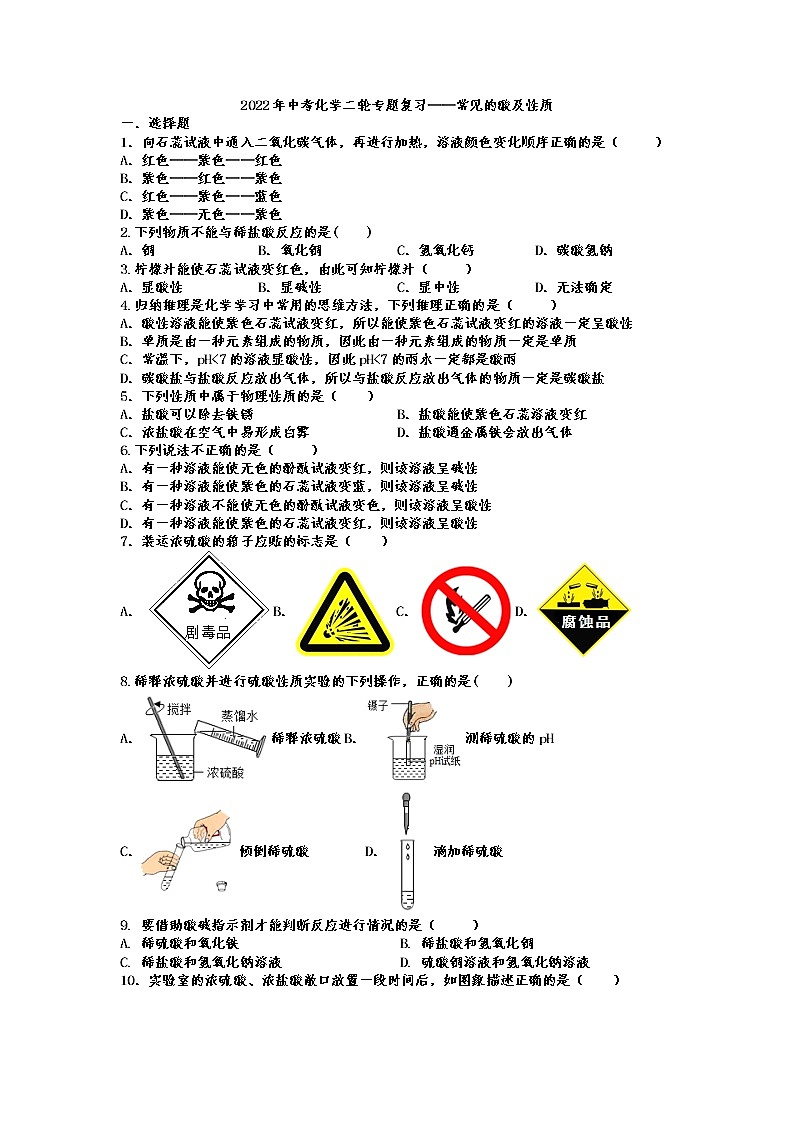
7.装运浓硫酸的箱子应贴的标志是( )
A.B.C.D.
8.稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )
A.稀释浓硫酸 B.测稀硫酸的pH
C.倾倒稀硫酸 D.滴加稀硫酸
9. 要借助酸碱指示剂才能判断反应进行情况的是( )
A. 稀硫酸和氧化铁 B. 稀盐酸和氢氧化铜
C. 稀盐酸和氢氧化钠溶液 D. 硫酸铜溶液和氢氧化钠溶液
10.实验室的浓硫酸、浓盐酸敞口放置一段时间后,如图象描述正确的是( )
A. B.
C. D.
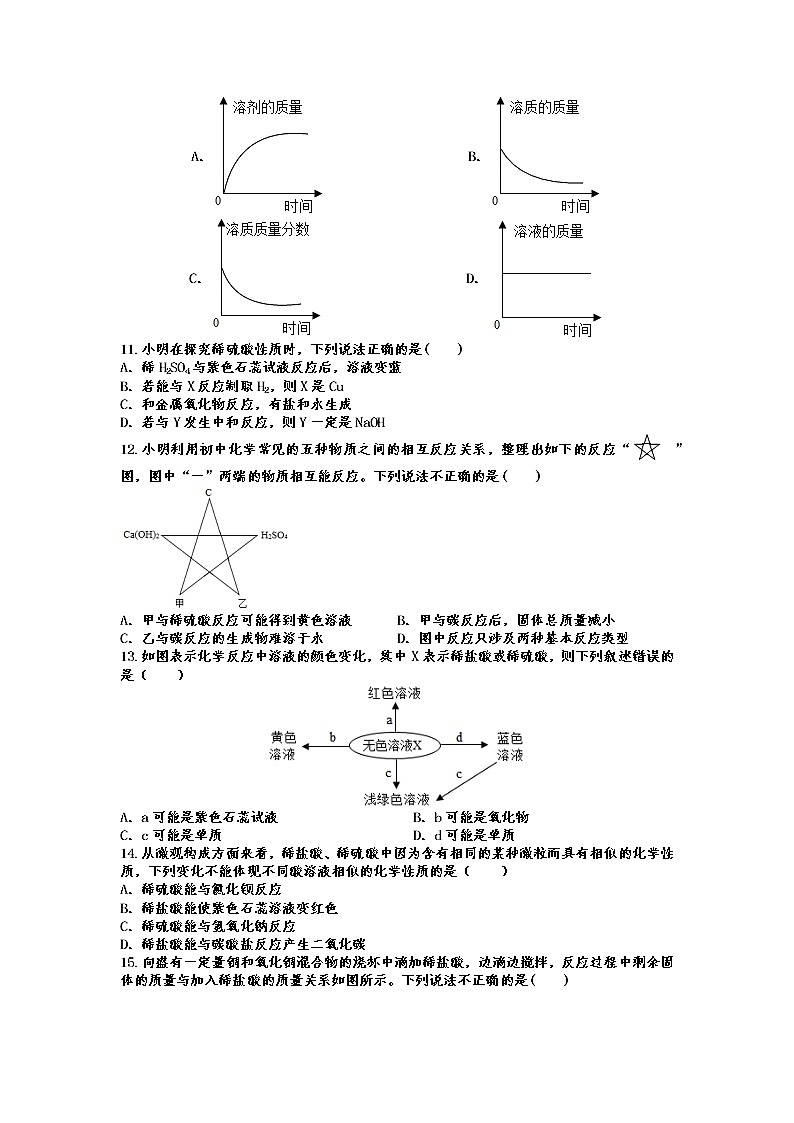
11.小明在探究稀硫酸性质时,下列说法正确的是( )
A.稀H2SO4与紫色石蕊试液反应后,溶液变蓝
B.若能与X反应制取H2,则X是Cu
C.和金属氧化物反应,有盐和水生成
D.若与Y发生中和反应,则Y一定是NaOH
12.小明利用初中化学常见的五种物质之间的相互反应关系,整理出如下的反应“ ”图,图中“一”两端的物质相互能反应。下列说法不正确的是( )
A.甲与稀硫酸反应可能得到黄色溶液 B.甲与碳反应后,固体总质量减小
C.乙与碳反应的生成物难溶于水 D.图中反应只涉及两种基本反应类型
13.如图表示化学反应中溶液的颜色变化,其中X表示稀盐酸或稀硫酸,则下列叙述错误的是( )
A.a可能是紫色石蕊试液 B.b可能是氧化物
C.c可能是单质 D.d可能是单质
14.从微观构成方面来看,稀盐酸、稀硫酸中因为含有相同的某种微粒而具有相似的化学性质,下列变化不能体现不同酸溶液相似的化学性质的是( )
A.稀硫酸能与氯化钡反应
B.稀盐酸能使紫色石蕊溶液变红色
C.稀硫酸能与氢氧化钠反应
D.稀盐酸能与碳酸盐反应产生二氧化碳
15.向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是( )
A. M点时,剩余固体是铜和氧化铜 B. M、N点时,溶液中的溶质均只有CuCl2
C. N、P点时,溶液的pH:N>P D. 混合物中铜的质量为(a-b)g
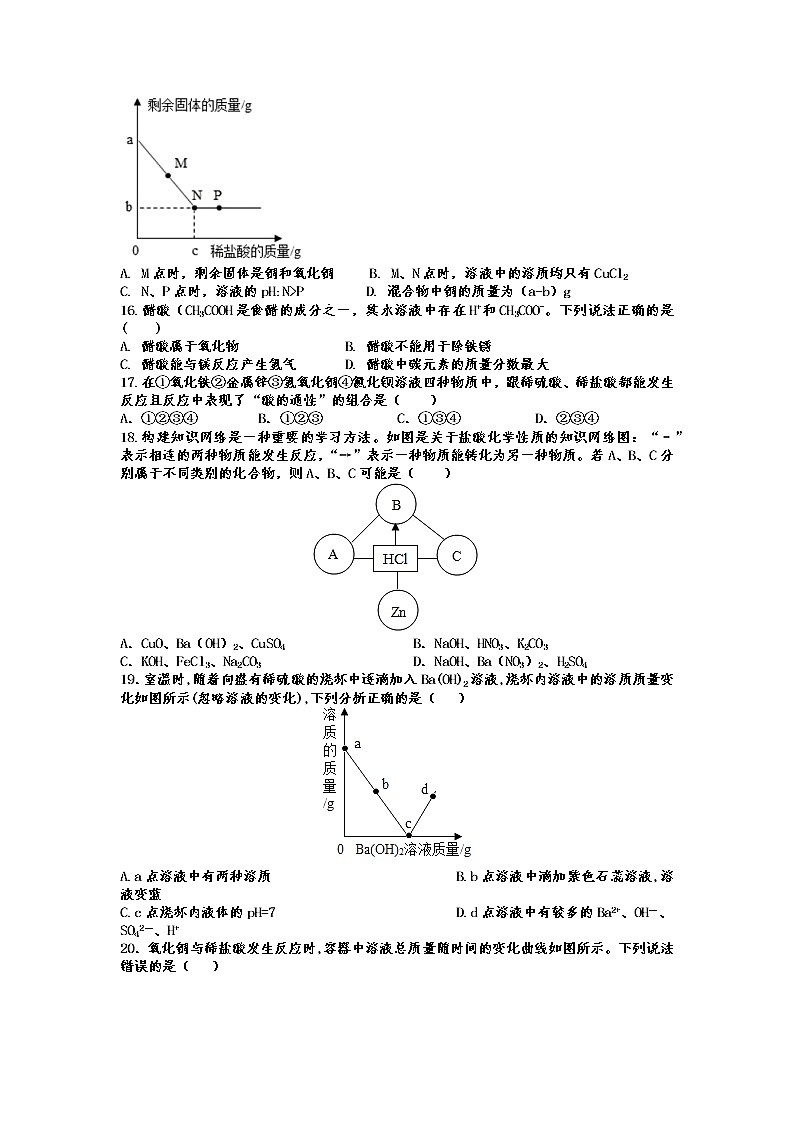
16.醋酸(CH3COOH是食醋的成分之一,其水溶液中存在H+和CH3COO-。下列说法正确的是( )
A. 醋酸属于氧化物 B. 醋酸不能用于除铁锈
C. 醋酸能与镁反应产生氢气 D. 醋酸中碳元素的质量分数最大
17.在①氧化铁②金属锌③氢氧化铜④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )
A.①②③④ B.①②③ C.①③④ D.②③④
18.构建知识网络是一种重要的学习方法。如图是关于盐酸化学性质的知识网络图:“﹣”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质。若A、B、C分别属于不同类别的化合物,则A、B、C可能是( )
A.CuO、Ba(OH)2、CuSO4 B.NaOH、HNO3、K2CO3
C.KOH、FeCl3、Na2CO3 D.NaOH、Ba(NO3)2、H2SO4
19.室温时,随着向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液的变化),下列分析正确的是( )
A.a点溶液中有两种溶质 B.b点溶液中滴加紫色石蕊溶液,溶液变蓝
C.c点烧杯内液体的pH=7 D.d点溶液中有较多的Ba2+、OH-、SO42-、H+
20.氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法错误的是( )
A. 该实验是将稀盐酸逐渐加入到盛有氧化铜的容器中
B. m点表示氧化铜与稀盐酸恰好完全反应
C. m点和n点对应溶液中铜元素的质量不相等
D. m点和n点对应溶液蒸发结晶后得到的固体成分相同
二.非选择题
21.硫酸是一种常见的酸,完成下列问题。
(1)实验室浓硫酸稀释的方法是______。
(2)为研究稀硫酸的化学性质,某同学进行了如下实验。
实验中,有气泡产生的反应的化学方程式是______,溶液有颜色变化的是______(填序号),E试管中观察到的现象是______。
22.用下图装置研究酸、碱的性质。
(1)向1中滴加Na2CO3溶液,观察到的现象是________________________。
(2)向2、3中滴加无色酚酞溶液,溶液变红的是______(填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为________________________。
23.下列有关酸的化学性质的关系图,请据图回答问题(“——”表示两种物质能发生化学反应)
(1)写出③中一个化学反应方程式_________________________。
(2)验证④发生中和反应时常选择的指示剂是_________,用离子符号表示其反应的实质____________。
(3)根据关系图,⑤中反应的物质类别是___________________。
(4)常见的稀酸有相似化学性质的原因是_________________。
24.构建知识网络,可以帮助我们理解知识间的内在联系。如图是盐酸与不同类别物质之间反应的知识网络。
(1)图中M应为 类物质。
(2)写出一种金属能与盐酸反应生成浅绿色溶液的化学方程式 。
(3)盐酸与碱反应的中和反应的实质是盐酸中的 (写符号)与碱中的OH﹣反应生成H2O。
(4)用盐酸除铁锈(主要成分Fe2O3)的化学方程式是 。
(5)写出一种盐能与盐酸反应生成白色沉淀的化学方程式 。
25.某化学兴趣小组同学为探究盐酸的化学性质,做了如下实验:
(1)试管①中的现象是 ,反应后试管②中一定有的阳离子是 (写离子符号)。
(2)试管③中反应的化学方程式为 。
(3)实验中发现试管④中固体全部溶解,试管⑤中产生白色沉淀,接着向试管⑤中滴加氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系,如图2所示。
则试管④中的溶质有 ;图2中a~b段对应溶液中一定发生反应的化学方程式为 。
26.在化学学习和研究中有很多规律可循。应用规律可以让我们获取新知识。
(1)碱性强弱规律
大量实验证明:金属越活泼。其对应的碱的碱性越强(碱的碱性强弱与碱的溶解性无关)。下列关于碱性强弱判断正确的是______。(填字母序号)
A.KOH>NaOH>Ca(OH)2 B.KOH >Ca(OH)2>NaOH C.NaOH > Ca(OH)2>KOH
(2)强酸制备弱酸规律
较强酸能制备较弱酸。已知酸性强弱:HCl>H2SO4>H2CO3>H2S,则下列反应不可能发生的是______(填字母序号)
A. B.
C.
(3)物质命名规律:
某些类别的物质命名与化合价有关:如:HClO4(高氯酸)、HClO3(氯酸)、HClO2(亚氯酸)、HClO(次氯酸)。磷的含氧酸有H3PO4、H3PO3、H3PO2,其中H3PO4为磷酸,则H3PO2的名称为____________。
27.化学兴趣小组的同学在验证硫酸的性质时,进行了以下实验。
(实验一)浓硫酸稀释过程中的能量变化。
图一实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水_______。
(实验二)溶液浓度对硫酸化学性质的影响。
图二实验中,观察到很快变黑的是滤纸_______(填“A”或“B”),由此可知,硫酸溶液的浓度不同,腐蚀性不同。
(实验三)稀硫酸的化学性质。
小组同学按图三进行实验。
(1)试管1中发生反应的化学方程式为_______。
(2)试管2中可观察到的现象是_______。
(3)向试管3中滴加了足量的稀硫酸仍无明显现象,要证明二者已经发生反应,可选用_______(填字母序号)继续进行实验,以达到实验目的。
A 酚酞溶液 B 氯化钡溶液 C 硫酸铜溶液
(4)小组同学将4、5两支试管反应后的物质倒入同一洁净的烧杯中,充分反应后过滤,得到无色滤液和白色沉淀。同学们对白色沉淀的成分产生了兴趣,继续进行实验。
(提出问题)白色沉淀的成分是发什么?
(作出猜想)猜想一:_______ 猜想二:BaSO4、BaCO3
(实验与结论)
实验操作
实验现象
实验结论
取少量白色沉淀与试管中,向其中加入足量的稀盐酸。
_______。
猜想二成立。
实验结束后,在老师指导下同学们对废液缸中的固体物质进行了回收。在检验废液时发现硫酸过量,为防止其污染环境,从实验成本的角度考虑,向该废液中加入适量的_______(填一种具体物质),处理后再排放。
28.为加深对酸的主要性质的认识,通过实验解释生活中的一些现象。在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
(实验内容与分析)
实验一:按图所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3gNa2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊溶液变_______色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因_______。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有(不考虑酚酞)_________________________(用化学式表示)。
(4)请计算,实验四中理论上可以生成二氧化碳的质量为_______g。
(可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5)
(应用与拓展)
(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜___。
(6)小明在征得老师的同意后,继续进行了如下图所示实验。
由上述实验可以得出氢氧化钙的哪些性质___________________。
29.某化学兴趣小组为验证硫酸的部分化学性质,使用氢氧化钠、碳酸钠、金属铝和另外一种不同类别的物质A进行了相关实验。
(1)实验时观察到稀硫酸与A反应有蓝色溶液生成,则A物质是____________。
(2)稀硫酸与氢氧化钠溶液反应时没有明显现象,为了证明二者发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化的情况见图二、图三、则B溶液是______溶液,图三中的M与图二中X、Y、Z中的______数值相等。
(3)该化学兴趣小组又做了如图所示实验:
(提出问题)②号试管中无色溶液的溶质是什么?
(作出猜想)猜想一:硫酸钠 猜想二:硫酸钠硫酸 猜想三:____________
(实验验证)该小组同学用试管取适量②号试管中的无色溶液,加入一种试剂后,根据产生的现象推断出了②号试管中溶质的成分,该试剂是__________________。
(质疑反思)甲同学认为猜想三不能成立,因为①②号试管中溶液混合后烧杯中没有蓝色沉淀生成。
乙同学则认为猜想三是可以成立的理由是____________________________________。
30.某兴趣小组探究与稀盐酸的反应。
(1)镁与稀盐酸反应的化学方程式为_________________。
(2)实验前,用砂纸打磨镁条的目的是_____________________________。
(3)将打磨后的镁条放入稀盐酸中,一段时间后发现有“灰白色沉淀”产生的异常现象。
(提出问题)灰白色沉淀可能含有什么物质?
(查阅资料)Mg(OH)2受热分解生成MgO和H2O;变色硅胶遇水由蓝色变为粉红色;
碱式氯化镁( Mg(OH)Cl)不溶于水,受热易分解生成MgO和HCl气体。
(提出假设)甲同学认为灰白色沉淀中不含MgCl2,你认为原因是_______________________。
乙同学认为灰白色沉淀中可能含有:
猜想Ⅰ:Mg 猜想Ⅱ:Mg(OH)C1 猜想Ⅲ:Mg(OH)2
(实验探究)乙同学将灰白色沉淀洗涤、干燥后,分别置于编号为①②③的试管中。
序号
实验操作
实验现象
实验结论
实验1
向试管①中加入适量_____(填物质名称)
沉淀消失无气泡产生
猜想Ⅰ不成立
实验2
加热试管②,并将蘸有紫色石蕊溶液的滤纸条置于试管口
滤纸条变红
猜想Ⅱ_________
实验3
加热试管③,将产生的气体通过变色硅胶
变色硅胶________
猜想Ⅲ成立
(讨论分析)实验2中滤纸条变红是由于HC1气体溶于水使溶液呈___________性,生成HC1气体的原因是_____________________________(用化学方程式表示)。
2022年中考化学二轮专题复习——常见的酸及性质参考答案
一.选择题
1.向石蕊试液中通入二氧化碳气体,再进行加热,溶液颜色变化顺序正确的是( )
A.红色——紫色——红色
B.紫色——红色——紫色
C.红色——紫色——蓝色
D.紫色——无色——紫色
【答案】B
2.下列物质不能与稀盐酸反应的是( )
A.铜 B.氧化铜 C.氢氧化钙 D.碳酸氢钠
【答案】A
3.柠檬汁能使石蕊试液变红色,由此可知柠檬汁( )
A.显酸性 B.显碱性 C.显中性 D.无法确定
【答案】A
4.归纳推理是化学学习中常用的思维方法,下列推理正确的是( )
A.酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定呈酸性
B.单质是由一种元素组成的物质,因此由一种元素组成的物质一定是单质
C.常温下,pH<7的溶液显酸性,因此pH<7的雨水一定都是酸雨
D.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
【答案】A
5.下列性质中属于物理性质的是( )
A.盐酸可以除去铁锈 B.盐酸能使紫色石蕊溶液变红
C.浓盐酸在空气中易形成白雾 D.盐酸遇金属铁会放出气体
【答案】C
6.下列说法不正确的是( )
A.有一种溶液能使无色的酚酞试液变红,则该溶液呈碱性
B.有一种溶液能使紫色的石蕊试液变蓝,则该溶液呈碱性
C.有一种溶液不能使无色的酚酞试液变色,则该溶液呈酸性
D.有一种溶液能使紫色的石蕊试液变红,则该溶液呈酸性
【答案】C
7.装运浓硫酸的箱子应贴的标志是( )
A.B.C.D.
【答案】D
8.稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )
A.稀释浓硫酸 B.测稀硫酸的pH
C.倾倒稀硫酸 D.滴加稀硫酸
【答案】D
9. 要借助酸碱指示剂才能判断反应进行情况的是( )
A. 稀硫酸和氧化铁 B. 稀盐酸和氢氧化铜
C. 稀盐酸和氢氧化钠溶液 D. 硫酸铜溶液和氢氧化钠溶液
【答案】C
10.实验室的浓硫酸、浓盐酸敞口放置一段时间后,如图象描述正确的是( )
A. B.
C. D.
【答案】C
11.小明在探究稀硫酸性质时,下列说法正确的是( )
A.稀H2SO4与紫色石蕊试液反应后,溶液变蓝
B.若能与X反应制取H2,则X是Cu
C.和金属氧化物反应,有盐和水生成
D.若与Y发生中和反应,则Y一定是NaOH
【答案】C
12.小明利用初中化学常见的五种物质之间的相互反应关系,整理出如下的反应“ ”图,图中“一”两端的物质相互能反应。下列说法不正确的是( )
A.甲与稀硫酸反应可能得到黄色溶液 B.甲与碳反应后,固体总质量减小
C.乙与碳反应的生成物难溶于水 D.图中反应只涉及两种基本反应类型
【答案】D
13.如图表示化学反应中溶液的颜色变化,其中X表示稀盐酸或稀硫酸,则下列叙述错误的是( )
A.a可能是紫色石蕊试液 B.b可能是氧化物
C.c可能是单质 D.d可能是单质
【答案】D
14.从微观构成方面来看,稀盐酸、稀硫酸中因为含有相同的某种微粒而具有相似的化学性质,下列变化不能体现不同酸溶液相似的化学性质的是( )
A.稀硫酸能与氯化钡反应
B.稀盐酸能使紫色石蕊溶液变红色
C.稀硫酸能与氢氧化钠反应
D.稀盐酸能与碳酸盐反应产生二氧化碳
【答案】A
15.向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是( )
A. M点时,剩余固体是铜和氧化铜 B. M、N点时,溶液中的溶质均只有CuCl2
C. N、P点时,溶液的pH:N>P D. 混合物中铜的质量为(a-b)g
【答案】D
16.醋酸(CH3COOH是食醋的成分之一,其水溶液中存在H+和CH3COO-。下列说法正确的是( )
A. 醋酸属于氧化物 B. 醋酸不能用于除铁锈
C. 醋酸能与镁反应产生氢气 D. 醋酸中碳元素的质量分数最大
【答案】C
17.在①氧化铁②金属锌③氢氧化铜④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )
A.①②③④ B.①②③ C.①③④ D.②③④
【答案】B
18.构建知识网络是一种重要的学习方法。如图是关于盐酸化学性质的知识网络图:“﹣”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质。若A、B、C分别属于不同类别的化合物,则A、B、C可能是( )
A.CuO、Ba(OH)2、CuSO4 B.NaOH、HNO3、K2CO3
C.KOH、FeCl3、Na2CO3 D.NaOH、Ba(NO3)2、H2SO4
【答案】B
19.室温时,随着向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液的变化),下列分析正确的是( )
A.a点溶液中有两种溶质 B.b点溶液中滴加紫色石蕊溶液,溶液变蓝
C.c点烧杯内液体的pH=7 D.d点溶液中有较多的Ba2+、OH-、SO42-、H+
【答案】C
20.氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法错误的是( )
A. 该实验是将稀盐酸逐渐加入到盛有氧化铜的容器中
B. m点表示氧化铜与稀盐酸恰好完全反应
C. m点和n点对应溶液中铜元素的质量不相等
D. m点和n点对应溶液蒸发结晶后得到的固体成分相同
【答案】C。
二.非选择题
21.硫酸是一种常见的酸,完成下列问题。
(1)实验室浓硫酸稀释的方法是______。
(2)为研究稀硫酸的化学性质,某同学进行了如下实验。
实验中,有气泡产生的反应的化学方程式是______,溶液有颜色变化的是______(填序号),E试管中观察到的现象是______。
【答案】
(1)将浓硫酸沿烧杯壁缓慢注入水中,并用玻璃棒不断搅拌
(2)Zn+ H2SO4=ZnSO4+ H2↑ ACD 有白色沉淀生成
22.用下图装置研究酸、碱的性质。
(1)向1中滴加Na2CO3溶液,观察到的现象是________________________。
(2)向2、3中滴加无色酚酞溶液,溶液变红的是______(填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为________________________。
【答案】澄清石灰水变浑浊 ;2 ; NaOH+HCl=NaCl+H2O
23.下列有关酸的化学性质的关系图,请据图回答问题(“——”表示两种物质能发生化学反应)
(1)写出③中一个化学反应方程式_________________________。
(2)验证④发生中和反应时常选择的指示剂是_________,用离子符号表示其反应的实质____________。
(3)根据关系图,⑤中反应的物质类别是___________________。
(4)常见的稀酸有相似化学性质的原因是_________________。
【答案】(1)CuO+2HCl=CuCl2 +H2O(合理即可)
(2)酚酞 H+ + OH-=H2O
(3)盐
(4)溶液中阳离子都是氢离子
24.构建知识网络,可以帮助我们理解知识间的内在联系。如图是盐酸与不同类别物质之间反应的知识网络。
(1)图中M应为 类物质。
(2)写出一种金属能与盐酸反应生成浅绿色溶液的化学方程式 。
(3)盐酸与碱反应的中和反应的实质是盐酸中的 (写符号)与碱中的OH﹣反应生成H2O。
(4)用盐酸除铁锈(主要成分Fe2O3)的化学方程式是 。
(5)写出一种盐能与盐酸反应生成白色沉淀的化学方程式 。
【答案】盐;Fe+2HCl═FeCl2+H2↑;H+;Fe2O3+6HCl═2FeCl3+3H2O;HCl+AgNO3═AgCl↓+HNO3。
25.某化学兴趣小组同学为探究盐酸的化学性质,做了如下实验:
(1)试管①中的现象是 ,反应后试管②中一定有的阳离子是 (写离子符号)。
(2)试管③中反应的化学方程式为 。
(3)实验中发现试管④中固体全部溶解,试管⑤中产生白色沉淀,接着向试管⑤中滴加氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系,如图2所示。
则试管④中的溶质有 ;图2中a~b段对应溶液中一定发生反应的化学方程式为 。
【答案】(1)溶液变为红色;Fe2+;Fe2O3+3H2SO4═2Fe2(SO4)3+3H2O;(2)H2SO4、Fe2(SO4)3;(3)2NaOH+H2SO4═Na2SO4+2H2O。
26.在化学学习和研究中有很多规律可循。应用规律可以让我们获取新知识。
(1)碱性强弱规律
大量实验证明:金属越活泼。其对应的碱的碱性越强(碱的碱性强弱与碱的溶解性无关)。下列关于碱性强弱判断正确的是______。(填字母序号)
A.KOH>NaOH>Ca(OH)2 B.KOH >Ca(OH)2>NaOH C.NaOH > Ca(OH)2>KOH
(2)强酸制备弱酸规律
较强酸能制备较弱酸。已知酸性强弱:HCl>H2SO4>H2CO3>H2S,则下列反应不可能发生的是______(填字母序号)
A. B.
C.
(3)物质命名规律:
某些类别的物质命名与化合价有关:如:HClO4(高氯酸)、HClO3(氯酸)、HClO2(亚氯酸)、HClO(次氯酸)。磷的含氧酸有H3PO4、H3PO3、H3PO2,其中H3PO4为磷酸,则H3PO2的名称为____________。
【答案】B C 次磷酸
27.化学兴趣小组的同学在验证硫酸的性质时,进行了以下实验。
(实验一)浓硫酸稀释过程中的能量变化。
图一实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水_______。
(实验二)溶液浓度对硫酸化学性质的影响。
图二实验中,观察到很快变黑的是滤纸_______(填“A”或“B”),由此可知,硫酸溶液的浓度不同,腐蚀性不同。
(实验三)稀硫酸的化学性质。
小组同学按图三进行实验。
(1)试管1中发生反应的化学方程式为_______。
(2)试管2中可观察到的现象是_______。
(3)向试管3中滴加了足量的稀硫酸仍无明显现象,要证明二者已经发生反应,可选用_______(填字母序号)继续进行实验,以达到实验目的。
A 酚酞溶液 B 氯化钡溶液 C 硫酸铜溶液
(4)小组同学将4、5两支试管反应后的物质倒入同一洁净的烧杯中,充分反应后过滤,得到无色滤液和白色沉淀。同学们对白色沉淀的成分产生了兴趣,继续进行实验。
(提出问题)白色沉淀的成分是发什么?
(作出猜想)猜想一:_______ 猜想二:BaSO4、BaCO3
(实验与结论)
实验操作
实验现象
实验结论
取少量白色沉淀与试管中,向其中加入足量的稀盐酸。
_______。
猜想二成立。
实验结束后,在老师指导下同学们对废液缸中的固体物质进行了回收。在检验废液时发现硫酸过量,为防止其污染环境,从实验成本的角度考虑,向该废液中加入适量的_______(填一种具体物质),处理后再排放。
【答案】
(实验一)放热
(实验二)B
(实验三)
(1)Zn+H2SO4=ZnSO4+H2↑
(2)红棕色固体逐渐溶解,溶液变为黄色
(3)A
(4)BaSO4 有气泡产生,白色沉淀部分溶解 熟石灰
28.为加深对酸的主要性质的认识,通过实验解释生活中的一些现象。在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
(实验内容与分析)
实验一:按图所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3gNa2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊溶液变_______色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因_______。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有(不考虑酚酞)_________________________(用化学式表示)。
(4)请计算,实验四中理论上可以生成二氧化碳的质量为_______g。
(可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5)
(应用与拓展)
(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜___。
(6)小明在征得老师的同意后,继续进行了如下图所示实验。
由上述实验可以得出氢氧化钙的哪些性质___________________。
【答案】红; 铁锈的主要成分为氧化铁,氧化铁与稀盐酸反应生成氯化铁和水,氯化铁溶液为黄色;足量的稀盐酸除去铁锈后和铁反应产生氢气;或和 ;2.2 ;将混合物加入足量的稀盐酸,充分反应后过滤、洗涤、干燥,得到纯净的铜 ;氢氧化钙微溶于水、氢氧化钙溶液显碱性、氢氧化钙能与稀盐酸反应
29.某化学兴趣小组为验证硫酸的部分化学性质,使用氢氧化钠、碳酸钠、金属铝和另外一种不同类别的物质A进行了相关实验。
(1)实验时观察到稀硫酸与A反应有蓝色溶液生成,则A物质是____________。
(2)稀硫酸与氢氧化钠溶液反应时没有明显现象,为了证明二者发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化的情况见图二、图三、则B溶液是______溶液,图三中的M与图二中X、Y、Z中的______数值相等。
(3)该化学兴趣小组又做了如图所示实验:
(提出问题)②号试管中无色溶液的溶质是什么?
(作出猜想)猜想一:硫酸钠 猜想二:硫酸钠硫酸 猜想三:____________
(实验验证)该小组同学用试管取适量②号试管中的无色溶液,加入一种试剂后,根据产生的现象推断出了②号试管中溶质的成分,该试剂是__________________。
(质疑反思)甲同学认为猜想三不能成立,因为①②号试管中溶液混合后烧杯中没有蓝色沉淀生成。
乙同学则认为猜想三是可以成立的理由是____________________________________。
【答案】CuO ;稀硫酸;Y ;硫酸钠、氢氧化钠;紫色石蕊试液;如果①号试管中稀硫酸过量,则混合后,氢氧化钠先与稀硫酸反应生成硫酸钠和水,也不会产生蓝色沉淀
30.某兴趣小组探究与稀盐酸的反应。
(1)镁与稀盐酸反应的化学方程式为_________________。
(2)实验前,用砂纸打磨镁条的目的是_____________________________。
(3)将打磨后的镁条放入稀盐酸中,一段时间后发现有“灰白色沉淀”产生的异常现象。
(提出问题)灰白色沉淀可能含有什么物质?
(查阅资料)Mg(OH)2受热分解生成MgO和H2O;变色硅胶遇水由蓝色变为粉红色;
碱式氯化镁( Mg(OH)Cl)不溶于水,受热易分解生成MgO和HCl气体。
(提出假设)甲同学认为灰白色沉淀中不含MgCl2,你认为原因是_______________________。
乙同学认为灰白色沉淀中可能含有:
猜想Ⅰ:Mg 猜想Ⅱ:Mg(OH)C1 猜想Ⅲ:Mg(OH)2
(实验探究)乙同学将灰白色沉淀洗涤、干燥后,分别置于编号为①②③的试管中。
序号
实验操作
实验现象
实验结论
实验1
向试管①中加入适量_____(填物质名称)
沉淀消失无气泡产生
猜想Ⅰ不成立
实验2
加热试管②,并将蘸有紫色石蕊溶液的滤纸条置于试管口
滤纸条变红
猜想Ⅱ_________
实验3
加热试管③,将产生的气体通过变色硅胶
变色硅胶________
猜想Ⅲ成立
(讨论分析)实验2中滤纸条变红是由于HC1气体溶于水使溶液呈___________性,生成HC1气体的原因是_____________________________(用化学方程式表示)。
【答案】Mg+2HCl=MgCl2+H2↑;去除镁条表面的氧化膜 ;氯化镁可溶;稀盐酸; 成立; 由蓝色变为粉红色; 酸;Mg(OH)ClMgO+HCl↑
中考化学二轮复习满分练习专题1.4.5 常见的酸碱盐——推断题(含解析): 这是一份中考化学二轮复习满分练习专题1.4.5 常见的酸碱盐——推断题(含解析),共11页。试卷主要包含了C 11等内容,欢迎下载使用。
中考化学二轮复习满分练习专题1.4.4 常见的酸碱盐——图表题(含解析): 这是一份中考化学二轮复习满分练习专题1.4.4 常见的酸碱盐——图表题(含解析),共11页。试卷主要包含了D 10等内容,欢迎下载使用。
中考化学二轮复习满分练习专题1.4.3 常见的酸碱盐——粗盐提纯(含解析): 这是一份中考化学二轮复习满分练习专题1.4.3 常见的酸碱盐——粗盐提纯(含解析),共11页。试卷主要包含了氯化钠是生活中常见的盐,某氯化钠样品中,可能含有杂质,①玻璃棒等内容,欢迎下载使用。












