
2022年中考化学第二轮复习专题六工艺流程题课件PPT
展开这是一份2022年中考化学第二轮复习专题六工艺流程题课件PPT,共49页。PPT课件主要包含了无气泡产生,Cl2,Fe2+,H2O,稀硫酸,FeNiAg,复分解,NaOH,作调味品,铜和铁等内容,欢迎下载使用。
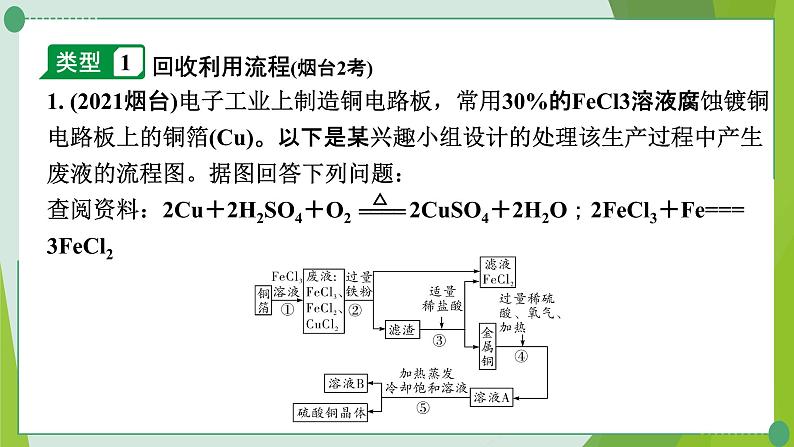
1. (2021烟台)电子工业上制造铜电路板,常用30%的FeCl3溶液腐蚀镀铜电路板上的铜箔(Cu)。以下是某兴趣小组设计的处理该生产过程中产生废液的流程图。据图回答下列问题:查阅资料:2Cu+2H2SO4+O2 2CuSO4+2H2O;2FeCl3+Fe=== 3FeCl2
回收利用流程(烟台2考)
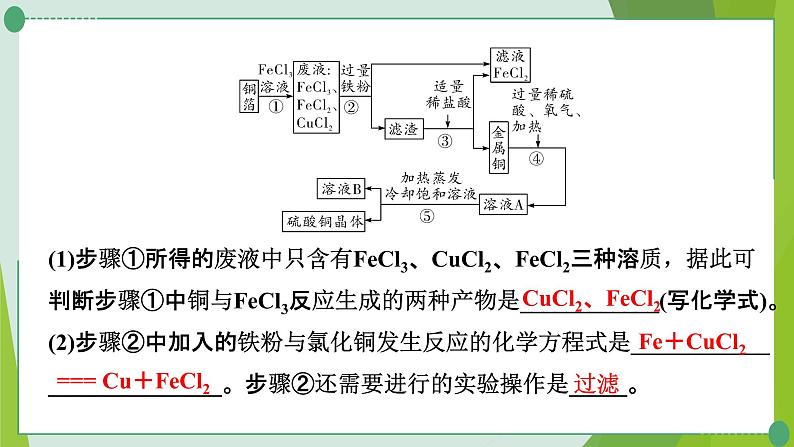
(1)步骤①所得的废液中只含有FeCl3、CuCl2、FeCl2三种溶质,据此可判断步骤①中铜与FeCl3反应生成的两种产物是____________(写化学式)。(2)步骤②中加入的铁粉与氯化铜发生反应的化学方程式是___________________________。步骤②还需要进行的实验操作是_____。
CuCl2、FeCl2
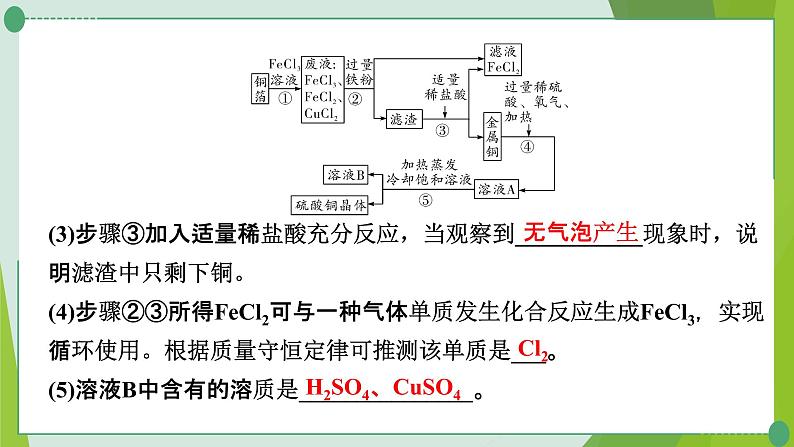
(3)步骤③加入适量稀盐酸充分反应,当观察到___________现象时,说明滤渣中只剩下铜。(4)步骤②③所得FeCl2可与一种气体单质发生化合反应生成FeCl3,实现循环使用。根据质量守恒定律可推测该单质是___。(5)溶液B中含有的溶质是_______________。
H2SO4、CuSO4
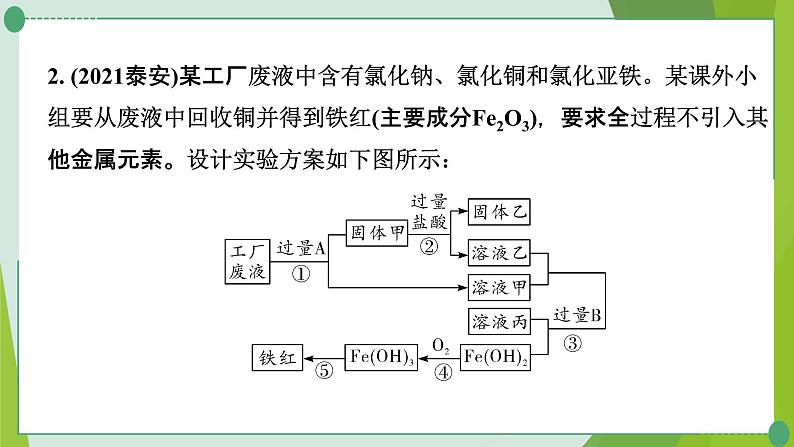
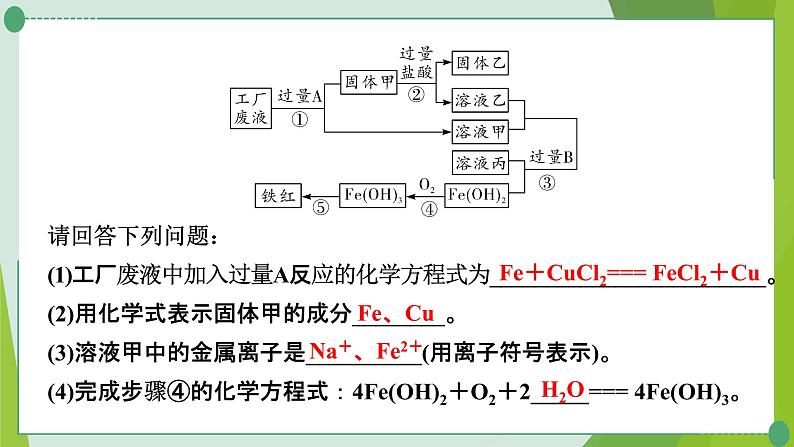
2. (2021泰安)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示:
请回答下列问题:(1)工厂废液中加入过量A反应的化学方程式为________________________。(2)用化学式表示固体甲的成分________。(3)溶液甲中的金属离子是__________(用离子符号表示)。(4)完成步骤④的化学方程式:4Fe(OH)2+O2+2_____=== 4Fe(OH)3。
Fe+CuCl2=== FeCl2+Cu
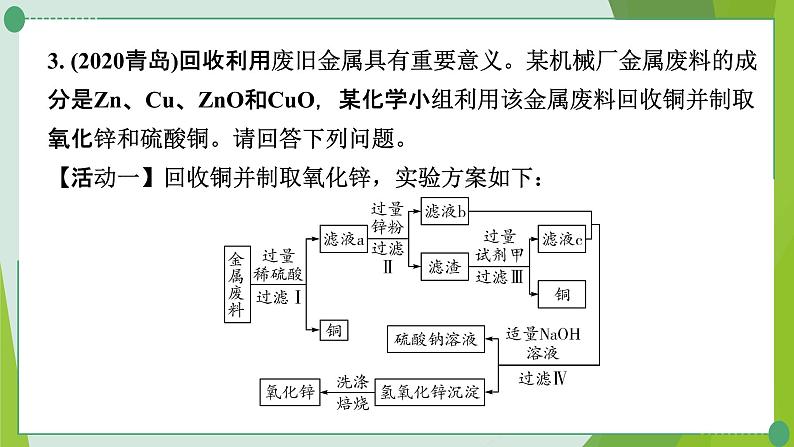
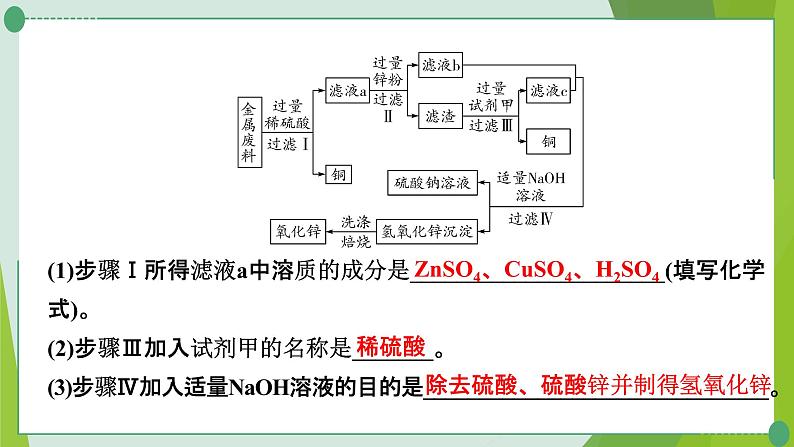
3. (2020青岛)回收利用废旧金属具有重要意义。某机械厂金属废料的成分是Zn、Cu、ZnO和CuO,某化学小组利用该金属废料回收铜并制取氧化锌和硫酸铜。请回答下列问题。【活动一】回收铜并制取氧化锌,实验方案如下:
(1)步骤Ⅰ所得滤液a中溶质的成分是______________________(填写化学式)。(2)步骤Ⅲ加入试剂甲的名称是_______。(3)步骤Ⅳ加入适量NaOH溶液的目的是______________________________。
ZnSO4、CuSO4、H2SO4
除去硫酸、硫酸锌并制得氢氧化锌
【活动二】利用活动一回收的铜制取硫酸铜,设计方案如下:方案A:Cu CuO CuSO4方案B:Cu CuSO4【信息】Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(4)方案A中氧化铜与稀硫酸反应的化学方程式为_________________________________。(5)小组同学从绿色化学的视角分析方案B不合理,理由是__________________________________________( 写出一条即可)。
4. (2021重庆A卷)某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如下图所示(部分产物略去)。
查阅资料:a. H2O2溶液可将Fe2+转化为Fe3+。 b. Fe3+、Ni2+转化为对应的氢氧化物沉淀时,溶液pH有如下关系:(1)步骤Ⅰ的操作为_____。(2)滤渣①的成分为____。
(3)单质Fe参与反应的化学方程式为_____________________________________________________(任写一个)。(4)滤液②中有Ni2+、无Fe3+,则滤液②pH可能为____(填序号)。A. pH=1 B. pH=2 C. pH=6 D. pH=10(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为__________。
Fe+H2SO4=== FeSO4+H2↑(或Fe+NiSO4=== FeSO4+Ni)
5. (2021深圳)某科学兴趣小组,用废渣(主要为CaCO3,还含有C、Fe2O3、MgO等少量杂质)去制作CaCl2,反应过程如图所示。
(1)Ⅰ过程中加过量稀盐酸溶液的目的是_________________________________________;(2)Ⅰ过程中MgO发生反应的化学反应方程式___________________________,此反应为_______反应(填基本反应类型)。(3)滤渣一的成分为___(填化学式);(4) X溶液为______(填化学式);
(5) NaCl 在生活中的用处:________(写一例)。(6)已知CaCl2与焦炭、BaSO4 在高温下生成BaCl2和CO和CaS,写出该反应的方程式:__________________________________________。
1. (2017济宁)氧化锌广泛用于皮肤病的治疗,工业氧化锌常含有少量杂质(CuO、FeO、SiO2等)不能直接使用。提纯、净化氧化锌的简易流程如图所示:参考资料:SiO2既不溶于水也不与酸反应
分离提纯流程(济宁:2017.14)
(1)反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式为_______________________。(2)残渣中除金属锌外,还有_______。(3)操作一、操作二和操作三采用的分离方法是____。(4)操作四发生反应的化学方程式为________________________。
ZnSO4、CuSO4、FeSO4
2. (2021安徽)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如下。(1)“酸浸”中使用的酸是___(填字母序号)。A. HCl B. H2SO4 C. Na2SO4(2)流程中涉及到的氧化物有____________(写出一种即可)。(3)“煅烧”过程发生反应的化学方程式为___________________________,反应类型是________。(4)该工艺的价值在于__________。
Al2O3(或H2O)
3. (2021重庆B卷)重庆多地都曾出现过盐井,从天然盐井水中获取的粗盐(含泥沙、CaCl2、MgCl2、Na2SO4等杂质)。为了除去以上杂质得到精盐。小明设计如下实验:【提示】杂质含量较少,不考虑微溶物形成沉淀。
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和_____。(2)沉淀b所含物质为Mg(OH)2和_______。(3)物质X是________。(4)滤液c中加入稀盐酸后发生中和反应的化学方程式为________________________。(5)为了证明滴加的Ba(OH)2溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有__(填序号)。A. Ba(OH)2 B. K2CO3C. Na2SO4 D. KCl
NaOH+HCl===NaCl+H2O
1. (2019烟台)烟台有漫长的海岸线,蕴藏着丰富的海洋资源。(1)海水淡化。可以采用如下图所示的膜分离法淡化海水,水分子可以通过淡化膜(海水中体积较大的盐的离子和其他分子不能通过)进入左侧的淡水池,从而得到淡水。下列说法中正确的是_____(填字母序号)。A. 膜分离法的原理与滤纸过滤原理类似B. 膜分离法还可以浓缩海水中的盐类物质C. 膜分离法也是一种分离混合物的方法D. 该膜分离法的目的是除去海水中的不溶物
制镁、制碱、晒盐流程 (烟台、济宁各3考,淄博:2020.17,东营:2021.17)
除去过量的碳酸钠和氢氧化钠
(3)海水资源综合利用的部分途径如下图。
①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,使碳酸氢钠结晶析出,该反应的化学方程式是__________________________________________。②写出步骤Ⅰ电解饱和NaCl溶液的化学方程式是________________________________________。③海水制镁。实际生产中,步骤Ⅲ常选用______作为沉淀剂,从海水中提取MgCl2历经步骤Ⅱ、Ⅲ、Ⅳ三步转换的主要目的是___________。
2. (2018枣庄节选)海洋是个巨大的宝藏,人类利用海洋化学资源大体上经历了如下图所示几个阶段。
BaCl2、NaOH、Na2CO3(或BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3)
(2)氯碱工业基本流程:由图示可知氯碱工艺中可循环利用的物质是_____。
(3)海水提镁流程:写出其中任一个反应的化学方程式______________________________________________________________________________________________。(4)下列方法中能淡化海水的是____(填字母)。A. 过滤法 B. 沉淀法C. 多级闪急蒸馏法 D. 分解法
3. (2021烟台模拟)烟台是一座美丽的海滨城市,有漫长的海岸线和丰富的海洋资源,近年来我市加快发展海水淡化和综合利用产业。(1)海水淡化。我市长岛、龙口、芝罘等多地实施建设海水淡化工程,海水淡化的常用方法有_____、膜法(RO)和离子交换树脂法等。(2)海水晒盐。海水晒盐是一个_____结晶过程,采用这种结晶方法的原因是_________________________________。
氯化钠的溶解度受温度影响变化较小
过量的NaOH和Na2CO3
(4)海水制碱。某化工企业利用“侯氏制碱法”生产纯碱的部分工艺流程示意图:查阅资料知:①NH4Cl NH3↑+HCl↑;②氨气极易溶于水,氨水呈碱性。①检验食盐水是否饱和的方法是___________________________________________________________。
②操作Ⅰ的名称是_____。实验室进行此操作时,玻璃棒的作用是_____。③“侯氏制碱法”中,向饱和氨盐水中通入足量的CO2,使氨水、水、NaCl和CO2反应生成NaHCO3等,该反应的化学方程式为___________________________________________。④处理含氯化铵混合溶液时,不直接加热蒸干得到氯化铵固体的原因是__________________。
1. (2021枣庄)二氧化碲(TeO2)是性能优良的声光晶体材料。用某工业废渣(主要含有TeO2,还有少量Cu,Ag)为原料制备纯净的TeO2的一种工艺流程如图:
生产制备流程(烟台3考,东营2考,济宁:2021.14)
已知:TeO2微溶于水,能与NaOH发生反应。回答下列问题:(1)粉碎的目的是___________________________________。(2)类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式:_______________________________。(3)“碱浸”后过滤,此时滤渣成分为________。(4)“沉碲”时,加入硫酸的作用为________________________________________。
增大反应物的接触面积,加快反应速率
TeO2+2NaOH=== Na2TeO3+H2O
2. (2021济宁)铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为Al2O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见下图:
(1)铝土矿中的SiO2不溶于水,也不与盐酸反应,操作①的目的是_________;(2)操作③得到的Al(OH)3,受热分解生成Al2O3,该反应的化学方程式为____________________________,铝土矿经过操作①~④的目的是________________;(3)在冰晶石作助熔剂条件下,高温电解Al2O3得到金属铝,该反应的化学方程式为_________________________。
3. (2018烟台)2017年12月28日,全球首段承载式太阳能光伏发电公路试验段在我省建成通车。高纯硅是光伏发电的重要材料,生产高纯硅的流程图如图:(1)生产高纯硅需要对普通石英砂(含有少量Fe2O3杂质)进行提纯,其中酸洗是一个重要的步骤。请写出用盐酸除去Fe2O3的化学方程式_____________________________。
Fe2O3+6HCl=== 2FeCl3+3H2O
(2)整个生产过程中必须控制无氧、无水。在HSiCl3与H2反应过程中若混入O2,可能引起的后果是________,HSiCl3遇水能剧烈反应生成H2SiO3、H2与HCl,该反应的化学方程式是__________________________________。(3)为了节约资源,上述生产流程中可循环利用的物质是_________(填化学式)。
HSiCl3+3H2O=== H2SiO3+H2↑+3HCl↑
4. (2020东营)下图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)(1)用高炉冶铁的主要反应原理是___________________________________________________________(用化学方程式表示)。
(2)分析流程图,三脱装置中发生反应的基本反应类型是__________。(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中________(填一种仪器的名称)的作用。(4)铁与镍相比,铁的金属活动性___镍(填“>”“=”或“<”),判断依据是________________________(用化学方程式表示)。(5)通过以上信息,得出白铜的成分是_______,其硬度比纯铜___(填“大”或“小”)。
Fe+NiSO4=== FeSO4+Ni
5. (2021黄石)以黄铜矿(主要成分为CuFeS2)为原料,采用生物炼铜是现代炼铜的新工艺,同时还可以获得绿矾(FeSO4·7H2O),流程如下:
(1)步骤①中的化学方程式:4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+______。(2)步骤②中的反应有两个:反应一是Fe+Fe2(SO4)3=== 3FeSO4,该反应属于________(填基本反应类型),反应二的化学方程式为_____________________________。(3)加入的A是________(填化学式)。(4)获得绿矾的“一系列操作”为:蒸发浓缩、_________、过滤等。
6. (2021江西)江西赣州被誉为“世界钨都”,钨(W)是一种重要的战略资源。下图是一种生产钨的工业流程:
已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;碳在高温条件下会与金属钨反应生成碳化钨。(1)操作1中粉碎白钨矿的目的是_____________________________________________________。(2)操作2所得滤液中一定含有的阳离子是_____、___。
(3)流程中氨水(NH3·H2O)和H2WO4反应生成(NH4)2WO4的化学方程式为_______________________________________。(4)用氢气还原WO3可获得高纯度的钨,此处不宜用焦炭代替氢气的原因是__________________________________________________________。
2NH3·H2O+H2WO4=== (NH4)2WO4+2H2O
不易获得高纯度的金属钨(或会引入碳杂质、会生成杂质碳化钨等)
7. (2021岳阳)84消毒液(主要成分是NaClO)是一种常用的环境消毒剂, 某同学用粗盐(含CaCl2、MgCl2、Na2SO4、 泥沙等杂质)制84消毒液的流程如下:
(1)操作①的名称是______。(2)溶液E中加入适量稀盐酸的目的是________________________________。(3) NaCl溶液通电时生成Cl2 (黄绿色气体)、H2和NaOH的化学方程式为______________________________________。(4) NaClO溶液能与空气中的CO2反应而变质,所以84消毒液应_____储存。
除去过量的NaOH溶液和Na2CO3溶液
11. (2021广西北部湾)某工厂生产高锰酸钾的流程如下图所示。请回答下列问题:(1)“混合加热室”发生的主要是_________(填“物理变化”或“化学变化”)。(2)“电解室”反应中,反应前后化合价发生变化的元素有________(写元素符号)。
相关课件
这是一份中考化学复习专题突破三工艺流程题教学课件,共34页。PPT课件主要包含了HCl,Mg2+,置换反应,除去B中的MgO,复分解反应,作氮肥合理即可,复分解,稀硫酸,SiO2,H2O等内容,欢迎下载使用。
这是一份中考化学复习专题突破三工艺流程题分层作业课件,共26页。PPT课件主要包含了H2O,烧成炉,涂油或制成合金等,铜或Cu,NH3·H2O,碘酒或碘水,光合作用等内容,欢迎下载使用。
这是一份2023年中考化学专题复习工艺流程题课件PPT,共15页。PPT课件主要包含了洗涤干燥,NaOH,CuSO4,样品充分溶解,玻璃棒,H2O,提供热量,CaOH2,CaCO3,CO2等内容,欢迎下载使用。












