





初中化学人教版九年级下册课题2 酸和碱的中和反应图片课件ppt
展开课题2 酸和碱的中和反应
1、学会用pH试纸测溶液的酸碱度
2、能用所学的知识和方法去测试一些物质的pH。
会用pH试纸测溶液的酸碱度。
阅读课本60-61页 ,并观察图10-15、10-16,3分钟后完成下列问题:
1、怎样表示溶液的酸碱度?
2、pH的范围在多少之间?pH的范围.ppt
4、溶液的pH与溶液酸碱度有什么关系?溶液的酸碱性与pH的关系.ppt
3、怎样测定溶液的pH ?pH的测定方法.ppt
用pH表示溶液的酸碱度
pH的范围在0-14之间
用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
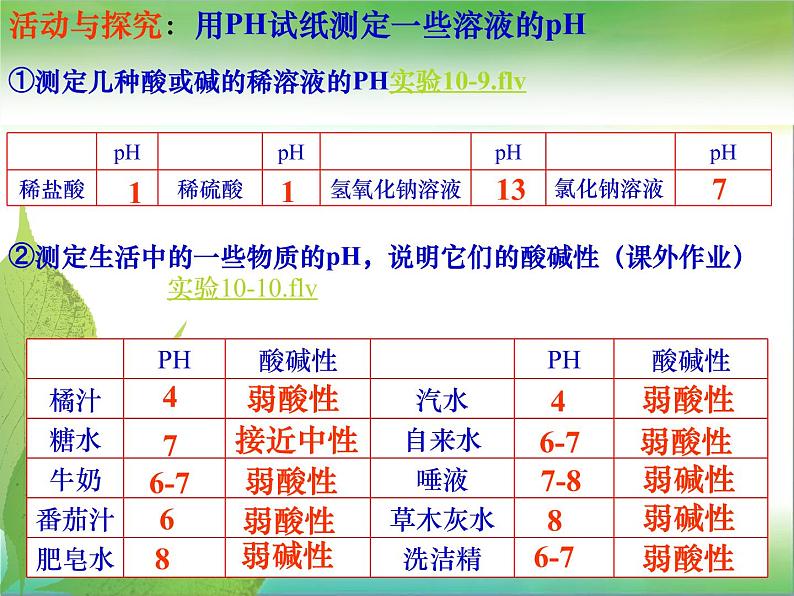
活动与探究:用PH试纸测定一些溶液的pH
①测定几种酸或碱的稀溶液的PH实验10-9.flv
②测定生活中的一些物质的pH,说明它们的酸碱性(课外作业) 实验10-10.flv
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
③测定雨水的pH,可以了解空气的污染情况 [注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6];
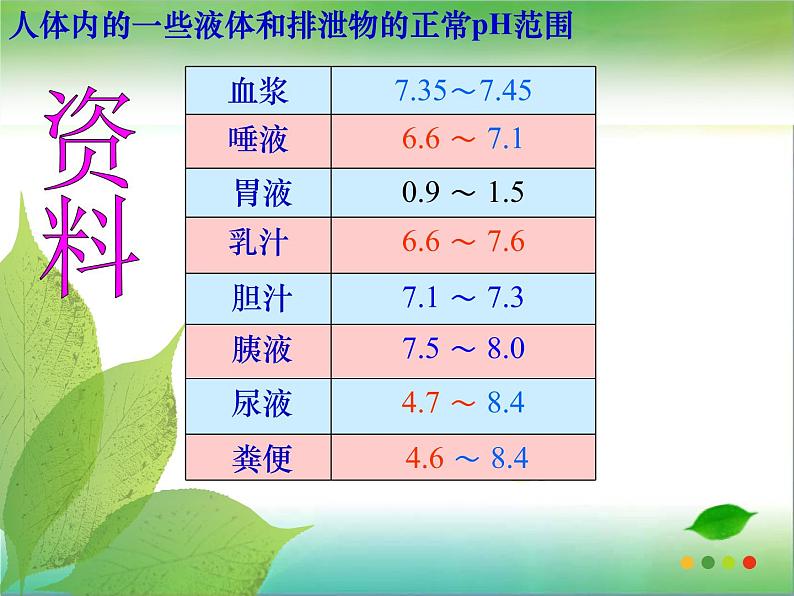
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
阅读课本62页倒数第5-1段 ,2分钟后完成下列问题:
了解溶液的酸碱度有哪些重要意义?
人体内的一些液体和排泄物的正常pH范围
⑴加碱:pH增大至=或﹥ 7
⑵加水:pH增大至≈7
⑴加酸:pH减小到=或﹤ 7
⑵加水:pH减小至≈7
三、 溶液酸碱度的表示法—pH
1、pH的范围在0-14之间
3、 溶液的酸碱性与pH的关系:
⑴pH = 7,溶液显中性 。
⑵ pH﹤ 7,溶液显酸性, pH越小,酸性越强。
⑶ pH ﹥ 7,溶液显碱性,pH越大,碱性越强。
1、酸加入碱中 当把酸加进碱的时候 ,碱的性质逐渐改变。当全部碱刚好被中和时,溶液的pH值很快地转变至pH=7,如果将更多的酸加入时,酸碱度便会降至pH=7以下。
(中和过程pH的变化)
请思考碱加入酸中pH怎样变化?
在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图13所示。 (1)该反应的化学方程式为: 。(2)该实验操作是将 滴加到另一种溶液中。(3)当加入溶液的质量为a g时,所得溶液中的溶质为(写化学式) 。(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈 色。
NaOH+HCl=NaCl+H2O
HCl、NaCl
2.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。
1.PH=0的溶液是 ( ) A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
3、下列实验操作记录与序号相同的图像所表示的变化关系不相符合的是( )
A. 向稀NaOH溶液中逐滴滴入pH=1的稀盐酸至过量 B.用水稀释pH=1的硫酸溶液C. 向稀硫酸中逐滴滴入Ba(OH)2溶液至稍过量 D.向镁粉中加入足量的稀硫酸
Ba(OH)2+H2SO4=BaSO4↓+2H2O
Mg+H2SO4=MgSO4+2H2↑
4.失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,可用 加以区分。
(提示:HCl + NaOH=NaCl + H2O)
⑵分别滴加酚酞,振荡。
⑶取少量NaOH溶液再分别滴到另外两只试管中,振荡。
⑴用三支试管,分别取少量三种无色液体。
变红的无色液体是蒸馏水,仍为无色的是稀盐酸。
能否用酚酞试液将它们鉴别出来?
1.盐酸和硫酸属于酸,酸在水溶液中能解离出H+和酸根离子。
酸 → H+ + 酸根离子(如SO42-、NO3-、Cl-)
2.氢氧化钠和氢氧化钙属于碱,碱在水溶液中能解离出金属离子和OH-。
碱→ OH- + 金属离子(如Na+、 K+)
3.酸和碱在生产和生活中有广泛的用途。
1.酸和碱都能与指示剂反应,指示剂遇酸或碱显示不同的颜色。
2.酸能与多种活泼(H前)金属反应,生成盐和氢气,如:
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
3.酸能与某些金属氧化物反应,生成盐和水,如:
Fe2O3+ HCl= FeCl3+ H2O
Fe2O3+ H2SO4=Fe2(SO4)3+ H2O
4.碱能与某些非金属氧化物反应,生成盐和水,如:
Ca(OH)2+CO2=CaCO3 ↓+ H2O
2NaOH+CO2= Na2CO3 + H2O
2NaOH+SO3=Na2SO4 + H2O
5.酸和碱能发生中和反应,生成盐和水,如:
HCl + NaOH= NaCl +H2O
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O
①pH 7,溶液呈中性, ②pH 7溶液呈酸性, PH越小,酸性越强,③pH 7溶液呈碱性, PH越大,碱性越强。
溶液的酸碱度可用pH表示,范围通常 在0~14之间。用pH试纸可以测定溶液的酸碱度。
溶液的酸碱性与pH的关系:
三、溶液的酸碱度的表示方法——pH
2020-2021学年课题2 酸和碱的中和反应一等奖课件ppt: 这是一份2020-2021学年课题2 酸和碱的中和反应一等奖课件ppt,共1页。
初中化学人教版九年级下册课题2 酸和碱的中和反应优质ppt课件: 这是一份初中化学人教版九年级下册课题2 酸和碱的中和反应优质ppt课件,共1页。
人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应优秀课件ppt: 这是一份人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应优秀课件ppt,文件包含人教九下第10单元课题2酸和碱的中和反应第二课时pptx、生活中一些物质的PHmp4、用PH试纸测定PHmp4等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。













