




2021届高考化学三轮复习专项冲刺:化学反应原理综合(第三课时)课件PPT
展开三、重点突破:读懂图像 ——精准判断速率、平衡对实际生产的调控作用
【审题要领】1.看题干,明方向看清题目要求,在题干中圈出关键词,明确是速率问题还是平衡移动问题,分清楚是“恒温恒压”还是“恒温恒容”,或其他限制条件。
2.识图表,“面、点、线”识图是解题的基础,①面即坐标系,明确横、纵坐标所表示的化学含义②找点:找出曲线中的特殊点(起点、顶点、拐点、终点、交叉点、平衡点等)③析线:正确分析曲线的走向、变化趋势(上升、下降、平缓、转折等),同时对走势有转折变化的曲线,要分段进行分析,研究找出各段曲线的变化趋势及其含义。
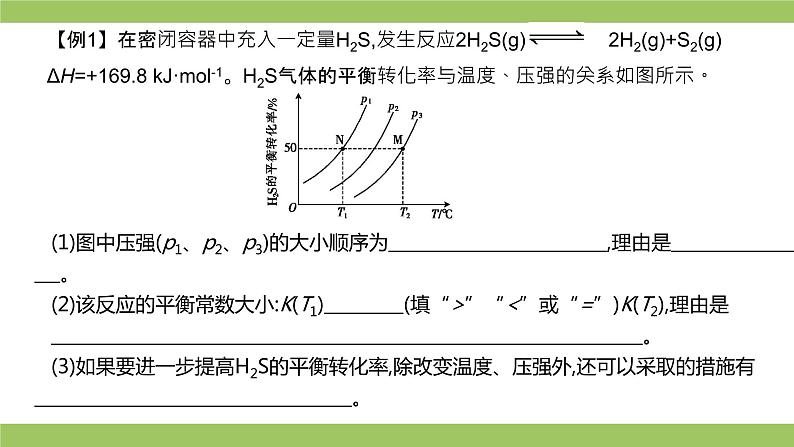
【例1】在密闭容器中充入一定量H2S,发生反应2H2S(g) 2H2(g)+S2(g) ΔH=+169.8 kJ·ml-1。H2S气体的平衡转化率与温度、压强的关系如图所示。
(1)图中压强(p1、p2、p3)的大小顺序为 ,理由是 。 (2)该反应的平衡常数大小:K(T1) (填“>”“<”或“=”)K(T2),理由是 。 (3)如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有 。
答案▶ (1)p1
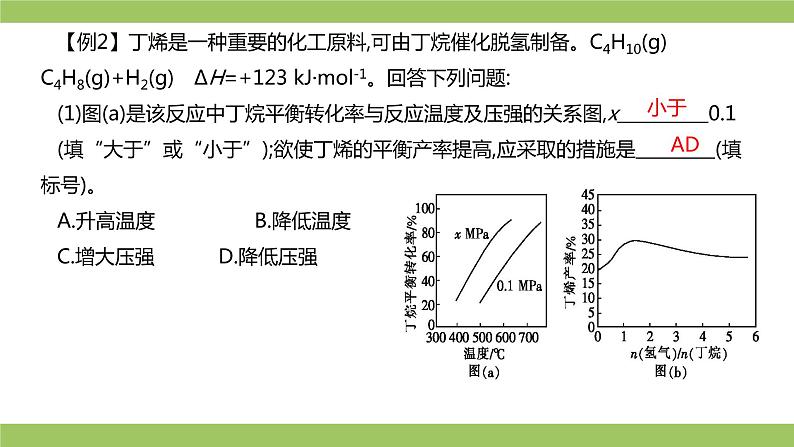
【例2】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。C4H10(g) C4H8(g)+H2(g) ΔH=+123 kJ·ml-1。回答下列问题:(1)图(a)是该反应中丁烷平衡转化率与反应温度及压强的关系图,x 0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是 (填标号)。 A.升高温度 B.降低温度C.增大压强 D.降低压强
升高温度有利于反应向吸热反应方向进行
升高温度时,反应速率加快
丁烯高温裂解生成短碳链烃类
1.转化率—投料比—温度图像[例1] 将燃煤废气中的CO2转化为甲醚的反应原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见右图:
此反应_____(填“放热”或“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将______(填“增大”“减小”或“不变”)。
2.根据图像判断投料比[例2] 采用一种新型的催化剂(主要成分是Cu—Mn合金),利用CO和H2制备二甲醚(DME)。主反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)副反应:CO(g)+H2O(g) CO2(g)+H2(g)CO(g)+2H2(g) CH3OH(g)测得反应体系中各物质的产率或转化率与催化剂的关系如图所示。则催化剂中n(Mn)/n(Cu)约为_____时最有利于二甲醚的合成。
解析 由图可知当催化剂中n(Mn)/n(Cu)约为2.0时,CO的转化率最大,生成的二甲醚最多。
3.废物回收及污染处理图像[例3] (1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气进行回收。反应为2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270 kJ·ml-1①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是______________________________________________________________________。
Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转
②某科研小组用Fe2O3作催化剂。在380 ℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为____。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
①写出该脱硝原理总反应的化学方程式:___________________________________________。
6NO+3O2+2C2H4 3N2+
②为达到最佳脱硝效果,应采取的条件是____________________。
350 ℃、负载率3.0%
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以AgZSM5为催化剂,测得NO转化为N2的转化率随温度变化情况如图5所示。
若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因是___________________________________________________;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在______左右。
NO分解反应是放热反应,升高温度不利于分解反应进行
1.已知H2S高温热分解制H2的反应如下:2H2S(g) 2H2(g)+S2(g)。在恒容密闭容器中,控制不同温度进行H2S的分解实验。
以H2S的起始浓度均为c ml·L-1测定H2S的转化率,结果如图所示。图中曲线a为H2S的平衡转化率与温度关系曲线,曲线b表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。随温度的升高,曲线b向曲线a逼近的原因是 。
温度升高,反应速率加快,达到平衡所需的时间缩短,故曲线b向曲线a靠近
2021届高考化学三轮复习专项冲刺:综合实验(一)课件PPT: 这是一份2021届高考化学三轮复习专项冲刺:综合实验(一)课件PPT,共26页。PPT课件主要包含了实验综合题特点,考情预测,常见的量气装置,实验综合题常见考查点等内容,欢迎下载使用。
2021届高考化学三轮复习专项冲刺:综合实验(三)课件PPT: 这是一份2021届高考化学三轮复习专项冲刺:综合实验(三)课件PPT,共35页。PPT课件主要包含了实验综合题常见考查点,分析模型,明确题型,了解原理,物质制备分离型,性质原理探究型,定量分析型,装置功能各步骤分目的,实验目的方法,物质结构性质等内容,欢迎下载使用。
2021届高考化学三轮复习专项冲刺:综合实验(二) 课件PPT: 这是一份2021届高考化学三轮复习专项冲刺:综合实验(二) 课件PPT,共23页。PPT课件主要包含了实验综合题常见考查点,分析模型,明确题型,了解原理,物质制备分离型,性质原理探究型,定量分析型,装置功能各步骤分目的,实验目的方法,物质结构性质等内容,欢迎下载使用。












