

所属成套资源:2022届高考化学二轮复习题型专练
专题06 非金属及其化合物-备战2022届高考化学二轮复习题型专练
展开
这是一份专题06 非金属及其化合物-备战2022届高考化学二轮复习题型专练,文件包含专题06非金属及其化合物解析版-备战2022届高考化学二轮复习题型专练doc、专题06非金属及其化合物原卷版-备战2022届高考化学二轮复习题型专练doc等2份试卷配套教学资源,其中试卷共69页, 欢迎下载使用。
一、知识网络梳理
1、碳、硅及其化合物
(1)注意网络构建
(2)扫除知识盲点
①工业上制备粗硅,是用过量的C和SiO2高温下反应,由于C过量,生成的是CO而不是CO2,该反应必须在隔绝空气的条件下进行。
②氢氟酸不能用玻璃容器盛放;NaOH溶液能用玻璃试剂瓶,但不能用玻璃塞。
③酸性氧化物一般能与水反应生成酸,但SiO2不溶于水;酸性氧化物一般不与酸作用,但SiO2能与HF反应。
④硅酸盐大多难溶于水,常见可溶性硅酸盐是硅酸钠,其水溶液称为泡花碱或水玻璃,但却是盐溶液。
⑤H2CO3的酸性大于H2SiO3的,所以有Na2SiO3+CO2(少量)+H2O===H2SiO3↓+Na2CO3,但高温下Na2CO3+SiO2Na2SiO3+CO2↑也能发生,原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO2制得低沸点易挥发的CO2。
⑥SiO2不导电,是制作光导纤维的材料;Si是半导体,是制作光电池的材料。
⑦水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮化硅等是新型无机非金属材料。2、氮及其化合物在考查中结合点
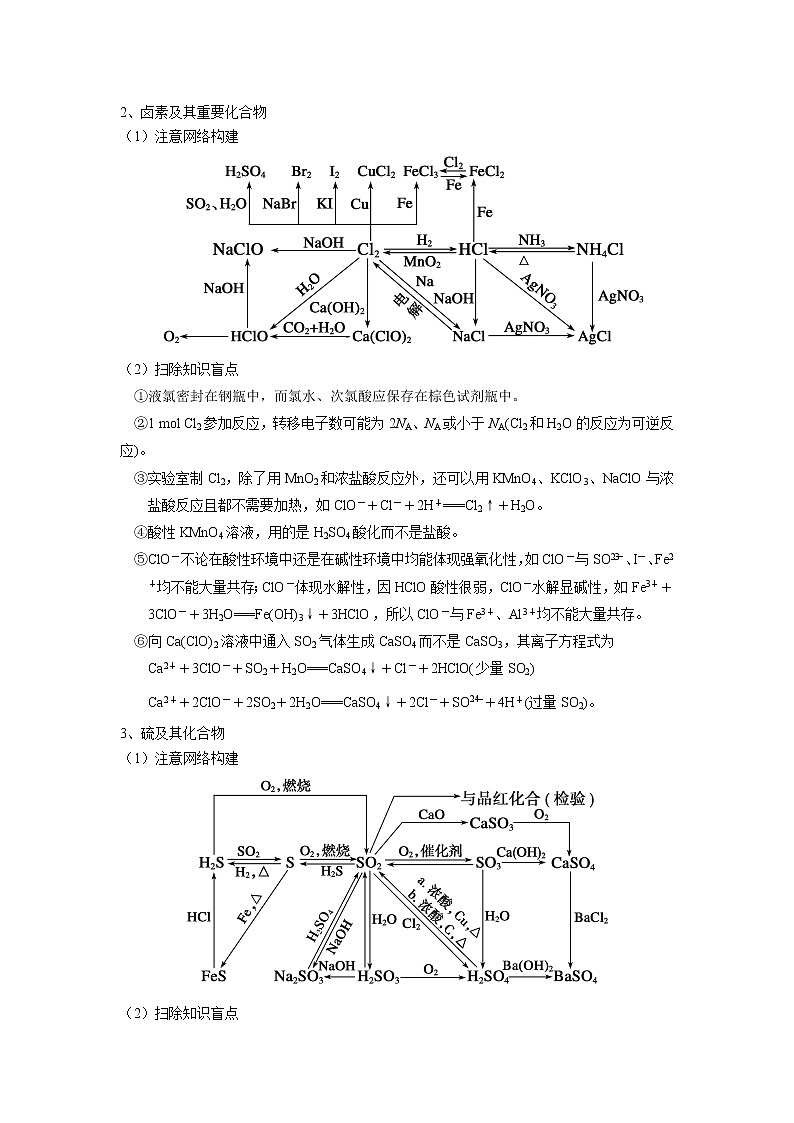
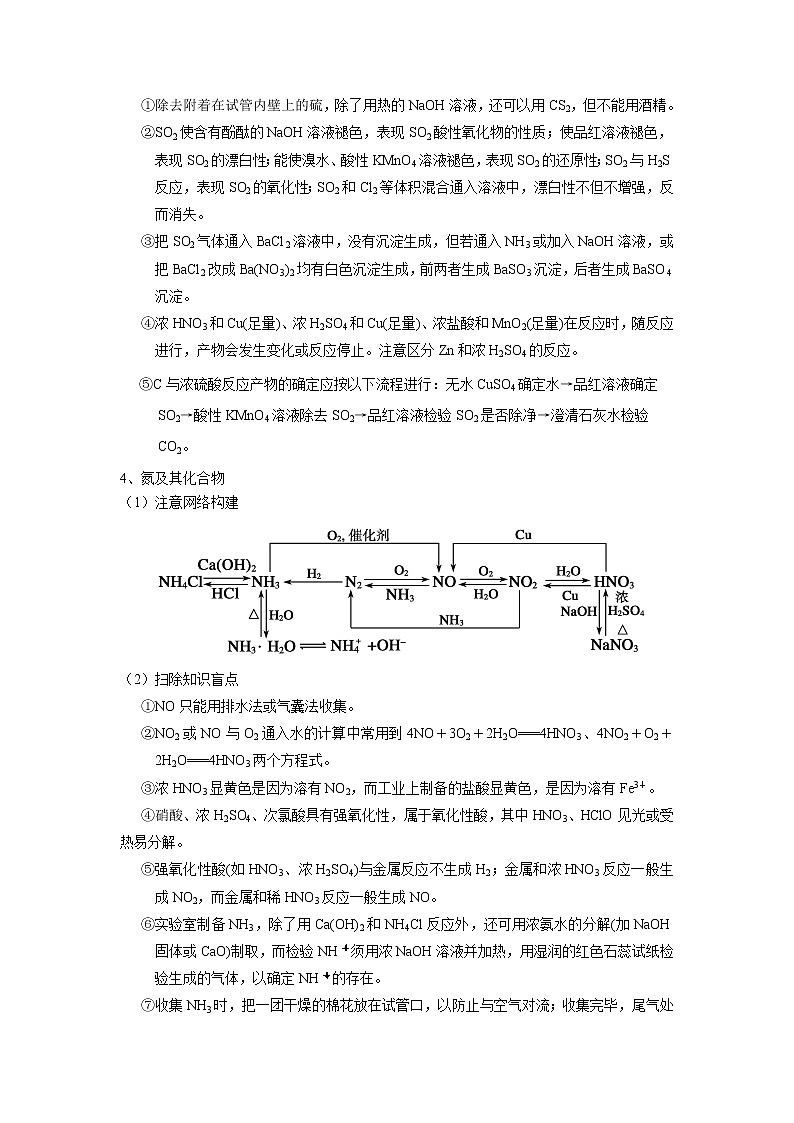
2、卤素及其重要化合物
(1)注意网络构建
(2)扫除知识盲点
①液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。
②1 mol Cl2参加反应,转移电子数可能为2NA、NA或小于NA(Cl2和H2O的反应为可逆反应)。
③实验室制Cl2,除了用MnO2和浓盐酸反应外,还可以用KMnO4、KClO3、NaClO与浓盐酸反应且都不需要加热,如ClO-+Cl-+2H+===Cl2↑+H2O。
④酸性KMnO4溶液,用的是H2SO4酸化而不是盐酸。
⑤ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与SO、I-、Fe2+均不能大量共存;ClO-体现水解性,因HClO酸性很弱,ClO-水解显碱性,如Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO,所以ClO-与Fe3+、Al3+均不能大量共存。
⑥向Ca(ClO)2溶液中通入SO2气体生成CaSO4而不是CaSO3,其离子方程式为
Ca2++3ClO-+SO2+H2O===CaSO4↓+Cl-+2HClO(少量SO2)
Ca2++2ClO-+2SO2+2H2O===CaSO4↓+2Cl-+SO+4H+(过量SO2)。
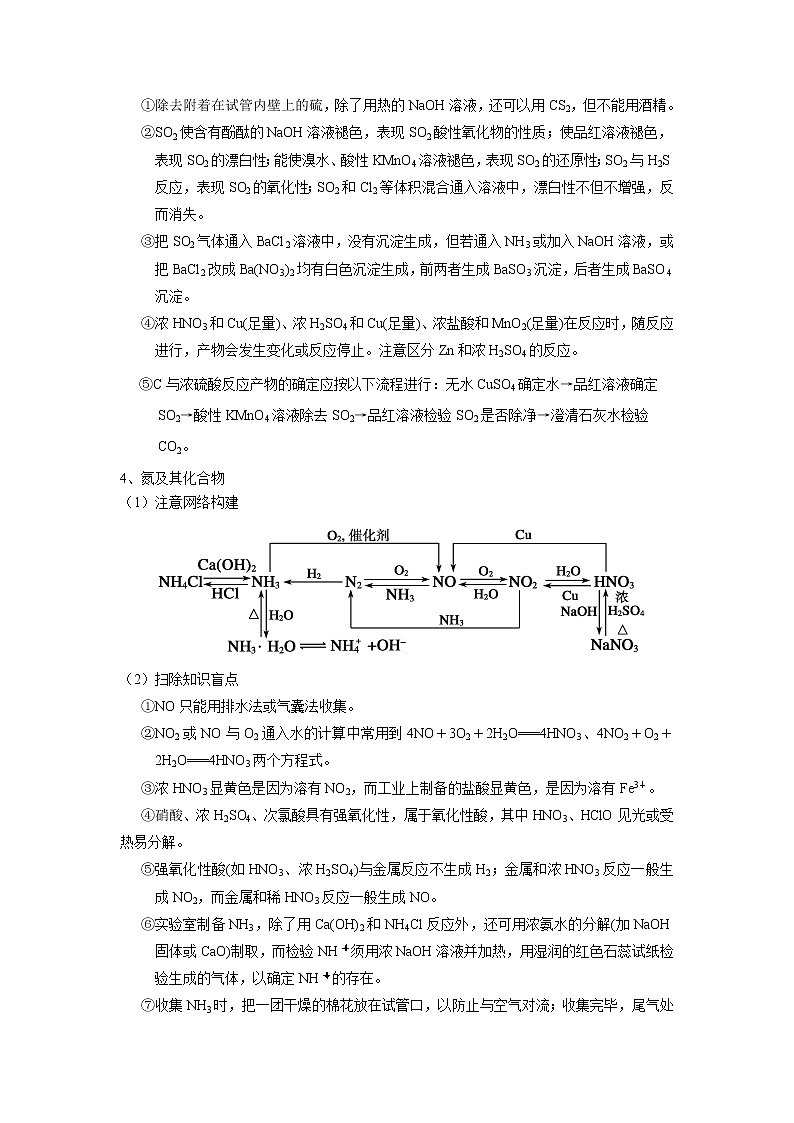
3、硫及其化合物
(1)注意网络构建
(2)扫除知识盲点
①除去附着在试管内壁上的硫,除了用热的NaOH溶液,还可以用CS2,但不能用酒精。
②SO2使含有酚酞的NaOH溶液褪色,表现SO2酸性氧化物的性质;使品红溶液褪色,表现SO2的漂白性;能使溴水、酸性KMnO4溶液褪色,表现SO2的还原性;SO2与H2S反应,表现SO2的氧化性;SO2和Cl2等体积混合通入溶液中,漂白性不但不增强,反而消失。
③把SO2气体通入BaCl2溶液中,没有沉淀生成,但若通入NH3或加入NaOH溶液,或把BaCl2改成Ba(NO3)2均有白色沉淀生成,前两者生成BaSO3沉淀,后者生成BaSO4沉淀。
④浓HNO3和Cu(足量)、浓H2SO4和Cu(足量)、浓盐酸和MnO2(足量)在反应时,随反应进行,产物会发生变化或反应停止。注意区分Zn和浓H2SO4的反应。
⑤C与浓硫酸反应产物的确定应按以下流程进行:无水CuSO4确定水→品红溶液确定SO2→酸性KMnO4溶液除去SO2→品红溶液检验SO2是否除净→澄清石灰水检验CO2。
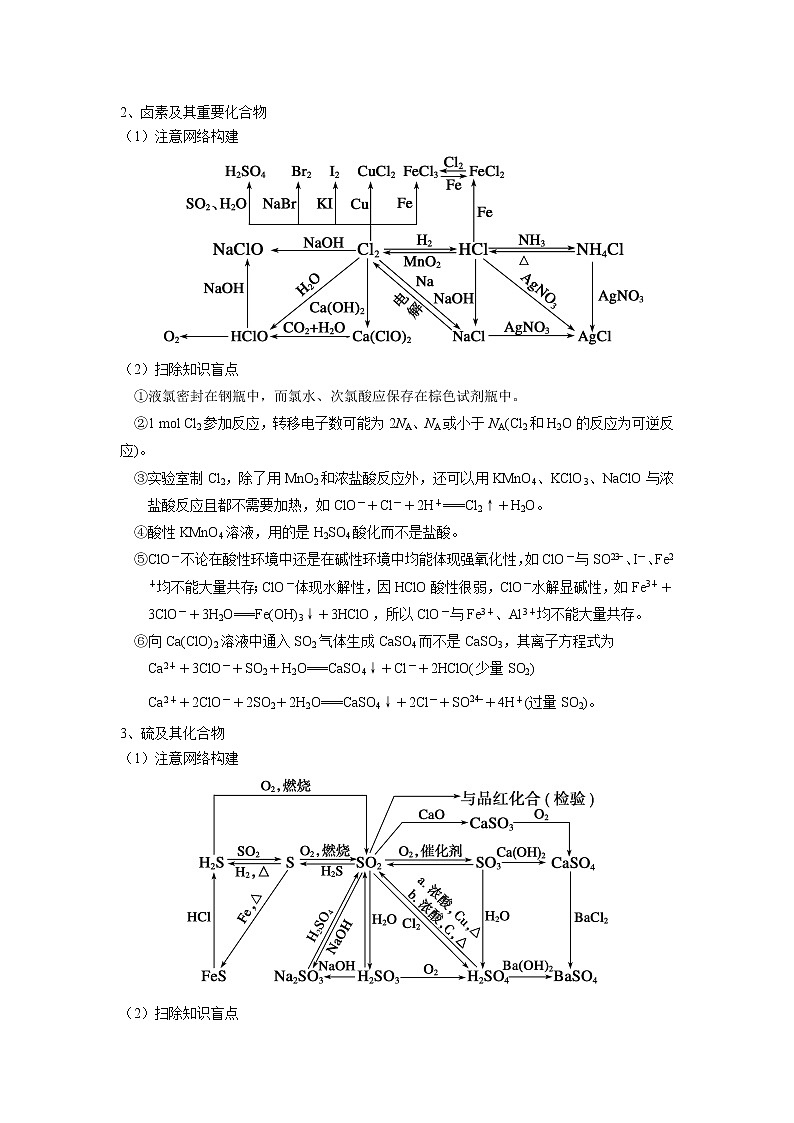
4、氮及其化合物
(1)注意网络构建
(2)扫除知识盲点
①NO只能用排水法或气囊法收集。
②NO2或NO与O2通入水的计算中常用到4NO+3O2+2H2O===4HNO3、4NO2+O2+2H2O===4HNO3两个方程式。
③浓HNO3显黄色是因为溶有NO2,而工业上制备的盐酸显黄色,是因为溶有Fe3+。
④硝酸、浓H2SO4、次氯酸具有强氧化性,属于氧化性酸,其中HNO3、HClO见光或受热易分解。
⑤强氧化性酸(如HNO3、浓H2SO4)与金属反应不生成H2;金属和浓HNO3反应一般生成NO2,而金属和稀HNO3反应一般生成NO。
⑥实验室制备NH3,除了用Ca(OH)2和NH4Cl反应外,还可用浓氨水的分解(加NaOH固体或CaO)制取,而检验NH须用浓NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定NH的存在。
⑦收集NH3时,把一团干燥的棉花放在试管口,以防止与空气对流;收集完毕,尾气处理时,应放一团用稀硫酸浸湿的棉花放在试管口,以吸收NH3。
⑧铜与浓HNO3反应在试管内就能看到红棕色的NO2,而与稀HNO3反应时需在试管口才能看到红棕色气体。
⑨浓盐酸和浓氨水反应有白烟生成,常用于HCl和NH3的相互检验。
5、常见的非金属单质及其化合物的转化关系
(1)直线型转化关系:
非金属单质酸性氧化物酸盐
如:CCO2H2CO3Na2CO3
SSO2H2SO3Na2SO3
PP2O5H3PO4Na3PO4
(2)交叉型转化关系:
如:
(3)连续氧化关系:ABC
如:SSO2SO3;N2NONO2
NH3NONO2;H2SSO2SO3
CCOCO2
二、重点知识回顾
1、硅及其化合物的“反常”
(1)Si的还原性大于C,但C却能在高温下从SiO2中还原出Si:2C+SiO2Si+2CO↑。
(2)非金属单质跟碱溶液作用一般无H2放出,但Si能跟强碱溶液作用放出H2:Si+2NaOH+H2O===
Na2SiO3+2H2↑。
(3)非金属单质一般不跟非氧化性酸作用,但Si能跟氢氟酸作用:Si+4HF===SiF4↑+2H2↑。
(4)非金属氧化物一般为分子晶体,但SiO2为原子晶体。
(5)酸性氧化物一般不与酸作用,但SiO2能与HF作用。
(6)H2CO3的酸性大于H2SiO3,所以有Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,但高温下Na2CO3+SiO2Na2SiO3+CO2↑也能发生,原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由SiO2高沸点难挥发固体制得低沸点易挥发的CO2。
2、氯及其化合物知识中的热点
(1)Cl2与水的可逆反应,HClO的强氧化性和弱酸性。
(2)Cl2与碱的歧化反应。
(3)Cl2作为氧化剂使用,如将Fe2+氧化为Fe3+。
(4)Cl2的实验室制法,还原剂用浓盐酸,氧化剂可以为MnO2(△)、KClO3和KMnO4等。
(5)次氯酸盐为重点
①ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与SO、I-、Fe2+均不能大量共存。
②ClO-体现水解性,因HClO酸性很弱,ClO-水解显示碱性,如Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO。
3、常见无机酸的重要规律和重要特性
(1)重要规律
①最高价氧化物对应水化物的酸性强弱取决于该元素非金属性的强弱,如酸性:
HClO4>H2SO4>H3PO4>H2CO3>H2SiO3。
②证明酸性强弱,可利用复分解反应中“强酸制弱酸”的规律,如:
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓ Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
③强氧化性酸(如:HNO3、浓H2SO4)与金属反应,不生成H2;金属和浓HNO3反应一般生成NO2,而金属和稀HNO3反应一般生成NO。
(2)重要特性
①硝酸、浓H2SO4、次氯酸具有强氧化性,属于氧化性酸,其中HNO3、HClO见光或受热易分解。
②浓HNO3和Cu(足量)、浓H2SO4和Cu(足量)、浓盐酸和MnO2(足量)在反应时,随反应进行,产物会发生变化或反应停止。
③浓H2SO4具有吸水性、脱水性和强氧化性。
④常温下,铁、铝遇浓H2SO4、浓HNO3发生钝化。
4、氮及其化合物
(1).NO、NO2与O2溶于水的计算,利用好两个比值4∶3、4∶1即可
4NO+3O2+2H2O===4HNO3 4NO2+O2+2H2O===4HNO3
(2).HNO3的性质,尤其是强氧化性是热点,涉及与单质反应产物的判断,尤其是与铁的反应如稀HNO3与Fe:Fe+4HNO3(稀,过量) ===Fe(NO3)3+NO↑+2H2O;3Fe(过量)+8HNO3(稀) ===3Fe(NO3)2+2NO↑+4H2O。
5、常见非金属元素形成的离子的检验
(1).利用盐酸和其他试剂检验
CO:加入BaCl2或CaCl2溶液后生成白色沉淀,再加稀盐酸沉淀溶解,并放出无色无味气体。
SO:先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀。
SO:加入BaCl2溶液,产生白色沉淀,再加稀盐酸,放出无色有刺激性气味能使品红溶液褪色气体。
(2).利用AgNO3(HNO3酸化)溶液检验
(3).利用某些特征反应检验
I-:滴入淀粉溶液和氯水,溶液变蓝色(或加入氯水和四氯化碳,四氯化碳层呈紫红色)。
特别注意:设计实验方案进行离子检验时,要设法排除不同离子之间的干扰,如检验SO时一定要排除Ag+和SO的干扰。
三、无机推断
(一)无机物的转化与推断方法
突破口又称“题眼”,解无机推断题的关键在于寻找突破口,常见的突破口主要有以下几类:
1.特殊结构
(1)原子个数比为1∶1的化合物通常是H2O2、C2H2、C6H6、Na2O2等。
(2)“A≡A”分子必然是N2,三角锥形的分子是NH3、PH3等。
(3)具有正四面体结构的有CH4、CCl4、NH、P4等。
(4)不含金属元素的离子化合物为铵盐。
2.物质的特有颜色
常见的有颜色的物质
淡黄色固体
S、Na2O2、AgBr
浅绿色溶液
Fe2+
红色固体
Cu、Cu2O
蓝色溶液
Cu2+
紫黑色固体
I2、KMnO4
棕黄色溶液
Fe3+
红棕色粉末
Fe2O3
红色溶液
Fe(SCN)3
黑色粉末,晶体
MnO2、Fe3O4、CuS、C、CuO
橙色、橙红色溶液
溴水
红褐色沉淀
Fe(OH)3
蓝色晶体
CuSO4·5H2O
白色沉淀
AgCl、BaSO4、Mg(OH)2、
Al(OH)3等
红棕色气体
NO2、Br2(g)
蓝色沉淀
Cu(OH)2
黄绿色气体
Cl2
3.特殊的实验现象
(1)H2在Cl2中燃烧呈苍白色火焰。
(2)遇酚酞溶液变红色的气体是氨气。
(3)在空气中迅速由无色变为红棕色的气体是NO。
(4)Cl2通入含Br-的溶液中,会出现橙色,加入有机溶剂,在有机溶剂层出现橙红色;Cl2通入含有I-的溶液中,会出现深黄色,加入有机溶剂,在有机溶剂层出现紫红色。
(5)遇SCN-显红色或遇OH-生成红褐色沉淀的离子是Fe3+。
(6)遇BaCl2溶液生成不溶于稀HNO3的白色沉淀,则溶液中可能含有Ag+或SO或SO。
(7)遇HCl生成白色沉淀,则溶液中可能含有Ag+或SiO。
(8)使品红溶液褪色的气体可能是Cl2或SO2,但将褪色后的液体加热又复原的是SO2。
(9)碘遇淀粉显蓝色。
(10)实验现象为:白色沉淀→灰绿色→红褐色的转化一定是:Fe(OH)2→Fe(OH)3。
(11)既能跟酸反应又能跟碱反应且生成气体的物质一般是Al、NH4HCO3、(NH4)2CO3、NH4HSO3、(NH4)2SO3、(NH4)2S、NH4HS。
(12)与碱反应产生气体的物质是铝、铵盐,产生的气体一般是H2、NH3。
(13)与水反应产生气体的物质一般是Na、Na2O2、CaC2、Mg3N2等。
4.特殊转化关系
(1)直线型转化
①金属碱性氧化物碱盐:满足此关系的有K、Na、Ca、Ba等。
②非金属酸性氧化物酸盐:满足此关系的有C、N、S等。
③ABC酸或碱:满足此关系的有NH3、S、N2、H2S、C、Na等。
(2)交叉型转化
(3)三角型转化
(4)属于“单质+化合物===新单质+新化合物(置换反应)”类型的反应有:
①单质同主族:2Na+2H2O===2NaOH+H2↑;2C+SiO2Si+2CO↑;
Cl2+2NaBr===2NaCl+Br2等。
②单质不同主族:2Al+6HCl===2AlCl3+3H2↑;H2S+Cl2===2HCl+S↓;C+H2O(g)CO+H2等。
③有过渡元素参加的常见置换反应:Fe+2H+===Fe2++H2↑;Fe+Cu2+===Fe2++Cu。
(5)能“三合一”的反应有:NH3+H2O+CO2===NH4HCO3;4Fe(OH)2+2H2O+O2===4Fe(OH)3。
6.其他特征
(1)常温下短周期呈气态的单质(除惰性气体外):H2、N2、O2、F2、Cl2。
(2)常见的同素异形体:金刚石和石墨、O2和O3、白磷和红磷。
(3)地壳中含量前四位的元素:O、Si、Al、Fe。
(4)常温下呈液态的金属单质:Hg;非金属单质:Br2。
(5)常见的可燃性气体:H2、CO、H2S、CH4、C2H4、C2H2等。
(二)解无机推断题“五步曲”
1.审:审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息标示出来,明确求解要求。
2.找:找“题眼”即找到解题的突破口,此步非常关键。
3.析:从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆思维、发散收敛思维、横向纵向思维等多种思维方式进行综合分析、推理,初步得出结论。
4.验:验证确认,将结果放入原题检验,完全符合才算正确。
5.答:按题目的要求写出答案。
一、碳、硅及其化合物
考向一 碳、硅的性质和用途
典例1 芯片制造的主要过程如图所示,下列说法错误的是
A.沙子的主要成分是
B.粗硅的制取:
C.氟化氢可用于蚀刻硅基
D.在硅基上电镀铜时,硅基做阴极
考向二 CO2、SiO2的性质
典例2 下列关于SiO2和CO2的说法中正确的是
A.CO2、SiO2分别是碳酸和硅酸的酸酐
B.SiO2既能与KOH反应,又能与浓盐酸反应,而CO2不能
C.CO2是酸性氧化物,SiO2是两性氧化物
D.CO2和SiO2都是由相应的分子构成的
二氧化硅的特殊性
(1)非金属氧化物一般由分子构成,而SiO2是由Si和O按个数比1∶2直接构成。Si、SiC、Si3N4、BN等也是直接由原子构成。
(2)SiO2是H2SiO3的酸酐,但它不溶于水,不能直接与水作用制备H2SiO3。
(3)酸性氧化物一般不与酸作用,但SiO2能跟HF作用:SiO2+4HF===SiF4↑+2H2O。
(4)不要混淆二氧化硅和硅的用途
用于制作光导纤维的是SiO2,用于制作半导体材料、计算机芯片的是晶体硅。
(5)水晶、石英、玛瑙的主要成分是SiO2;珍珠的主要成分是CaCO3;钻石是金刚石;红、蓝宝石的主要成分是Al2O3。
考向三 CO2与盐或碱溶液反应的规律
1、CO2与NaOH溶液反应产物的定量判断方法
与碱的反应
反应原理
CO2+2NaOH(足量)Na2CO3+H2O
CO2+NaOH(少量)NaHCO3
反应后溶质成分的判断,x=n(NaOH)∶n(CO2)
x≤1∶1
NaHCO3
1∶1< x 2∶1
NaOH、Na2CO3
也可用数轴表示:
①CO2+Na2CO3+H2O2NaHCO3↓
②CO2(少量)+2NaAlO2+3H2O2Al(OH)3↓+Na2CO3
CO2(足量)+NaAlO2+2H2OAl(OH)3↓+NaHCO3
③CO2(少量)+Ca(ClO)2+H2OCaCO3↓+2HClO
④CO2(少量)+Na2SiO3+H2OH2SiO3↓+Na2CO3
典例3 浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。下列判断不正确的是
A.原NaOH溶液的浓度为0.2 mol·L-1
B.B烧杯中通入的CO2体积为448 mL(标准状况)
C.通入CO2后,A烧杯中的溶质为Na2CO3和NaHCO3
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=2∶1
考向四 无机非金属材料及硅酸盐的表示方法
典例4 青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸处理时,还原产物只有NO。下列说法不正确的是
A.青石棉是一种硅酸盐材料
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1 mol青石棉能使稀硝酸中的1 mol HNO3被还原
二、氮及其化合物
考向一 氮的氧化物性质与相关计算
有关氮的氧化物溶于水的计算,从反应实质看都是氧化还原反应。可以从得失电子数相等或原子守恒的角度分析,简化计算过程。如NOx与O2、H2O转化为硝酸的计算,则反应中O2得到的电子数与NOx失去的电子数相等。
NO2和NO有如下反应:
3NO2+H2O===2HNO3+NO ①
2NO+O2===2NO2 ②
4NO2+O2+2H2O===4HNO3 ③
4NO+3O2+2H2O===4HNO3 ④
(1)NO和NO2的混合气体
NO、NO2的混合气体溶于水时仅涉及反应①,可利用气体体积变化差值进行计算:V剩=V(NO)原+V(NO2)。
(2)NO2和O2的混合气体
NO2和O2的混合气体溶于水时涉及反应③,其计算如下表:
x=
0”或“
相关试卷
这是一份高考化学二轮复习题型专练06化学实验 含解析,共11页。试卷主要包含了 下列说法正确的是, 下列①、②对应的试剂等内容,欢迎下载使用。
这是一份高考化学二轮复习题型专练06《化学实验》(含详解),共13页。试卷主要包含了 下列说法正确的是, 下列①、②对应的试剂等内容,欢迎下载使用。
这是一份专题14 化学反应原理综合-备战2022届高考化学二轮复习题型专练,文件包含专题14化学反应原理综合解析版-备战2022届高考化学二轮复习题型专练doc、专题14化学反应原理综合原卷版-备战2022届高考化学二轮复习题型专练doc等2份试卷配套教学资源,其中试卷共52页, 欢迎下载使用。









