



所属成套资源:2022年高考化学二轮复习专题冲刺(上海专用)
专题11 《铝及其化合物》二轮复习--2022年高考化学二轮复习专题冲刺(上海专用)
展开这是一份专题11 《铝及其化合物》二轮复习--2022年高考化学二轮复习专题冲刺(上海专用),文件包含专题11《铝及其化合物》二轮复习-教师版-2022年高考化学二轮复习专题冲刺上海专用docx、专题11《铝及其化合物》二轮复习-学生版-2022年高考化学二轮复习专题冲刺上海专用docx等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
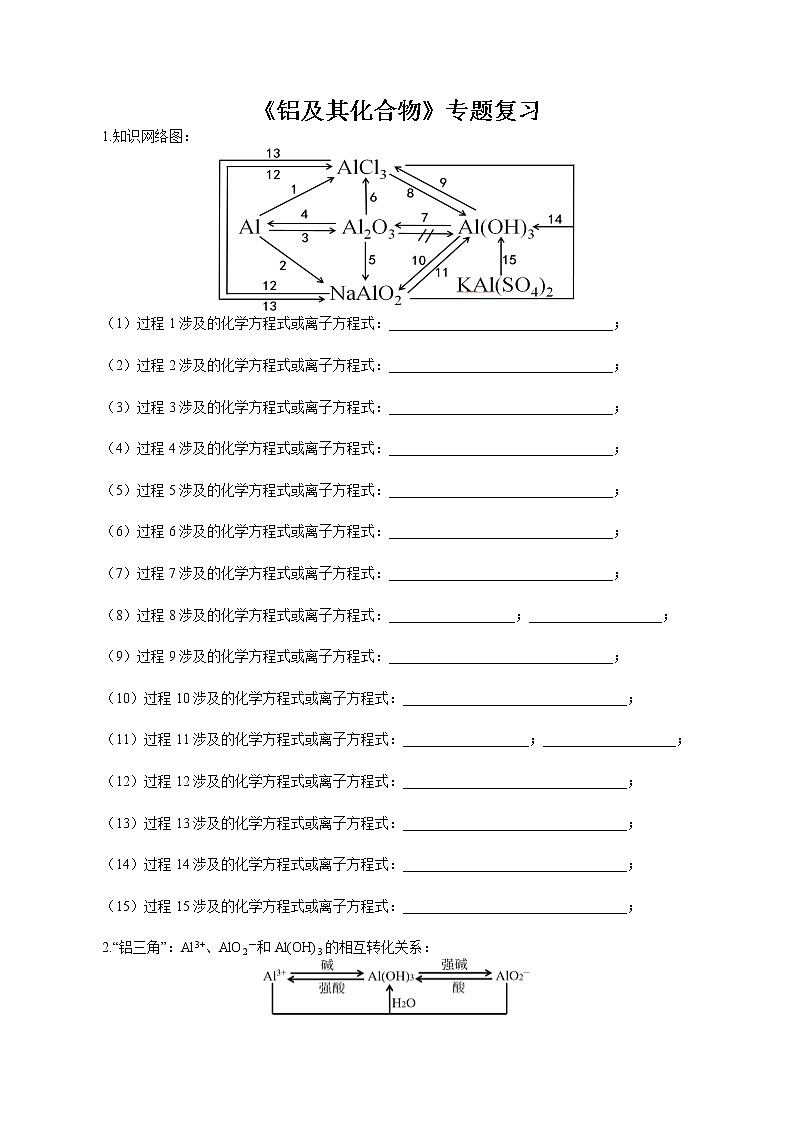
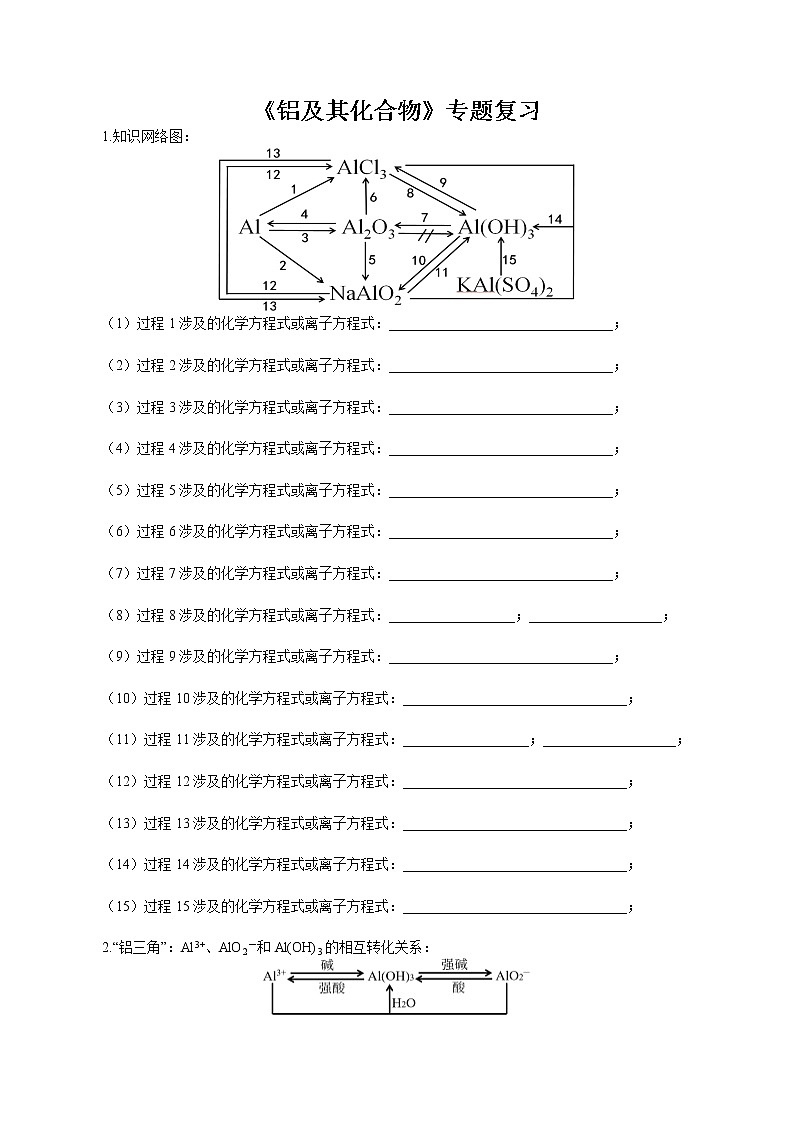
(1)过程1涉及的化学方程式或离子方程式:________________________________;
(2)过程2涉及的化学方程式或离子方程式:________________________________;
(3)过程3涉及的化学方程式或离子方程式:________________________________;
(4)过程4涉及的化学方程式或离子方程式:________________________________;
(5)过程5涉及的化学方程式或离子方程式:________________________________;
(6)过程6涉及的化学方程式或离子方程式:________________________________;
(7)过程7涉及的化学方程式或离子方程式:________________________________;
(8)过程8涉及的化学方程式或离子方程式:__________________;___________________;
(9)过程9涉及的化学方程式或离子方程式:________________________________;
(10)过程10涉及的化学方程式或离子方程式:________________________________;
(11)过程11涉及的化学方程式或离子方程式:__________________;___________________;
(12)过程12涉及的化学方程式或离子方程式:________________________________;
(13)过程13涉及的化学方程式或离子方程式:________________________________;
(14)过程14涉及的化学方程式或离子方程式:________________________________;
(15)过程15涉及的化学方程式或离子方程式:________________________________;
2.“铝三角”:Al3+、AlO2-和Al(OH)3的相互转化关系:
3.与Al3+、AlO2-有关的水解反应:
(1)Al3+的水解:__________________________________;
(2)AlO2-的水解:_________________________________;
(3)Al3+与AlO2-的双水解反应:_________________________________;
(4)泡沫灭火器的工作原理:________________________________;
(5)Al3+与S2-的双水解:___________________________________;
例1.(铝及其化合物的性质)
1.1.下列说法不正确的是( D )
A.氢氧化铝溶于强碱溶液可说明金属铝有非金属性
B. Al溶于强碱溶液涉及到Al(OH)3的弱酸性
C.不能一步反应实现:Al2O3→Al(OH)3
D.可用碳酸钠、氢氧化铝治疗胃酸过多
1.2.(2018浦东一模)生成等物质的量的NaAlO2时,下列物质消耗NaOH的量最多的是( A)
A.AlCl3 B.Al(OH)3 C.Al2O3 D.Al
例2.(离子方程式的书写)
2.下列变化中的离子方程式书写正确的是(C)
A.向氯化铝溶液中滴加过量氨水:4NH3·H2O+Al3+→AlOeq \\al(-,2)+4NHeq \\al(+,4)+2H2O
B.NH4Al(SO4)2溶液中滴加少量NaOH溶液:Al3++NHeq \\al(+,4)+4OH-→Al(OH)3↓+NH3·H2O
C.向明矾溶液中加入过量的Ba(OH)2溶液:Al3++SOeq \\al(2-,4)+2Ba2++4OH-→2BaSO4↓+AlOeq \\al(-,2)+2H2O
D.向NaAlO2溶液中通入足量CO2:2AlOeq \\al(-,2)+CO2+3H2O→2Al(OH)3↓+COeq \\al(2-,3)
例3.(铝的图像问题,包括反应的计算,难点是利用假设法判断反应的先后顺序)
3.1.如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线。下列判断错误的是(B)
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlOeq \\al(-,2)的物质的量的变化
解:AlCl3溶液与NaOH溶液混合有两种方式:向AlCl3溶液中缓慢滴加NaOH溶液,开始有沉淀生成后沉淀溶解,且生成沉淀与沉淀溶解消耗的NaOH的物质的量之比为3∶1,显然符合题意,则x表示NaOH的物质的量,B项错误;另一种方式是向NaOH溶液中缓慢滴加AlCl3溶液,开始没有沉淀,后有沉淀生成,与本题图示情况不符。
3.2.(2014上海)向含2ml NaOH、1ml Ba(OH)2、2ml NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是(B)
解:向含2 ml NaOH、1 ml Ba(OH)2、2 ml Na[Al(OH)4]的混合溶液中慢慢通入CO2发生反应依次为:
2NaOH+CO2→Na2CO3+H2O
2 ml 1 ml 1 ml
Ba(OH)2+CO2→BaCO3↓+H2O
1 ml 1 ml 1 ml
2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O
2 ml 1 ml 2 ml 1 ml
Na2CO3+CO2+H2O→2NaHCO3
1 ml 1 ml
BaCO3+CO2+H2O→Ba(HCO3)2
1 ml 1 ml
当通入2 ml CO2时,生成1 ml BaCO3沉淀;
当通入3 ml CO2时,生成1 ml BaCO3沉淀和2 ml Al(OH)3沉淀;
当通入4 ml CO2时,生成1 ml BaCO3沉淀和2 ml Al(OH)3沉淀;
当通入5 ml CO2时,生成2 ml Al(OH)3沉淀;当通入 6 ml CO2时,BaCO3已完全反应,Al(OH)3量不变,即仍为 2 ml 沉淀。
变式训练:
1.下列说法正确的是(B)
A.常温下,KAl(SO4) 2·12H2O溶于水可形成Al(OH)3沉淀
B.在0.1 ml/L NaOH溶液中,Na+、K+、CO32-、Al QUOTE O2-能大量共存 O2-能大量共存
C. Al(s)NaAlO2(aq)Al(OH)3(s)
D.因为Al2O3具有两性,所以可用于电解冶炼铝
2.(2016上海)向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是(D)
A.CO2+2OH−→CO32−+H2O B.Al2O3+2OH−→2AlO2−+H2O
C.2 Al+2OH−+2H2O→2AlO2−+3H2↑ D.Al3++4OH−→AlO2−+2H2O
3.(2013广东)下列实验的现象与对应结论均正确的是(C)
4.把X溶液逐滴滴入Y溶液中,与把Y溶液逐滴滴入X溶液中,反应现象不同的是(B)
解:A、C、D三项中,无论前者滴入后者,还是后者滴入前者,反应现象均相同;B项,若将NaAlO2溶液滴入盐酸中,开始盐酸过量,没有沉淀生成,随着NaAlO2溶液的增多,会产生Al(OH)3白色沉淀,若将盐酸滴入NaAlO2溶液中,开始盐酸少量,会立即产生Al(OH)3白色沉淀,随着盐酸的过量,最后白色沉淀逐渐溶解,反应现象不同,符合题意。
5.如图所示的装置中,把X溶液逐滴滴下与Y物质反应,若X为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单质。Z为品红溶液。实验中观察到Z褪色。则Y为(B)
A.Na B.Mg C.Al D.Mg或Al
6.将100mL 3ml/L的NaOH溶液与100mL 3ml/L的AlCl3溶液按下列两种方法混合:
(1)将NaOH溶液逐滴滴入AlCl3溶液中;(2)将AlCl3溶液逐滴滴入NaOH溶液中。
对上述实验所得结论正确的是(C)
A.现象相同,沉淀量相等 B.现象相同,沉淀量不等
C.现象不同,沉淀量相等 D.现象不同,沉淀量不等
解: n(NaOH)=0.3 ml,n(AlCl3)=0.3 ml;
①将NaOH溶液逐滴滴入AlCl3溶液中,发生:Al3++3OH-=Al(OH)3↓,产生白色沉淀,n[Al(OH)3]=0.1ml;
②将AlCl3溶液逐滴滴入NaOH溶液中,分别发生:Al3++4OH-=AlOeq \\al(-,2)+2H2O,Al3++3AlOeq \\al(-,2)+6H2O=4Al(OH)3↓,开始没有沉淀后出现沉淀,二者现象不同,根据方程式可知最终得到的沉淀是0.1ml,沉淀量相等。
7.常温下,下列各组离子在指定溶液中能大量共存的是(C)
A.中性溶液中:Cl-、Mg2+、Al3+、K+
B.1.0 ml·L-1的NaAlO2溶液中:Cl-、HCOeq \\al(-,3)、K+、Ca2+
C.在强碱性环境中:AlOeq \\al(-,2)、SiOeq \\al(2-,3)、Na+、K+
D.0.1 ml·L-1明矾溶液中:NHeq \\al(+,4)、AlOeq \\al(-,2)、HCOeq \\al(-,3)、Na+
8.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( B)
A.4种B.5种C.6种D.7种
9.向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图像的一组是(C)
解:A项,向甲溶液中缓慢滴加NaOH溶液时,图像中间一段沉淀质量不变的反应不存在,与图像变化不符。B项,向甲溶液中缓慢滴加Ba(OH)2溶液时,不存在沉淀部分溶解的反应,与图像变化不符。C项,在甲溶液中加入NaOH溶液时,NaOH先与盐酸反应,没有沉淀生成;随后Al3+、Fe3+开始沉淀,当两种离子沉淀完全后,OH-和NHeq \\al(+,4)反应,此时沉淀质量不变;最后OH-与Al(OH)3反应,沉淀部分溶解与图像变化相符。D项,向甲溶液中加硫酸时,最终沉淀会全部溶解,与图像变化不符。
10.(2014安徽)室温下,在0.2ml/L Al2(SO4)3溶液中,逐滴加入1.0ml/L NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是(C)
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
解:A项,Al2(SO4)3为强酸弱碱盐,Al3+水解使溶液显酸性,离子方程式应为Al3++3H2OAl(OH)3+3H+,错误;B项,a~b段,加入NaOH消耗H+,使Al3++3H2OAl(OH)3+3H+反应正向进行,Al3+的浓度减小,错误;C项,b~c段,pH变化不明显,说明OH-主要用于生成Al(OH)3沉淀,正确;D项,c~d过程中,pH变化较大,说明发生了反应:Al(OH)3+NaOH=NaAlO2+2H2O,所以c点以后Al(OH)3开始溶解,错误。
11.下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是(D)
A.氧化镁中混有氧化铝 B.氯化铝溶液中混有氯化铁
C.氧化铁中混有二氧化硅 D.氯化亚铁溶液中混有氯化铜
解:A项,MgO是碱性氧化物,与NaOH溶液不能反应,而Al2O3是两性氧化物,可以与NaOH溶液发生反应产生NaAlO2,过滤后洗涤,就得到纯净的MgO,向滤液中加入盐酸至沉淀达到最大量,过滤洗涤,不溶物加热得Al2O3;B项,向溶液中加入过量的NaOH溶液,氯化铁变为Fe(OH)3沉淀,氯化铝变为NaAlO2,过滤,然后向滤液中加入适量的盐酸,当沉淀达到最大值,过滤,得到Al(OH)3,再分别向两种物质的沉淀中加入适量的盐酸溶解,就分别得到氯化铝溶液和氯化铁溶液;C项,二氧化硅是酸性氧化物,能与NaOH溶液发生反应,而氧化铁与NaOH溶液不反应。加入过量的NaOH溶液,然后过滤洗涤,就得到纯净的氧化铁;D项,二者都能与NaOH溶液反应,当再向得到的沉淀中加入盐酸时,二者都溶解,而且得到FeCl3溶液,不能分离、提纯二者。
12.下列除去杂质的方法不正确的是( B)
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
13.某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示:
下列说法不正确的是(D)
A.X为NaOH溶液,Y为盐酸
B.a→b发生的反应为AlOeq \\al(-,2)+H++H2O→Al(OH)3↓
C.b→c→Al的反应条件分别为:加热、电解
D.a、b、c既能与酸又能与碱反应
解:A项,在铁粉和铝粉混合物中加入试剂X,过滤得到铁,试剂X能溶解铝不能溶解铁,X为NaOH溶液,a为NaAlO2溶液,NaAlO2和适量盐酸反应生成Al(OH)3沉淀,X为NaOH溶液,Y为盐酸,正确;B项,a为NaAlO2溶液,b为Al(OH)3,a→b发生的反应为AlOeq \\al(-,2)+H++H2O=Al(OH)3↓,正确;C项,b为Al(OH)3,Al(OH)3受热分解生成Al2O3和水,电解Al2O3生成铝和氧气,正确;D项,b为Al(OH)3,c为Al2O3,均既能与酸又能与碱反应,a为NaAlO2溶液,只能和酸反应,不能和碱反应,错误。
14.(2018全国Ⅰ)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是(D)
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用硫酸钠代替碳酸钠
解:废旧电池中含有的金属元素、电解质溶液等会对水体和土壤等造成污染,处理废旧电池有利于资源再利用,同时能够降低环境污染,保护环境,A项正确;从流程图看出,正极材料涉及了铝、铁、锂等金属, B项正确;因流程中加入的有HNO3,HNO3具有氧化性,故在含Li、P、Fe等滤液中加碱液,发生“沉淀”反应的金属离子为Fe3+,C项正确;因为锂及其化合物的性质与镁相似,由硫酸镁易溶于水推知,硫酸锂易溶于水,由碳酸镁微溶于水推知,碳酸锂微溶于水,所以不能用硫酸钠代替碳酸钠,D项错误。
15.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是(A)
A.3ml/L盐酸 B.4ml/L HNO3溶液 C.8ml/L NaOH溶液 D.18ml/L H2SO4溶液
16.甲、乙两烧杯中各盛有100mL 3ml/L盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝
粉,反应结束后测得甲、乙两烧杯中产生的气体体积之比为1∶2,则加入铝粉的质量为(A)
解:根据铝粉与盐酸、氢氧化钠溶液反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知若在含等物质的量的HCl和NaOH溶液中分别加入足量的铝粉,产生的H2的体积之比为1∶3。而题中产生的H2的体积之比为1∶2,说明铝粉的量相对盐酸是过量的,相对NaOH是不足的,则与盐酸反应的铝粉是2.7g,与NaOH溶液反应的铝粉应为5.4g。
17.a g镁铝合金投入x mL 2 ml/L的盐酸中,金属完全溶解,再加入y mL 1 ml/L NaOH溶液,沉淀达到最大值,质量为(a+1.7)g,则下列说法不正确的是(C)
A.镁铝合金与盐酸反应转移电子数为0.1NA
B.沉淀为Mg(OH)2和Al(OH)3的混合物
C.x=2y
D.a的取值范围为0.9<a<1.2
解:Mg、Al失去电子变为离子,离子再结合OH-生成沉淀,则镁铝合金与盐酸反应转移电子的物质的量等于其生成沉淀时结合的OH-的物质的量,沉淀量最大时得到Mg(OH)2和Al(OH)3的混合物,则m(OH-)=(a+1.7) g-a g=1.7 g,n(OH-)=0.1 ml,电子转移总数是0.1NA,A、B正确;沉淀量最大时,溶液中n(Na+)=n(Cl-),此时HCl和氢氧化钠的物质的量相等,即2x=y,C错误;电子转移总数是0.1NA,若金属全部是镁,则镁的质量是1.2 g,若金属全部是铝,则铝的质量是0.9 g,D正确。
18.向硫酸铝铵[NH4Al(SO4)2]溶液逐滴加入Ba(OH)2溶液,当SO42-恰好完全沉淀时,溶液中的Al元素的存在形式为_______________。Al(OH)3
19.为确定Al2(OH)nCl(6-n)中n的值,取3.490g白色固体,全部溶解在0.112ml的HNO3(足量)中,并加水稀释成100mL,将溶液分成两等份,进行如下实验:
(1)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g,判断加入氨水已足量的操作是_________________________________________________。
过滤、洗涤后至少要灼烧____________次;测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因可能是____________。
a.干燥Al(OH)3固体时易失水
b.Al2O3的质量比Al(OH)3大,误差小
c.沉淀Al(OH)3时不完全
d.灼烧氧化铝时不分解
(2)从另一份溶液中取出20.00mL,用0.129ml/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00mL,终点时滴定管液面局部如图所示(背景为白底蓝线的滴定管)。则滴定管的读数____________mL,Al2(OH)nCl(6-n)中n的值为____________。
解:(1)判断试剂已过量的方法是继续滴加,即当氨水加入过量时,取上层清液继续滴加氨水,则无沉淀生成;将所得的Al(OH)3沉淀至少灼烧2~3次,至两次质量差不超过0.1 g即说明Al(OH)3分解完全得Al2O3,不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因是干燥Al(OH)3时易分解失水,而灼烧Al2O3不失水;
(2)滴定管的0刻度在上,故滴定管的读数为18.60mL,则消耗的氢氧化钠的体积为18.60 mL;根据0.112ml HNO3的消耗有两个原因:被3.490g Al2(OH)nCl(6-n)中OH-消耗的和被0.129ml/L的标准NaOH溶液消耗的,可有:
0.112ml=eq \f(3.490 g,267-18.5ng/ml)×n+0.129 ml/L×0.018 6 L×5,解得n=5。
【答案】(1)静置,取上层清液,滴加氨水,无沉淀生成 2 ad (2)18.60 5
20.将一定质量的Mg和Al的混合物投入100mL的稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示:
(1)当加入氢氧化钠溶液的体积为20 mL时,溶液显________性(填“酸”、“碱”或“中”)。
(2)当加入氢氧化钠溶液的体积为20 mL时,溶液中的溶质有________________。
(3)NaOH溶液的物质的量浓度约为___________ ml/L(结果保留一位小数)。
(4)固体溶解时生成的气体在标准状况下的体积为___________L。
(5)稀硫酸的物质的量浓度为___________ ml/L(结果保留一位小数)。
解:(1)酸
(2)硫酸镁、硫酸铝、硫酸钠
(3)3.3
(4)6.72
(5)3.3
选项
A
B
C
D
n(CO2)/ml
2
3
4
6
n(沉淀) /ml
1
2
3
2
选项
操作
现象
结论
A
将浓硫酸滴到蔗糖表面
固体变黑膨胀
浓硫酸有吸水性和强氧化性
B
常温下将Al片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
C
将一小块Na放入无水乙醇中
产生气泡
Na能置换出醇羟基中的氢
D
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应
选项
A
B
C
D
X
NaHCO3
NaAlO2
NaHCO3
MgCl2
Y
Ca(OH)2
HCl
HCl
NaOH
选项
甲
乙
A
AlCl3、Mg(NO3)2、HNO3
NaOH
B
Na2CO3、NH4HCO3、Na2SO4
Ba(OH)2
C
NH4NO3、Al(NO3)3、Fe(NO3)3、HCl
NaOH
D
NaAlO2、氨水、NaOH
H2SO4
相关试卷
这是一份2019-2023年高考化学分类汇编 专题11 铝及其化合物,文件包含2019-2023年高考化学分类汇编专题11铝及其化合物解析版docx、2019-2023年高考化学分类汇编专题11铝及其化合物原卷版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
这是一份专题18 《定量实验》专题训练--2022年高考化学二轮复习专题冲刺(上海专用),文件包含专题18《定量实验》专题训练-教师版-2022年高考化学二轮复习专题冲刺上海专用docx、专题18《定量实验》专题训练-学生版-2022年高考化学二轮复习专题冲刺上海专用docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
这是一份专题17 《化工生产》专题复习--2022年高考化学二轮复习专题冲刺(上海专用),文件包含专题17《化工生产》专题复习-教师版-2022年高考化学二轮复习专题冲刺上海专用docx、专题17《化工生产》专题复习-学生版-2022年高考化学二轮复习专题冲刺上海专用docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。












