

高考化学二轮专题大题练习专题13《氮及其化合物》(含详解)
展开www.ks5u.com(满分60分 时间30分钟)
姓名:_______________ 班级:_______________ 得分:_______________
1.氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是________。
② 氨催化氧化生成一氧化氮反应的化学方程式是________。
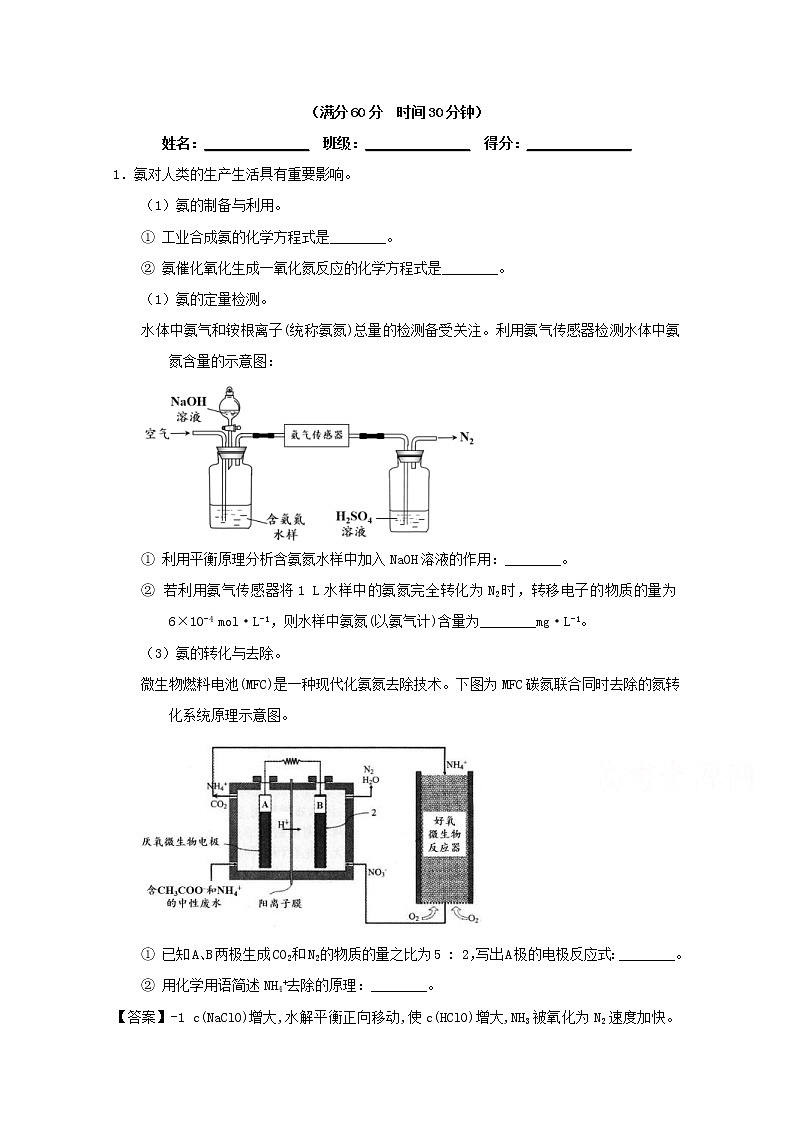
(1)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图:
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol·L-1,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:________。
② 用化学用语简述NH4+去除的原理:________。
【答案】-1 c(NaClO)增大,水解平衡正向移动,使c(HClO)增大,NH3被氧化为N2速度加快。 ClO- + H2O HClO + OH- pH较大时,c(OH-)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱,去除率降低。 pH较小时,c(H+)较大,促进NaClO水解,c(HClO)太高致HClO易分解,去除率降低。负极 Cl-- 2e- + H2O = H+ + HClO
【解析】本题考查工业上合成氨和氨催化氧化反应方程式的书写,外界条件对电离平衡的影响,氧化还原
2.某化学课外活动小组利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
(1)A和E中制取NH3的装置为_____,所用试剂为___,装置中制取NO2的化学方程式是___________________。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是______________________。
(3)实验过程中,一段时间内未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③______________。
(4)此实验装置存在一个明显的缺陷是_________________________________。
【答案】A 浓氨水和CaO(合理即可) Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 混合气体颜色变浅 在此条件下,该反应的化学反应速率极慢 缺少尾气吸收装置
【解析】
3.HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是_______________(填字母编号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是______________(填字母编号)。
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:_________________________________________________。
(4)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式_________:
FeSO4+K2O2=K2FeO4+K2O+K2SO4+O2↑
(5)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,发挥的作用是______;②_________。
【答案】D B NO2-+Cl2+H2O═NO3-+2H++2 Cl- 2 6 2 2 2 1 作强氧化剂,杀菌消毒 反应后生成Fe(OH)3胶体,起吸附杂质作用
【解析】
【分析】由题给信息可知Fe2+转化为Fe3+而中毒,服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+;甲基橙的变色范围是3.1~4.4;把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,二者发生氧化还原反应;依据化合价升降法配平化学方程式;高铁酸钾具有强氧化性,能消毒,还原产物铁离子水解生成氢氧化铁胶体,能吸附水中的悬浮物起到净水的作用。
【详解】(1)误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,说明亚硝酸盐具有
【点睛】本题综合考查铁盐和亚铁盐的相互转化,侧重于分析能力的考查,本题涉了的二价铁离子和三价铁离子的检验、化学方程式的配平等知识点,掌握化合价升降法配平化学方程式是关键。
4.一定条件下,含氮元素的物质可发生如图所示的循环转化。
回答下列问题:
(1)氮的原子结构示意图为_________。
(2)图中属于“氮的固定”的是_________(填字母,下同);转化过程中发生非氧化还原反应的是_________。
(3)若“反应h”是在NO2与H2O的作用下实现,则该反应中氧化产物与还原产物的物质的量之比为_________。
(4)若“反应i”是在酸性条件下由NO3-与Zn的作用实现,则该反应的离子方程式为_____。
【答案】 k和c a和l 2∶1 4Zn+2NO3-+10H+=4Zn2++N2O↑+5H2O
【解析】本题考查化学用语的表达、离子反应方程式的书写、氧化还原反应等,(1)N位于第二周期VA族,
高考化学二轮专题大题练习专题15《元素及化合物综合应用》(含详解): 这是一份高考化学二轮专题大题练习专题15《元素及化合物综合应用》(含详解),共8页。
高考化学二轮专题大题练习专题14《硫及其化合物》(含详解): 这是一份高考化学二轮专题大题练习专题14《硫及其化合物》(含详解),共7页。
高考化学二轮专题大题练习专题12《氯及其化合物》(含详解): 这是一份高考化学二轮专题大题练习专题12《氯及其化合物》(含详解),共7页。












